去氢骆驼蓬碱对甲状腺未分化癌患者的细胞放疗增敏作用及分子机制
2021-05-31阮舒
阮 舒
(盐城市第三人民医院内分泌科,江苏 盐城 224001)
甲状腺癌属于临床上常见疾病,与分化型甲状腺癌相比,未分化型甲状腺恶性肿瘤在甲状腺癌中的占比为1%~2%,但患者预后往往较差,生存期较短,多数患者生存期不足5个月。去氢骆驼蓬(HM)可发挥抑菌、抗肿瘤等作用[1]。PI3K/AKT信号通路以及MAPK信号通路等在甲状腺癌细胞的增殖、分化等过程中发挥重要作用[2]。有研究指出,HM能够对甲状腺癌未分化细胞化疗过程中产生一定的影响[3]。目前,关于未分化型甲状腺癌的研究较少。基于此,本研究主要从细胞层面探讨HM对甲状腺未分化癌细胞放疗增敏中的作用,从而进一步为甲状腺未分化癌治疗方法的制订提供参考。
1 资料与方法
1.1 一般资料 人未分化甲状腺癌细胞、PI3K抑制剂LY294002、PI3K激动剂IGF-1均购自南京伯特仕生物科技有限公司。
1.2 方法
1.2.1 CCK8法检测HM对于TT细胞的抑制效果 取细胞,消化后形成细胞悬液,5×104个/mL左右,96孔板,每孔100 μL,分别培养24 h、48 h和72 h。在培养前1 h,加CCK8溶液,混匀,孵育1 h,检测吸光度值。
1.2.2 免疫蛋白印迹试验(Western blot)检测HIF、PI3K、AKT、MAPK、GLUT、VEGF蛋白以及p-PI3K、p-AKT的表达 细胞接种,经PBS清洗,培养,离心,取上清液。蛋白定量,蛋白样本置于-20 ℃冰箱中,取出蛋白样本,凝胶电泳,电转移,过夜,加一抗、二抗,经TBST清洗,曝光、显影、成像。
1.2.3 实时荧光定量PCR(RT-PCR)检测HIF、PI3K、AKT、MAPK、GLUT、VEGF mRNA的表达 取细胞悬液,离心,提取总RNA,反转录出cDNA。PCR扩增:94 ℃,40 s;48 ℃,30 s;72 ℃,40 s。
1.2.4 流式细胞仪检测细胞的凋亡 取细胞,消化,6孔板,过夜,培养。24 h,PBS洗涤2次,70%乙醇固定,过夜培养。PBS,加入50 μg/mL的溴化乙锭和吖啶橙混合溶液以及10 μg/mL的R NaseA和0.2%Triton-100,避光环境孵育。采用流式细胞术进行检测。
1.3 统计学方法 采用SPSS 25.0统计学软件对数据进行分析。计量资料采用()表示,组间比较行t检验;计数资料采用[n(%)]表示,组间比较行χ2检验;P<0.05表示差异有统计学意义。
2 结果
2.1 HM对甲状腺未分化癌细胞的影响 ①HM对于TT细胞具有浓度依赖性的杀伤效果见图1。不同浓度的HM分别与TT细胞培养24 h、48 h、72 h后均显示出明显的浓度依赖性的细胞抑制效果。②HM引起TT细胞凋亡的流式细胞仪结果:15 μmol/L、30 μmol/L、60 μmol/L的HM作用于TT细胞后流式细胞仪测定凋亡细胞比例,发现随着浓度的逐渐增加,凋亡细胞的比例也逐渐增加,见图2。③Western blot检测结果:HM联合放疗组中HIF-α、PI3K、AKT、MAPK、GLUT、VEGF蛋白的表达低于单独放疗组,见图3。④RT-PCR检测结果:HM联合放疗组中HIF-α、PI3K、AKT、MAPK、GLUT、VEGF mRNA的表达低于单独放疗组,见图4。

图1 HM对TT细胞的抑制效果

图2 不同浓度HM引起TT细胞凋亡的分析
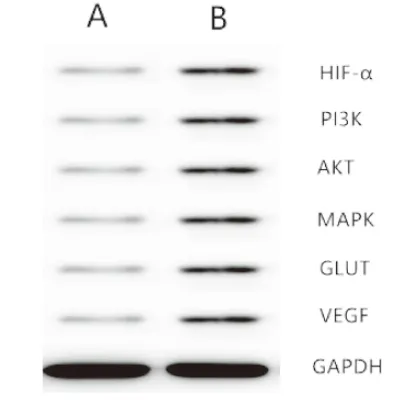
图3 Western blot检测结果
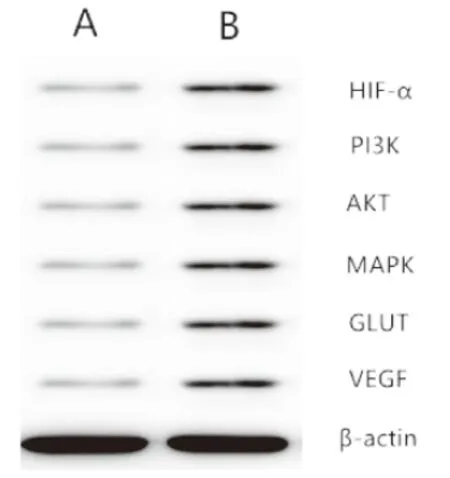
图4 RT-PCR检测结果
2.2 过表达HIF-α对甲状腺未分化癌细胞的影响 ①Western blot检测结果:HM联合放疗组中HIF-α、PI3K、AKT、MAPK、GLUT、VEGF蛋白的表达高于单独放疗组。见表1。②RT-PCR检测结果:HM联合放疗组中HIF-α、PI3K、AKT、MAPK、GLUT、VEGF mRNA的表达高于单独放疗组。见表2。
表1 两组蛋白表达结果()
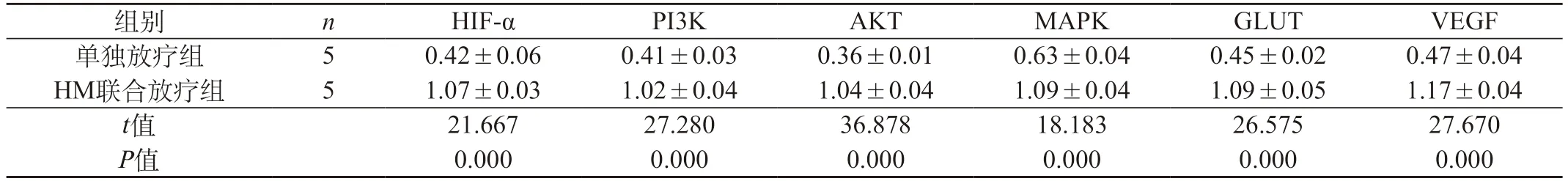
表1 两组蛋白表达结果()
表2 两组mRNA表达结果()
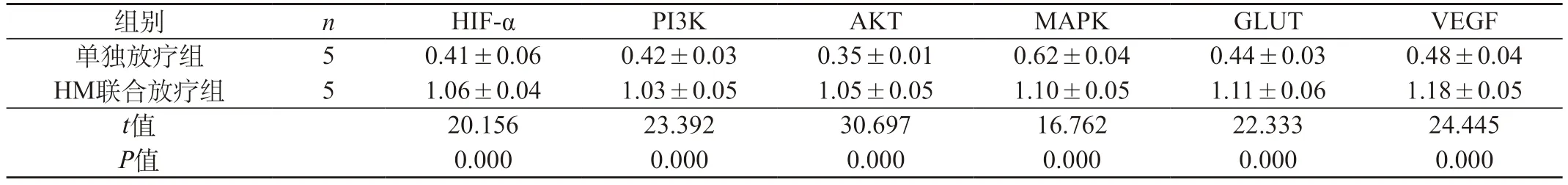
表2 两组mRNA表达结果()
3 讨 论
甲状腺未分化癌作为恶性程度较高的一种类型,预后往往较差,病死率较高[4-6]。目前已有证据表明,综合治疗能提高甲状腺未分化癌的局部控制率和存活率。放疗作为综合治疗的一种,可缓解患者的症状,延长生存期,起到姑息治疗的目的[7-8]。但由于存在严重的细胞乏氧现象,甲状腺未分化癌对放疗会产生抵抗,复发率较高。相关研究表明,甲状腺癌的肿瘤细胞处于缺氧状态,肿瘤细胞会激活一系列相关分子信号传导途径导致肿瘤细胞在适应乏氧微环境的同时,增强其侵袭性和对放化疗的抗拒性,致使疗效下降[9]。因而,这些信号传导途径中的相关分子及放射增敏成为肿瘤乏氧研究中的热点。其中,乏氧诱导因子-1(HIF-1α)备受临床的关注。相关研究指出,在细胞缺氧的环境下,HIF-1α存在多条信号通路介导其中,调控主要发生在2条信号途径,即PI3K/Akt依赖的HIF-1α蛋白稳定性调控、MEK/MAPK介导的HIF-1α反式激活功能调控[10]。
本研究结果证实了HM对甲状腺未分化癌放疗的增敏作用,HM放疗联合组HIF-1α蛋白以及mRNA的表达以及相关信号通路和下游因子等表达均呈现下降的趋势,且明显低于单独放疗组;同时,本研究过表达HIF-1α后的结果证实了HM对甲状腺未分化癌放疗的增敏作用,进一步提示HM可能主要通过抑制PI3K-AKT信号通路、MAPK信号通路等来进一步抑制HIF-1α的表达,从而抑制下游的GLUT、VEGF蛋白水平,最终提高对放疗的增敏作用。但本研究仅局限于人类甲状腺未分化癌细胞株的肿瘤模型,并非自然状态的人类未分化癌。本研究结果可能存在一定的局限性,如选取的样本量较少,研究尚且处于细胞试验,期待后续研究扩大样本量等继续进一步进行深入的研究,提高研究结果的准确性。
综上所述,在放疗过程中,与HM联用能够对放疗起到增敏作用,提高对甲状腺未分化癌细胞的毒性。
