森林草莓FveD27的表达特性和功能
2021-05-31孙洪影王岩李伟佳朱天姝姜颖许妍吴清悦张志宏
孙洪影,王岩,李伟佳,2,朱天姝,姜颖,许妍,吴清悦,张志宏✉
1沈阳农业大学园艺学院/辽宁省草莓育种与优质栽培重点实验室,沈阳 110866;2山西大同大学炭材料研究所,山西大同 037009
0 引言
【研究意义】植物株型对植物的生长发育起着十分重要的作用,其主要受遗传、植物内源激素以及温度、光周期、营养条件等内外因素共同调控,其中植物激素在株型的调节机制中具有决定性地位[1]。分枝发育不仅是决定植物株型的关键因素,还能影响其产量[2]。独脚金内酯(strigolactone,SL)是近年来在植物体内发现的调控植株生长发育和形态建成的一类新型激素,具有抑制植物分枝的显著功能[3-5]。克隆鉴定草莓SL生物合成途径中的关键基因DWARF27(D27)并阐明其生物学功能,探究FveD27在草莓分枝等生长发育过程中的作用,为提高草莓产量提供理论基础。【前人研究进展】SL是一种以类胡萝卜素为前体合成的特异性小分子萜类化合物,D27编码全反式-β-类胡萝卜素异构酶,该酶处于SL生物合成的上游[6-8]。D27的功能最早在水稻中被发现,通过对d27突变体的深入研究,发现D27具有抑制水稻分蘖的作用[9-10]。之后研究人员在拟南芥中利用反向遗传学、外源 GR24(一种以 SL为框架的人工合成物质)以及嫁接试验证实AtD27是抑制次生芽生长所必需的[11]。此外,菊花中克隆出D27的同源基因DgD27,该基因在拟南芥的异位表达降低分枝数并使突变体d27恢复至野生型表型,表明菊花DgD27对枝条分枝的调控效果[12]。小麦中也分离出TaD27,并且TaD27-7B在拟南芥的异位表达可以恢复拟南芥d27突变体的表型,说明在小麦中TaD27的功能与AtD27相近[13]。国内外学者还分别对苜蓿、森林草莓、甘蔗以及青天葵中D27的同源基因进行克隆分析,但并未揭示其生物学功能[14-17]。【本研究切入点】目前,关于 SL合成及信号传导基因的研究主要集中在拟南芥、水稻等模式植物,在草莓上的研究鲜有报道[2,15,18]。笔者课题组前期研究发现,无匍匐茎的森林草莓资源‘Yellow Wonder’的匍匐茎发生突变体(srp)的新茎数量减少,FveD27表达水平显著上调[19]。此外,外源施用 5 μmol·L-1的GR24可显著抑制森林草莓新茎分枝数量(数据尚未发表)。因此,推测FveD27具有调控草莓新茎发生的功能。【拟解决的关键问题】从森林草莓中克隆FveD27,通过在森林草莓中过表达FveD27来明确其生物学功能。
1 材料与方法
试验于2016年10月至2020年9月在沈阳农业大学园艺学院/辽宁省草莓育种与优质栽培重点实验室,以及沈阳农业大学教学科研试验基地日光温室完成。
1.1 植物材料
森林草莓(Fragariavesca)资源‘Yellow Wonder’(YW)用于基因克隆、基因表达分析和稳定遗传转化,‘Ruegen’(RG)用于 GUS组织活性试验分析。
本氏烟草(Nicotianabenthamiana)用于基因亚细胞定位。
1.2 植物核酸的提取
草莓基因组DNA以及草莓不同器官中的总RNA提取方法参照改良版的CTAB法[20]。
1.3 引物设计与合成
参考NCBI数据库(https://www.ncbi.nlm.nih.gov/)中FveD27序列设计基因全长克隆、实时荧光定量PCR与亚细胞定位所需引物;利用蔷薇科基因组数据库(https://www.rosaceae.org/)获得FveD27启动子的参考序列设计启动子克隆引物,引物设计采用Primer 5.0软件,并交由金唯智生物科技有限公司(苏州)合成。引物信息见表1。
1.4 基因编码区扩增
使用TaKaRa公司的反转录(RT)试剂盒将森林草莓 YW 幼叶提取的总 RNA反转录为 cDNA,以cDNA为模板通过PCR扩增FveD27编码区,反应体系为 20 μL:cDNA 0.5 μL、上下游引物(FveD27-F/R)各 0.5 μL、10×LA Buffer 2 μL、dNTP 1.6 μL、LA Taq Buffer(Mg2+)0.2 μL、ddH2O 14.7 μL。反应程序为:95℃ 3 min;95℃ 30 s,60℃ 30 s,72℃ 1 min,32个循环;72℃ 7 min。将电泳检测正确的产物回收纯化,并连接pMD18-T,转化大肠杆菌Trans 5α,筛选阳性克隆并测序,将序列比对正确的载体命名pMD-T-FveD27。
1.5 生物信息学分析
用蛋白质系统分析工具(http://web.expasy.org/protparam/)分析FveD27的理化参数;TMHMM跨膜分析在线软件(http://www.cbs.dtu.dk/services/TMHMM/)预测 FveD27蛋白跨膜情况,参考 NCBI数据库(https://www.ncbi.nlm.nih.gov/),查找不同物种中FveD27的同源基因,用DNAMAN 6.0软件对其氨基酸序列进行对比分析;并用MEGA 6.0软件完成系统进化树的绘制。
1.6 亚细胞定位
通过Plant-mPLoc软件(http://www.csbio.sjtu.edu.cn/bioinf/plant-multi/)在线预测森林草莓FveD27的亚细胞定位。以重组质粒 pMD-T-FveD27为模板,用FveD27(eGFP)-F/R引物(表1)克隆获得去除终止子的FveD27目的片段,与双元表达载体pRI101-AN-eGFP连接获得融合表达载体pRI101-FveD27-eGFP。参照冻融法[21]将质粒 pRI101-AN-eGFP(对照)和 pRI101-FveD27-eGFP分别转化农杆菌GV3101。利用注射法[22]进行烟草叶片瞬时表达,之后应用TCS SP8激光共聚焦显微镜(Leica,德国)检测烟草叶片中绿色荧光蛋白(GFP)的表达情况。
1.7 基因表达分析
以转录水平稳定性较好的森林草莓26S为内参基因,利用qRT-PCR分析FveD27在森林草莓‘YW’不同组织(成熟叶、幼叶、叶柄、茎尖和根)中以及野生型与过表达转基因植株中的表达水平。本试验采用SYBR Green荧光染料法,反应体系为10 μL:5 μL SYBR Green mix、引物(FveD27-DL-F/R 与Fve-26S-F/R)各 0.5 μL、cDNA 0.5 μL、RNase-free H2O 3.5 μL。使用QuantStudioTM6Flex荧光定量仪(Applied Biosystems,美国),qRT-PCR反应设置程序为二步法:95℃ 10 min;95℃ 15 s,60℃ 1 min,95℃ 15 s,40 个循环;60℃ 1 min,95℃ 15 s。参考 2-ΔΔCT法[23]对PCR结果进行分析,每个样品进行3次生物学重复与3次技术重复。
1.8 启动子克隆与分析
以森林草莓‘YW’幼叶DNA为模板,proFveD27-F/R为引物(表1),进行FveD27启动子序列的克隆。将PCR产物纯化与pMD18-T构成重组质粒并测序。将测序成功的阳性克隆重组质粒命名pMD-T-proFveD27。利用 PlantCARE软件对克隆得到的FveD27启动子顺式作用元件进行在线预测分析。

表1 本试验所用引物Table 1 Primers used in this study
1.9 FveD27启动子与GUS融合载体及FveD27过表达载体的构建
利用限制性内切酶PstⅠ与XbaⅠ对 pMD-T-proFveD27以及双元表达载体 pRI201-AN-GUS同时进行双酶切,之后再利用T4 DNA连接酶连接载体与目的片段,使FveD27启动子替换双元 pRI201-ANGUS中 CaMV35S启动子序列,得到植物融合载体pFveD27::GUS。
使用限制性内切酶SmaⅠ与KpnⅠ,对 pMD-TFveD27以及空载pRI101-AN同时进行双酶切,之后利用T4 DNA连接酶将两者进行连接得到过表达载体pRI101-FveD27。
1.10 草莓遗传转化
将pFveD27::GUS与pRI101-FveD27植物表达载体转入农杆菌 GV3101中用于森林草莓的遗传转化。森林草莓叶片遗传转化方法采用叶盘法[24]。经农杆菌浸染后,外植体经共培养、推迟培养、卡那霉素(Kan)抗性选择培养3个阶段获得再生抗性芽。待抗性芽长成单株,进行转化植株叶片的Kan抗性试验以及DNA目的片段扩增的阳性植株筛选[25]。
1.11 GUS组织化学染色
将野生型与 pRI201-FveD27-GUS转基因阳性植株不同组织浸入 GUS染液(磷酸钠缓冲溶液、K3[Fe(CN)6]溶液、K4[Fe(CN)6]溶液、Na2EDTA、Triton-100溶液、蒸馏水以及现用现加X-Gluc),用锡箔纸做好避光处理,37℃黑暗条件下染色12—16 h,然后加入无水乙醇进行脱色反应,利用体视显微镜(OLYMPUS,日本)观察试材的染色情况[26]。
1.12 转基因植株的表型观察与分析
转基因植株和非转基因对照植株移栽到沈阳农业大学教学科研试验基地日光温室,培养条件为白天20—25℃,夜间12—15℃,相对湿度60%—70%,基质栽培配比是珍珠岩、蛭石、蚯蚓粪与草炭为 1∶2∶2∶4。选长势健壮的转基因和对照植株各10株,统一编号后用直尺、电子游标卡尺等工具进行植物学性状调查。调查指标:株高、冠径、新茎分枝数、叶片数、叶柄直径、花序数等[27]。
1.13 数据统计分析
运用DPS 9.5软件中的Duncan算法对植物学性状调查部分数据进行差异性分析。
2 结果
2.1 FveD27的克隆及生物信息学分析
以FveD27-F/R为引物通过RT-PCR扩增出长度为789 bp的FveD27编码区序列(图1-A),编码262个氨基酸。扩增序列与突变体srp转录组测序拼接的FveD27序列[19]长度一致(图2),但是比NCBI中森林草莓‘Hawaii 4’的FveD27(XM_011460303.1)编码区少3个碱基。预测的FveD27编码蛋白的分子量和理论等电点分别为29.45 kD和8.35 kD;包含20种氨基酸,正电氨基酸32个,负电氨基酸29个;不稳定性指数为49.90,属不稳定蛋白,且亲水性平均系数(GRAVY)为-0.257,属亲水蛋白。TMHMM在线网站分析结果表明FveD27不属于跨膜蛋白。FveD27与其他植物D27相似,具有保守的‘DUF4033’结构域(图 3-A,3-B黑框内),该结构域家族存在于细菌和真核生物中,但其功能尚未明确。系统发育关系分析结果(图4)表明,FveD27与蔷薇科苹果中MdD27蛋白的亲缘关系最近,而与拟南芥中AtD27蛋白的亲缘关系较远。
2.2 FveD27亚细胞定位
Plant-mPLoc软件在线预测结果表明FveD27定位在叶绿体。为验证该结果,本研究在本氏烟草叶表皮细胞中进行 FveD27的瞬时表达分析。结果如图 5,pRI101-AN-eGFP空载侵染的烟草细胞中,绿色荧光蛋白均匀分布在细胞核、细胞膜以及细胞质(图 5-A—D),pRI101-FveD27-eGFP侵染的烟草细胞中,融合蛋白主要在叶绿体中表达(图5-E—H),该结果与Plant-mPLoc软件预测一致,表明FveD27定位于叶绿体。
2.3 FveD27表达特性
以森林草莓‘YW’的成熟叶、幼叶、叶柄、茎尖、根为试材,经qRT-PCR定量分析不同组织器官中FveD27的表达水平。结果表明,FveD27在草莓不同组织器官中表达量有明显差异,主要在幼叶与茎尖中表达,而在叶柄与成熟叶中表达量次之,在根中表达量最低(图6)。
以森林草莓‘YW’的幼叶 DNA为模板,利用PCR扩增出长度为1 670 bp的FveD27启动子序列(图1-B),该序列不包括转录本中的5′UTR。为进一步探索FveD27启动子在转录水平的调控机制,本研究采用PlantCARE在线数据库对FveD27启动子区域进行分析。结果显示(表2):FveD27启动子序列中,除了含有大量的 TATA-box核心启动元件、CAAT-box启动子和增强子共同顺式作用元件外,还包含了3大类顺式作用元件:(1)光响应元件;(2)环境胁迫响应元件,涉及MYB、干旱以及缺氧、厌氧;(3)激素响应元件,包括水杨酸、赤霉素与茉莉酸甲酯。因此,FveD27可能受到光信号、激素信号和逆境胁迫的调控,并参与草莓植株的生长发育。
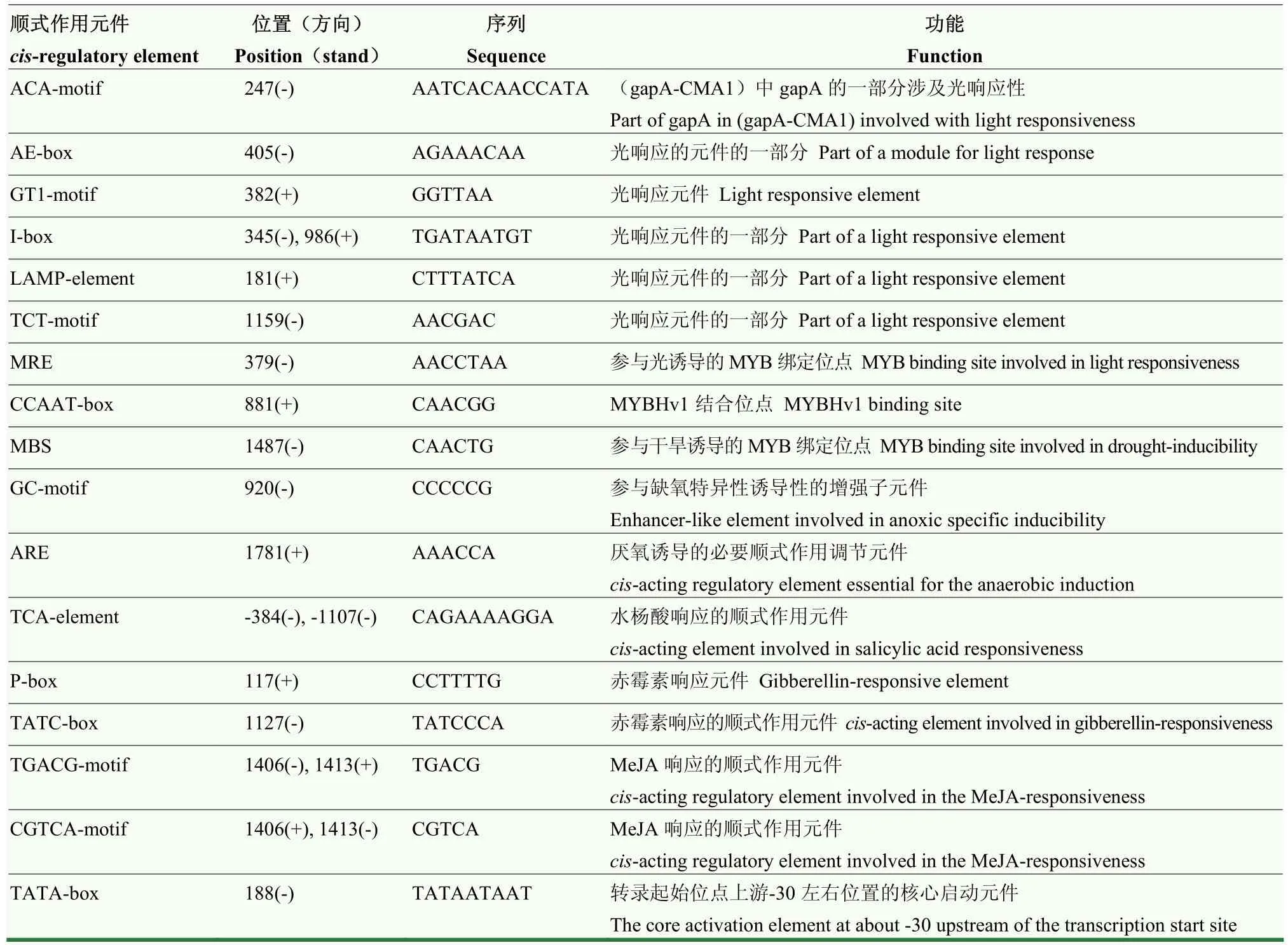
表2 FveD27启动子相关顺式作用元件的预测Table 2 Prediction of cis-acting elements related to FveD27 promoter
为了进一步明确FveD27在草莓植株中的表达特性,将pRI201-FveD27-GUS载体进行森林草莓遗传转化,然后对野生型与转基因试管苗植株进行GUS组织化学染色分析。与对照植株相比(图7-A—D),转基因植株的幼叶、芽等幼嫩部位(图 7-F)蓝色明显,成熟叶(图7-E)与叶柄(图7-G)只有部分被染成蓝色,而根部几乎无显色(图7-H)。GUS染色结果与qRT-PCR(图6)结果一致,表明FveD27在幼叶与茎尖中表达水平较高。
2.4 FveD27的功能分析
为了确定FveD27在森林草莓中的功能,本研究构建了FveD27过表达载体并利用农杆菌进行森林草莓的遗传转化,获得2个FveD27过表达转基因株系。qRT-PCR数据显示,转基因株系中FveD27表达量是非转基因对照植株的16.6—52.2倍(图8)。
为了揭示FveD27的生物学功能,将转基因株系(T0代)和非转基因对照植株同时移栽并在温室中培养。对移栽40 d(处于营养生长期)的野生型与转基因植株进行植物学性状调查(图 9),结果显示该时期的转基因植株与对照植株相比,株高并无显著差异,冠径增加,第三叶面积增大,叶柄直径加粗,叶片数减少,新茎分枝数减少。
为了进一步探究FveD27在草莓生殖生长阶段的影响,对生殖初期的野生型与转基因植株进行调查。如图10所示,在株高上,野生型与转基因植株两者间依旧未表现出明显不同,相比于对照,该阶段的FveD27过表达株系冠径减小,叶片数减少,新茎分枝数减少,并且转基因株系的花序数量明显增多。此外,对T1代转基因植株的表型也进行了初步观察,结果显示T1代转基因植株也表现出新茎分枝减少的表型(图11)。
3 讨论
3.1 FveD27抑制草莓分枝的可能机制
分枝发育是决定植物株型的一个主要因素,对于蔷薇科果树的植株结构有着重要意义。关于D27抑制分蘖分枝的研究在水稻、拟南芥等模式植物中发现并验证[9-11]。本研究中,FveD27过表达株系可以显著抑制草莓新茎分枝数量,确定了该基因在高等植物中的功能保守,但其作用机制尚不清楚,为此,笔者希望在 SL抑制分枝研究结果中找到一些线索。一种为生长素极性运输理论,当D27过量表达后,相对减弱的生长素极性运输导致根部分泌出大量SL,从而加强分蘖芽向外生长的抑制作用。然而 SL的生物合成需要受其内、外部环境条件的协同作用,植物可能利用影响SL合成基因的转录来调节SL的合成和分泌[28-29]。最新研究成果阐述了 SL影响生长素运输通道相关过程,SL干扰生长素对PIN极性靶向,是创伤后维管系统再生的关键调节剂[30]。第二种为腋芽形成与生长机制,植物分枝分蘖的过程一般包括腋芽的形成以及生长两个主要阶段[31],首先是腋芽在叶腋处形成,然后由腋芽直接或间接的生长形成分蘖或分枝,之间存在短时间的休眠期,并通过激素类物质将其打破,推测该激素物质主要是 SL,其协同生长素(抑制腋芽产生)、细胞分裂素(促进分枝)一起诱导休眠期腋芽成枝构型[32-34]。近期,LUO等[35]在水培种植的水稻上使用高度空间分辨的原位杂交和转录组学的组合在腋芽休眠过程中取得新进展,发现 SL功能主要作用于腋芽的叶原基,并且脱落酸ABA参与SL介导的腋芽休眠,细胞分裂素CTK及ABA促进早期腋芽休眠,从而影响植物分枝;DUAN等[36]发现在水稻中SL能快速激活细胞分裂素氧化酶/脱氢酶 OsCKX9,即 SL通过OsCKX9调控CTK信号传导通路,直接激活CTK分解代谢以调节水稻的分枝。上述研究进一步完善了多种激素协同调控分枝的网络机制,这与FveD27启动子作用元件分析结果相吻合(表 2),由此推测本研究中FveD27过表达株系间表型的差异性可能由相关激素间的互相作用与串扰引起,这一复杂关系网络还需进行深入研究。
3.2 FveD27对开花的调控作用
目前为止,关于 SL的研究主要集中在植物的营养生长阶段,比如:拟南芥或水稻中的下胚轴长度、根结构、枝条分枝、茎伸长、叶形等形态发生与抗逆性中的作用[37-40]。然而,对 SL在植物生殖生长中的作用知之甚少。有研究表明,与腋芽形成相关的LBD蛋白家族,其主要表达在腋芽萌动、器官形成以及侧生与顶端分生组织边界形成等方面,拟南芥中LBD蛋白家族的ASL1调控茎和花序的发育,从而影响侧生分生组织的生成[41-42],这与FveD27过表达株系中生殖生长初期阶段叶柄直径增加、花序数增加等方面的表型相近,推测D27可能与腋芽形成有关的基因存在某种未知的联系,在表型调查过程中还发现转基因植株表现早花特性,转基因#1与#2株系比对照的开花时间提前5—7 d。此外,WU等[18]确定SL相关基因在发育中的心皮和花柱中高表达,并参与森林草莓果实发育的早期阶段,这些结果说明SL也作用于植物开花及果实发育等过程,为本研究提供了新的方向。
综上所述,本研究表明了 SL生物合成基因FveD27不仅有抑制草莓新茎分枝的作用,而且还影响其花序数量。通过分析讨论该基因抑制分枝的可能作用机制,以及结合当前相关领域的最新研究结果,本研究找到了一条可能调控草莓株型,提高草莓产量的新思路,以期在接下来的试验中展开深入研究。
4 结论
从森林草莓中克隆出编码区为789 bp的FveD27序列,该基因在森林草莓的幼叶与茎尖等幼嫩部位表达量较高。FveD27定位在叶绿体。过表达FveD27的森林草莓转基因株系表型揭示FveD27具有抑制新茎分枝的功能。
