EGCG 通过作用IL-6抑制前列腺癌侵袭转移的机制研究
2021-05-31陈照新何泳贤罗金泰
陈照新,何泳贤,张 晓,罗金泰
(1.广州市番禺区市桥医院泌尿外科,2.护理部,广东 广州 511400;3.广州市番禺区东环街社区卫生服务中心,广东 广州511492;4广州医科大学附属第一医院泌尿外科,广东省泌尿外科重点实验室,广东 广州 510230)
前列腺癌是常见的恶性肿瘤,死亡率位于癌症相关死亡的第五位。2018年,在全球范围内,前列腺癌新增病例近130万,死亡人数达35.9万[1]。目前,前列腺癌治疗方案包括根治性手术、雄激素剥夺治疗、放疗和化疗等,但大多数患者因肿瘤远处转移仍然呈现不良预后[2]。因此,探索前列腺癌新的药物治疗已成为现阶段研究的焦点。
流行病学调查表明,饮用绿茶能够降低肿瘤的发生。多项研究结果表明,饮用绿茶明显降低前列腺癌发病率[3,4]。Meta分析结果亦表明,每天饮用绿茶可明显降低患前列腺癌风险[5]。茶多酚作为绿茶中含量最多的活性物质,其有效单体成分是儿茶素。表没食子儿茶素没食子酸酯(EGCG)则是含量最丰富、活性最强的儿茶素。近年来,许多研究表明,EGCG能显著抑制皮肤癌、乳腺癌、结直肠癌、肝癌和肺癌等肿瘤的进展[6]。本研究主要探讨EGCG抑制前列腺癌PC3和C4-2细胞迁移和转移的影响及其潜在作用机制。
1 材料与方法
1.1 实验材料
人雄激素非依赖性前列腺癌细胞PC3和C4-2购买于中国科学院上海生命科学研究院;EGCG购买于上海华壹生物有限公司;DMEM培养基、RPMI-1640培养基、胎牛血清、胰酶均购买于美国Gibco公司;Transwell小室购买于美国Corning公司;IL-6 酶联免疫吸附测定试剂盒 (ELISA) 购买于美国eBioscience/San Diego公司。
1.2 细胞培养
PC3、C4-2细胞均在含10%胎牛血清的RPMI-1640中培养,于37 ℃、5% CO2培养箱中培养,取处于对数生长期的细胞进行实验。
1.3 划痕实验
前期研究结果表明,最佳EGCG处理细胞浓度为20 μmol/L[7]。实验分为正常对照组和EGCG处理组。PC3和C4-2细胞传代于6孔板中,处理组中加入20 μmol/L EGCG,培养至细胞融合。用200 μL枪头在6孔板中间均匀用力的划十字架,用PBS洗去漂浮的细胞,然后加入无血清培养基。分别于0和48 h在倒置显微镜下拍照。
1.4 Transwell 侵袭实验
采用Transwell实验检测EGCG对前列腺癌细胞迁移和侵袭能力的影响。将稀释Matrigel铺于Transwell小室用于检测细胞侵袭实验,未铺Matrigel的Transwell小室用于检测细胞迁移实验。加入EGCG后处理48 h后,细胞消化离心后用无血清培养基重悬配置成浓度为2.5×105/mL细胞悬液;在Transwell下室内加入含10%FBS的培养基750 μL,上室加入细胞悬液200 μL(5×104个细胞),放置细胞培养箱,PC3细胞培养48 h,C4-2细胞培养72 h;培养时间结束后,取出Transwell小室,吸弃小室内培养基,用PBS洗涤2次;甲醇固定15 min,PBS洗涤2次; 0.4%的结晶紫染色15 min,吸弃小室内结晶紫,PBS洗涤2次,用棉签擦去小室内未穿过的细胞,晾干;倒置显微镜下观察计数穿过细胞,随机选取5个视野,计算平均值。
1.5 ELSIA检测细胞上清液中IL-6的蛋白表达水平
Wash buffer洗涤实验孔,每孔加100 μL Assay buffer,每孔加100 μL标准品,空白对照孔加100 μL Assay buffer,EGCG组孔加收集的50 μL细胞上清液;对照孔和EGCG组孔中均加50 μL Biotin-conjugate,室温静置2 h,Wash buffer 洗涤3次;随后,对照孔和EGCG组孔加入100 μL HRP,室温静置1 h;对照孔和EGCG组孔加100 μL的TMB substrace sodium,室温孵育15 min;对照孔和EGCG组孔加入100 μL终止液(stop solution),最后在酶标仪上450 nm的波长下检测吸光度。
1.6 RT-qPCR 检测 E-cadherin、Vimentin、IL-6表达
用Trizol法提取各组细胞的总RNA,检测其浓度后逆转录成为cDNA,并以此为模板进行RT-PCR扩增,利用2-△△CT法进行相对定量。以 GAPDH为内参基因,基因引物及其序列如下:E-cadherin:上游引物:5′- TCCTCCCAATACATCTCCCTTCA-3′;下游引物5′- TCTCCGCCTCCTTCTTCATCATA-3′;Vimentin:上游引物:5′-TTCGCCAACTACATCGACAAGG-3′;下游引物:5′-TTCAAGGTCAAGACGTGCCAG-3′;IL-6:上游引物:5′-CCTGAACCTTCCAAAGATGGC-3′;下游引物:5′-TTCACCAGGCAAGTCTCCTCA-3′;GAPDH:上游引物:5′-CCATCACTGCCACCCAGAAGAC-3′;下游引物:5′-GTGTCGCTGTTGAAGTCAGAGGAGA-3′。
1.7 Western blot检测E-cadherin、Vimentin、IL-6蛋白表达
收集对数生长期细胞,加入细胞裂解液100 μL,冰上裂解10 min,刮下细胞,超声吹打,4 ℃ 13 000 r/min离心 20 min,吸取蛋白上清,用 BCA 法蛋白定量,调整至相同蛋白浓度,100 ℃浴煮10 min,上样,10% SDS-PAGE凝胶电泳 90V 120 min,转膜 100V 100 min,5%脱脂奶粉封闭条带 室温2 h,随后一抗4 ℃孵育过夜,TBST缓冲液洗3次,每次5 min,加入荧光二抗,室温下孵育2 h,TBST缓冲液洗3次,每次5 min,最后在 Image Studio 上进行条带扫描,以 E-cadherin、Vimentin、IL-6 蛋白与内参GAPDH比值表示其相对表达量。
1.8 统计学方法
所有试验均独立重复3次,应用GraphPad Prism 5软件进行分析,计量资料以均数±标准差表示,两组比较采用两独立样本t检验,P<0.05为差异有统计学意义。
2 结果
2.1 细胞形态学变化
EGCG处理细胞后,在倒置显微镜下观察细胞形态学变化,如图1所示,PC3和C4-2细胞形态上从长梭形变为椭圆形,从松散变为聚集;细胞形态学结果表明EGCG能够逆转前列腺癌细胞上皮间质转化(EMT)过程。

图1 EGCG对PC-3和C4-2细胞形态学变化的影响
2.2 划痕实验
如图2所示,经20 μmol/L EGCG处理48 h后,PC3和C4-2细胞的迁移能力均显著低于对照组的PC3和C4-2细胞 (P=0.003,P=0.006)。
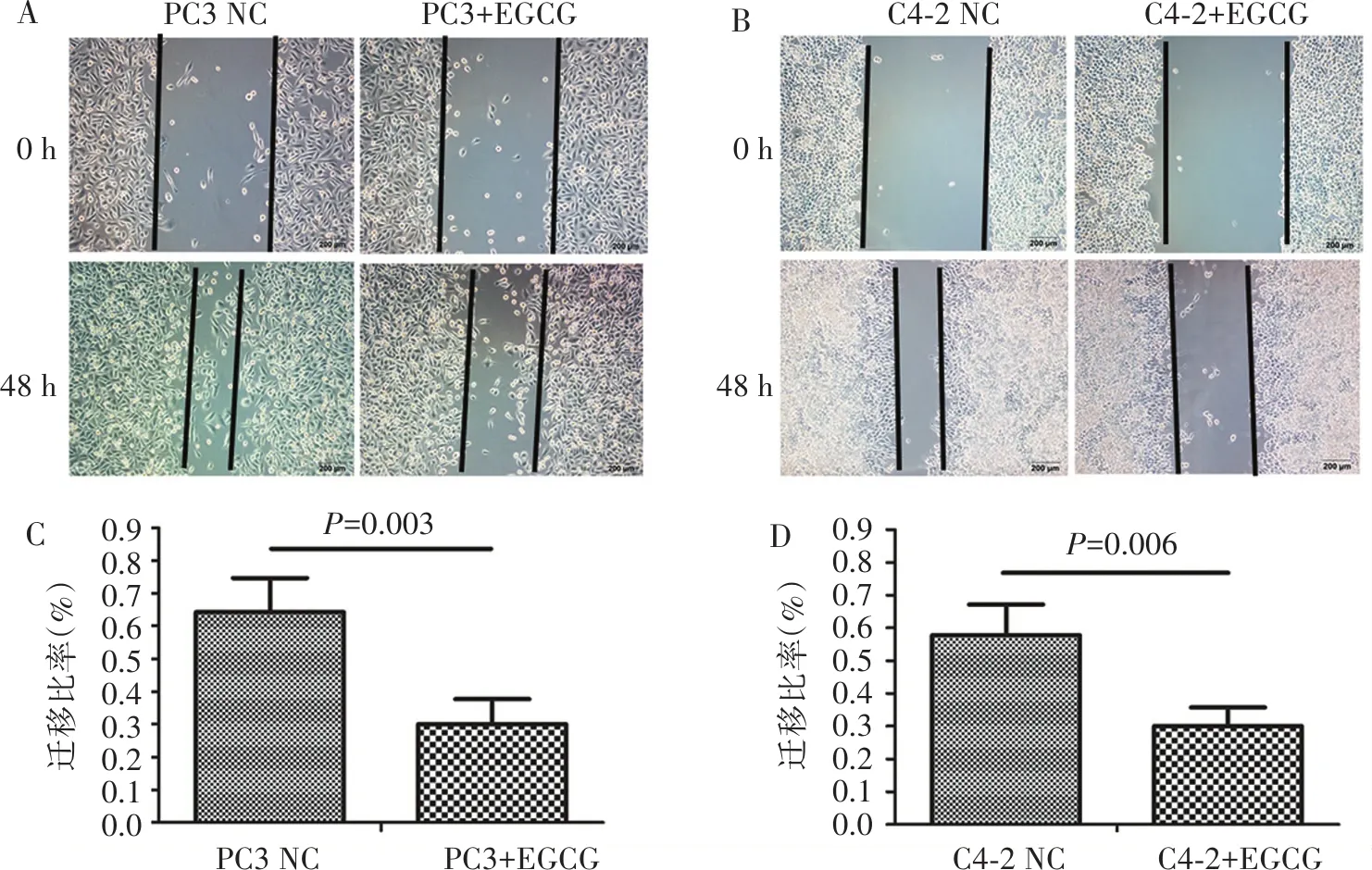
图2 EGCG对PC-3和C4-2细胞迁移能力的影响
2.3 Transwell 实验
如图3所示,EGCG处理后PC3和C4-2细胞迁移能力显著减弱(P=0.001,P=0.000)。EGCG处理后PC3和C4-2细胞侵袭能力亦明显下降(P=0.000,P=0.000)。
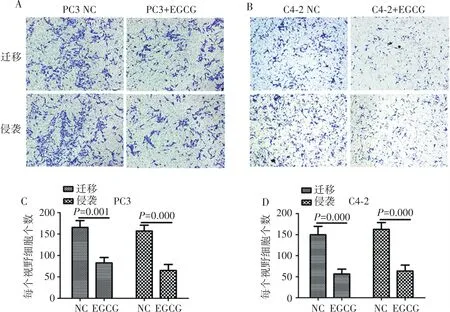
图3 PC-3和C4-2细胞transwell实验结果
2.4 RT-PCR 和 Western blot 检 测 细胞EMT 相关 Marker 表达的变化
以GAPDH作为内参基因,对照组E-cadherin、Vimentin基因表达作为100 %表达,如图4所示, EGCG处理组PC3和C4-2细胞E-cadherin基因表达较对照组显著升高(P=0.006,P=0.008),而EGCG处理组PC3和C4-2细胞Vimentin基因表达较对照组显著降低(P=0.003,P=0.006)。Western blot结果显示,与对照组相比,EGCG处理组细胞E-cadherin蛋白表达显著升高(P=0.009,P=0.004),Vimentin基因表达较对照组显著降低(P=0.006,P=0.003)。
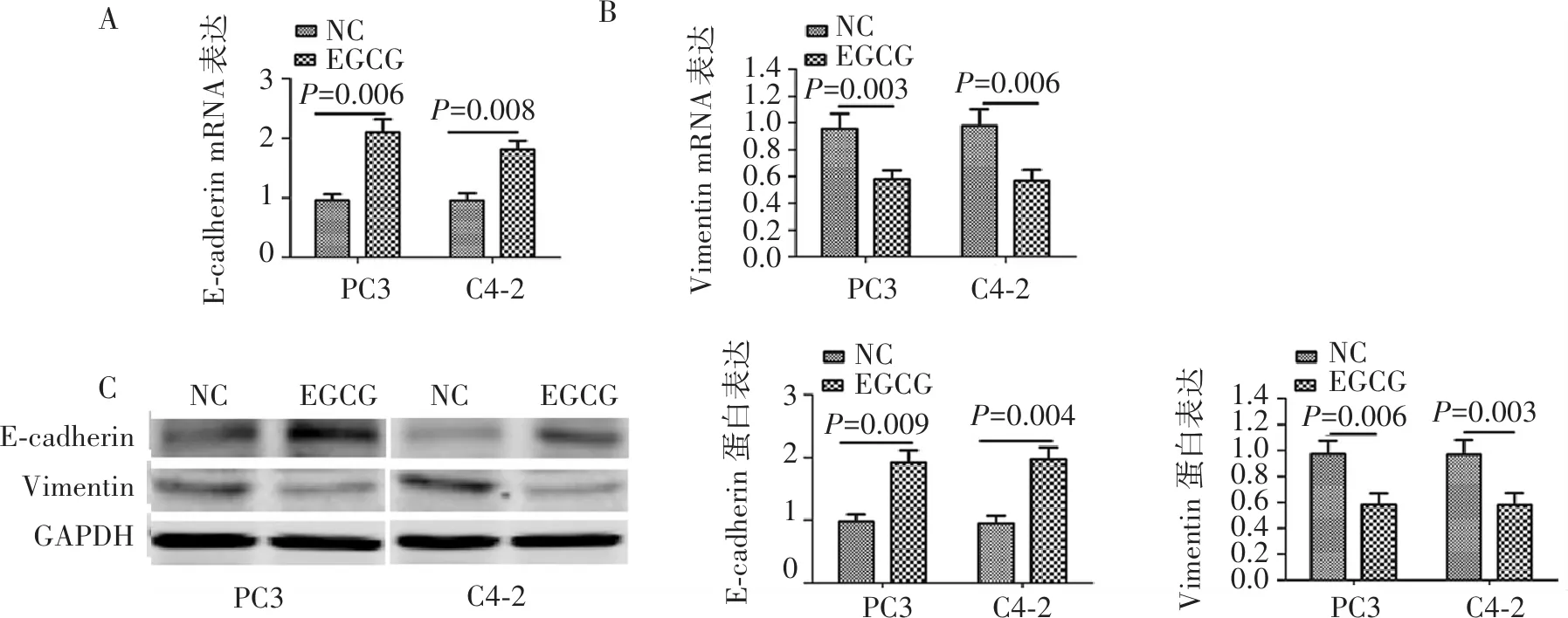
图4 PC-3和C4-2细胞上皮间质转化实验结果
2.5 ELISA 、RT-PCR 和 Western blot 检测IL-6表达
如图5所示,ELISA实验结果显示,EGCG处理后的PC3和C4-2细胞IL-6表达水平较对照组显著下降(P=0.000,P=0.000)。PCR结果表明,EGCG处理后的PC3和C4-2细胞IL-6表达水平较对照组明显下降(P=0.002,P=0.000)。Western blot结果显示,与对照组相比,EGCG处理后的PC3和C4-2细胞IL-6表达明显下调(P=0.000,P=0.000)。
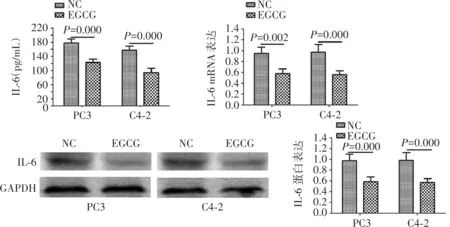
图5 EGCG处理后PC-3和C4-2细胞IL-6表达变化
3 讨论
前列腺癌是欧美国家中老年男性最常见的恶性肿瘤,在亚洲国家,前列腺癌的患病率也在逐渐增加。前列腺癌起病隐匿,很多患者在确诊前列腺癌时已是肿瘤晚期,失去了根治性治疗的机会,大多数转移性肿瘤患者采取内分泌治疗,然而经过一定时间的内分泌治疗之后将转变为去势抵抗性前列腺癌,此时治疗方法十分有限且预后很差。
EGCG是儿茶素中含量最高、活性最强的单体成分。许多研究表明,EGCG具有清除活性氧、抗肥胖、预防糖尿病、预防心血管疾病等生物功能。此外,研究证实EGCG在肿瘤的预防及治疗方面具有一定的功效[6]。在本研究中,通过划痕实验和Transwell实验发现,EGCG处理后PC3和C4-2细胞的迁移和侵袭能力明显下降;通过EGCG处理前后的细胞形态变化进行观察发现,EGCG处理后PC3和C4-2细胞从松散变为聚集、长梭形变为圆形。研究表明,IL-6在多种肿瘤组织中表达增高,从而诱导肿瘤细胞上皮间质转化,导致肿瘤细胞迁移、侵袭能力增加[8-10]。由于上皮细胞间紧密连接,间质细胞松散,缺乏细胞连接,细胞与基底膜粘附减弱,获得了游走迁移和侵袭能力[9]。本研究进一步采用PCR和Western blot进行检测,结果显示,EGCG处理后的细胞上皮间质转化相关标志物细胞粘附分子(E-cadherin)表达明显上调,波形蛋白(Vimentin)表达明显下调。这说明,EGCG可能通过抑制前列腺癌细胞上皮间质转化,从而减弱肿瘤的迁移和侵袭能力。
白细胞介素-6(IL-6)是一种多效性细胞因子,炎症细胞和肿瘤细胞都可以分泌IL-6,作为自分泌和旁分泌增殖刺激因子,参与免疫和炎症反应。与正常前列腺组织相比,局限性前列腺癌中IL-6蛋白表达增加约18倍;IL-6表达水平对晚期前列腺患者的预后有重要的生物学意义[11]。李林等[12]研究结果也表明,前列腺癌中IL-6表达水平明显高于正常前列腺组织,且其表达水平与前列腺癌的临床分期、分化程度、有无淋巴结转移等密切相关。已有研究证实IL-6能够诱导上皮间质转化发生[8]。因此,本研究进一步探讨EGCG逆转前列腺癌细胞上皮间质转化是否与IL-6表达有关,结果显示,EGCG处理后,PC3 和C4-2细胞IL-6表达显著低于对照组,这表明 EGCG能够有效降低前列腺癌细胞中IL-6表达,抑制前列腺癌细胞EMT,从而减弱肿瘤的迁移和侵袭能力。
综上所述,EGCG抑制前列腺癌细胞迁移和侵袭,可能与其通过抑制细胞IL-6表达进而抑制上皮间质转化的发生有关,这有望为EGCG抗前列腺癌提供新的实验依据。
