晕厥患者不良事件的危险因素分析及建立新CANES 风险预测评分
2021-05-29梁燕李秀莲刘文玲李广平刘彤
梁燕,李秀莲,刘文玲,李广平,刘彤
晕厥为一过性全脑血液低灌注导致的短暂意识丧失(TLOC),其特点为发生迅速、一过性、自限性并且能够完全恢复[1]。人群晕厥发病率高,预估终生累积发病率为30%~40%[2]。研究发现,以晕厥为主要症状的患者占急诊科就诊总人数的0.8%~2.4%,其中约30%的晕厥患者最终住院治疗[3-4]。晕厥的病因繁多,可能为良性疾病所致,也可能由危及生命的室性心律失常等引发,早期识别存在不良事件风险的高危晕厥患者非常重要。我国晕厥的诊疗流程不统一,缺乏规范化管理[5]。目前,已有多个晕厥危险分层评分用于预测晕厥患者的短期和长期不良预后,如SFSR 评分[6]、OESIL 评分[7]、EGSYS 评分[8]等。但既往评分的制定均未纳入我国晕厥患者,是否适用于我国人群尚未可知。本研究旨在确定晕厥患者长期不良事件的发生率以及预测因素,从而得出针对我国人群的新晕厥预后评分,为临床医生提供更可靠的临床风险评估模型。
1 资料与方法
1.1 研究对象
本研究为一项前瞻性、单中心、观察性队列研究。选取2018 年6 月22 日至2020 年02 月10 日就诊于天津医科大学第二医院的晕厥患者。纳入标准:(1)年龄≥18 岁;(2)发作过程符合晕厥特征。排除标准:(1)无法给予书面或口头的知情同意;(2)其他原因导致的意识丧失,例如眩晕、昏迷、休克、癫痫发作、头部受伤、短暂性脑缺血发作、药物毒性、低血糖等;(3)妊娠女性;(4)药物或酒精滥用史。本研究为中国晕厥患者前瞻性、多中心注册研究的一部分,该研究通过北京大学人民医院伦理委员会批准和并获得主要研究者的知情同意。所有患者均签署知情同意书。
1.2 临床评估
研究者对所有患者进行了详细评估,包括病史、体格检查、12 导联心电图检测。询问患者本人有关晕厥发作相关症状的信息。由接诊医生酌情进行相关实验室检查、经胸超声心动图和冠状动脉造影等。其中心电图异常包括:(1)窦性心动过缓(心率<50次/min)或窦性停搏≥3 s;(2)房室或室内传导异常(Mobitz 二度及以上房室阻滞,束支阻滞或室内传导延迟);(3)节律异常(心房颤动或心房扑动、室上性心动过速、多灶性房性心动过速、频发室上性或室性早搏、室性心动过速);(4)Brugada 型或QTc 间期延长(>450 ms)、陈旧性心肌梗死或心室肥厚的心电图征象;(5)电轴左偏或右偏;(6)提示急慢性心肌缺血的ST 段和T 波异常。
1.3 终点事件及随访
定期对所有患者进行随访,包括门诊复查和电话随访,主要研究终点为晕厥发作后1 年内发生不良事件,包括全因死亡、心律失常、心肌梗死、严重结构性心脏病、主动脉夹层、急性肺栓塞、严重肺动脉高压、严重出血、心脏介入治疗、心脏外科手术、急性脑血管病等。心律失常包括心室颤动、室性心动过速、病态窦房结综合征、Mobitz 二度房室阻滞、三度房室阻滞、症状性室上性心动过速,心房扑动或心房颤动伴快速心室率(≥160 次/min)、症状性心动过缓;严重结构性心脏病包括主动脉瓣狭窄(瓣膜面积≤1 cm2)、肥厚型梗阻性心肌病、严重肺动脉高压[平均动脉压>30 mmHg(1 mmHg=0.133 kPa)]、左心房黏液瘤或血栓及流出道梗阻等[4]。心脏介入治疗包括植入心脏复律除颤器、经皮冠状动脉介入治疗等;心脏外科手术包括冠状动脉旁路移植术、瓣膜置换术及其他心脏外科手术;急性脑血管病包括伴随明显临床症状的急性脑梗死及脑出血。根据随访期间是否发生不良事件分为无不良事件组和不良事件组。
1.4 统计学方法
使用SPSS 24.0 统计软件进行统计学分析。连续变量用均数±标准差或中位数(P25,P75)表示,组间比较采取χ2检验,分类变量用百分比表示,组间比较采用非参数检验。采用多因素Logistic 逐步回归筛选出有统计学意义的变量,影响因素的分析采用多因素Cox 回归模型,通过每个变量的风险比计算得到相应分值,根据回归系数的相对大小,将正值或负值分配给每个变量,得到新的评分系统,计算评分的敏感度、特异度、阳性预测值和阴性预测值等,绘制ROC 曲线,使用MedCalc 10.4.0.0 对ROC 曲线进行比较。用Kaplan-Meier 法绘制生存曲线,比较采用Log-rank χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 所有患者的一般资料
本研究最终纳入212 例患者,其中女性102例(48.11%),平均年龄(69±12)岁(范围33~92岁),平均随访时间(384±205)d。随访期间,共有36 例(16.98%)患者发生终点事件,其中心律失常6 例(16.67%)(包括心房颤动伴快速心室率4 例(11.11%)、室性心动过速1 例(2.78%)、症状性窦性心动过缓1 例(2.78%))、心肌梗死2 例(5.56%)、心力衰竭2 例(5.56%)、肺栓塞1 例(2.78%)、心脏介入治疗8 例(22.22%,包括4 例冠状动脉介入治疗、4 例起搏器植入)、除颤器放电1 例(2.78%)、心脏外科手术2 例(5.56%)、急性脑血管病5 例(13.89%)(包括脑梗死3 例、脑出血2 例);死亡9 例(25.00%)(包括3 例大面积心肌梗死后心脏破裂、2 例恶性肿瘤、1 例心力衰竭、1 例感染性心内膜炎、1 例血液系统疾病、1 例死因未明)。
2.2 两组患者的一般资料比较(表1)
表1 不良事件组和无不良事件组患者基本资料比较()

表1 不良事件组和无不良事件组患者基本资料比较()
注:NT-proBNP:N 末端B 型利钠肽原;CK-MB:肌酸激酶同工酶。*:用中位数(P25,P75)表示。1 mmHg=0.133 kPa
不良事件组患者的心率高于无不良事件组患者[(80.6±30.9)次/min vs.(70.5±17.8)次/min,P=0.010];不良事件组中无前驱症状的患者比例(63.9% vs.18.2%)、有心电图异常的患者比例(86.5%vs.62.3%)均高于无不良事件组(P均<0.05)。在病史方面,不良事件组器质性心脏病患者比例(54.1%vs.28.0%)、心律失常患者比例(51.4% vs.26.9%)均高于无不良事件组(P均<0.05)。在实验室指标检测方面,不良事件组N 末端B 型利钠肽原(NTproBNP)、D-二聚体水平均高于无不良事件组(P均<0.05),且肌酸激酶同工酶(CK-MB)>24 U/L的患者比例高于无不良事件组(33.3% vs.10.2%,P<0.05)。
2.3 Cox 回归分析(表2)

表2 晕厥患者不良事件的预测变量及相关参数
将心率、心电图异常、器质性心脏病、心律失常病史、NT-proBNP、D-二聚体、CK-MB >24 U/L、无前驱症状带入Cox 回归方程分析,结果显示:器质性心脏病、心律失常病史、心电图异常、CK-MB>24 U/L、无前驱症状是晕厥患者远期发生不良事件的独立预测因素(P均<0.05)。计算上述5 个变量的相应分值,并得到CANES 评分。
2.4 CANES 评分对晕厥患者不良事件的预测价值(图1)
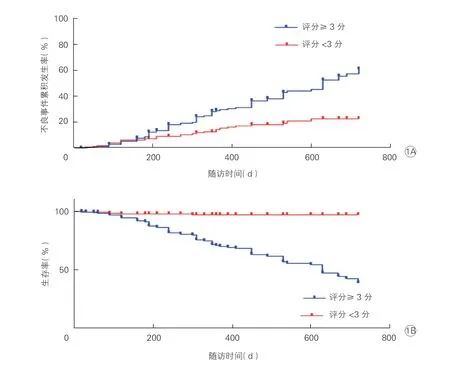
图1 CANES 评分≥3 分和<3 分的患者不良事件累积发生率(1A)和生存率(1B)比较
与CANES 评分<3 分的患者相比,评分≥3分的患者随访期间不良事件发生风险增加,不良事件累积发生率显著升高,而生存率显著降低(P均<0.001)。
2.5 CANES 评分不同分值对晕厥患者不良事件的预测效果(表3)

表3 CANES 评分的特征以及对晕厥患者1 年不良事件的预测作用
在212 例患者中,CANES 评分≥3 分的患者有87 例(41.04%),其中31 例(14.62%)在1 年随访期间发生不良事件。CANES 评分≥3 分预测不良事件的敏感度为86%(95%CI:71%~95%),特异度为68%(95%CI:61%~75%),阳性似然比2.71(95%CI:2.10~3.49),阴性似然比0.20(95%CI:0.09~0.46)。
2.6 CANES 评分与其他晕厥预后评分比较(图2)
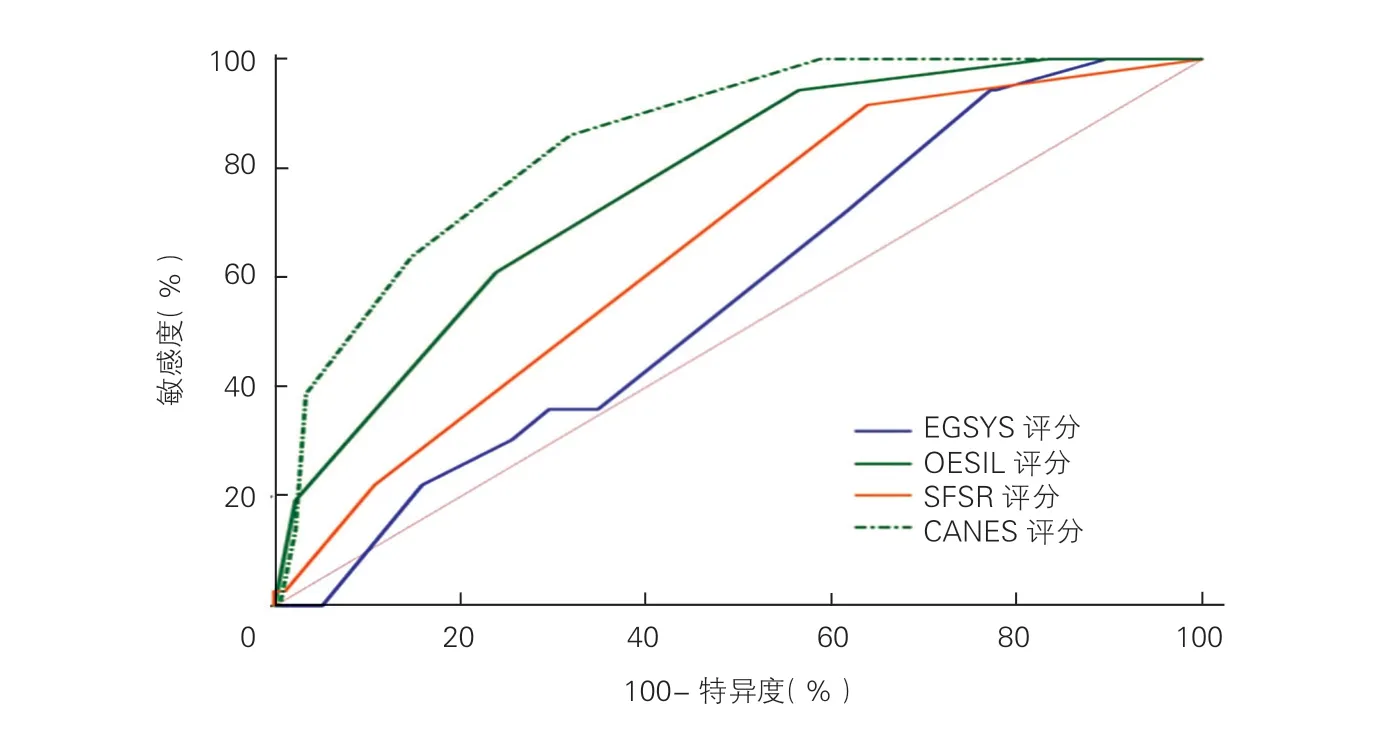
图2 应用ROC 曲线评估CANES 评分及其他晕厥预后评分对晕厥患者不良事件的预测价值
当评分≥3 分时,CANES 评分预测不良事件的ROC 曲线AUC 为0.85(95%CI:0.80~0.91),高 于SFSR 评 分(AUC=0.66,95%CI:0.59~0.90,P<0.0001),OESIL 评分(AUC=0.77,95%CI:0.71~0.30,P=0.0069)、EGSYS 评分(AUC=0.57,95%CI:0.50~0.64,P<0.0001)。CANES 评分对不良事件的预测价值明显优于SFSR 评分、OESIL 评分以及EGSYS 评分。
3 讨论
本研究是一项在中国人群中进行的晕厥患者队列研究,建立了预测晕厥患者不良事件发生的新临床预测评分——CANES 评分。通过与既往3 种临床晕厥预后评分进行比较,包括心脏疾病、心律失常病史、心电图异常、CK-MB >24 U/L、无前驱症状等危险因素的CANES 评分为最适合国人且敏感度较高的晕厥预后评分。CANES 评分将提高医生对晕厥患者不良预后的判断,并根据患者不良预后的风险决定是否住院,避免不良事件发生。本评分相对简单,容易记忆,且不依赖临床医生的水平。如果经过验证,可以将其用作评估低危患者出院的工具。
2003 年,有学者报道了首个急诊科晕厥风险评分——SFSR 评分,用于急诊晕厥患者7 d 内发生严重不良后果及是否需要住院治疗的评估,预测不良预后的敏感度和特异度分别为96%和62%[5]。后来,又相继出现OESIL 评分、EGSYS 评分等[7-8]评分,但只有少数评分在不同人群中得到验证。2010 年,Serrano 等[9]的Meta 分析表明,晕厥评分系统的预测作用有限,另一项Meta 分析也发现,与临床决策相比,OESIL 评分、EGSYS 评分和SFSR 评分等晕厥预后评分并未显示出更好的预测价值[10]。
目前已知的十余种晕厥预测评分中,仅有OESIL 评分和EGSYS 评分用于预测晕厥患者的长期不良事件发生率。OESIL 评分的具体变量包括年龄≥65 岁、心血管疾病史、无先兆晕厥症状、心电图异常,每项危险因素为1 分,4 分时1 年死亡率为57%。EGSYS 评分包括晕厥前有心悸、异常心电图和(或)心脏病史、劳累时晕厥、仰卧位晕厥、存在发病诱因,评分≥3 时,患者2 年内死亡率更高。
CANES 评分纳入变量与OESIL 评分有所重叠,目的均为预测远期不良事件和死亡,未对患者年龄进行限制,并且加入心律失常、CK-MB >24 U/L等危险因素,与OESIL 评分相比,预测晕厥患者不良预后的价值更高。
既往研究中,CSRS 和FAINT 等多个评分[4,11-12]均将肌钙蛋白作为危险因素之一,但并未有评分纳入CK-MB。CK-MB 和肌钙蛋白均为心肌损伤的标志物。CK-MB 主要分布于心肌细胞,敏感度和特异度分别为97.5%和100%,现已在临床实践中广泛使用[13],且较少受非心脏因素(如肾功能衰竭、严重感染等)的影响,更易作为晕厥不良预后的预测指标。本研究CK-MB 的检测采用免疫抑制法,正常范围为0~24 U/L。然而,由于不同实验室的正常范围可能不同,纳入CK-MB 的评分体系可能对评分系统的临床推广有一定影响。
本文尚存在一些局限性。第一,本研究为单中心队列研究,纳入患者例数较少,不能代表所有人群;其次,近年报道的CSRS 评分、FAINT 评分均来自大型多中心研究队列,具有良好的诊断价值。本研究样本量较小,故未与此二者进行比较;最后,本评分尚需在大型多中心队列研究中进行验证。
综上所述,本前瞻性队列研究发现,CK-MB与晕厥患者发生严重不良事件相关。与其他晕厥预后评分相比,加入CK-MB 变量的CANES 评分有助于识别远期严重不良事件高风险的患者,且在临床实践中容易推行。
利益冲突:所有作者均声明不存在利益冲突
