肝主动靶向给药系统研究进展
2021-05-27高司琪骆慧婷彭志荣颜红夏新华
高司琪 骆慧婷 彭志荣 颜红 夏新华
〔摘要〕 主动靶向给药系统可以选择性地将药物传递到靶部位,可减少对正常组织或细胞的毒性、减少给药剂量和次数、提高药物的生物利用度,是目前药物研发的一个热点。本文通过查阅近五年有关肝主动靶向给药方面的文献,从肝实质细胞靶向、肝非实质细胞靶向以及肝肿瘤细胞靶向3个方面,对肝主动靶向给药制剂的制备工艺、表征、肝靶向性评价等进行综述,并对其存在的问题及前景进行讨论。
〔关键词〕 肝主动靶向给药系统;受体;配体;靶向性
〔中图分类号〕R283.6 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2021.02.028
〔Abstract〕 Active targeting drug delivery systems are becoming a hot spot in pharmaceutical research. It can selectively deliver drugs to targeting sites, decrease toxicity to normal tissue or cells, reduce the dosage and frequency of administration, and improve the drug bioavailability. Through searching and summarizing relevant literatures on liver active targeting drug delivery systems in the past five years, this paper reviewed the preparation process, characterization and targeting evaluation of active targeting liver drug delivery systems from three aspects: hepatic parenchymal cells targeting, hepatic non-parenchymal cells targeting, and liver tumor cells targeting. Its prospect and problems are also discussed.
〔Keywords〕 liver active targeting drug delivery system; receptor; ligand; targeting
肝脏是人体重要的代谢器官,它不仅在糖、脂肪、蛋白质、维生素及激素等物质代谢中有重要作用,而且还具有分泌、排泄等重要功能。临床常见的肝脏疾病多为肝炎、肝纤维化、肝硬化、肝癌等。文献报道,乙型肝炎病毒全世界感染约20亿人,每年约造成32万人死亡,而丙型肝炎病毒感染影响着全世界约1.7亿人[1];肝细胞癌(hepatocellular carcinoma,HCC)是世界上第三大最致命的癌症,研究表明全世界每年有626 000例新发的原发性肝癌病例,其发病率和死亡率在恶性肿瘤中分别排名第五和第三[2]。传统的化学疗法由于药物非特异性分布,难以或较少到达目标部位,药物在体内的血药浓度低,往往达不到理想的治疗效果,并且可能产生一定的不良反应。肝主动靶向制剂作为一种新型给药系统,可将药物靶向输送至肝细胞,提高靶区的药物浓度,实现增效减毒的作用。本文从肝实质细胞靶向、肝非实质细胞靶向以及肝肿瘤细胞靶向3个方面,对制剂的制备工艺、表征、肝靶向性评价等进行综述和讨论,以期为肝靶向新型给药系统的研发提供新的思路和方法。
1 肝实质细胞靶向给药系统
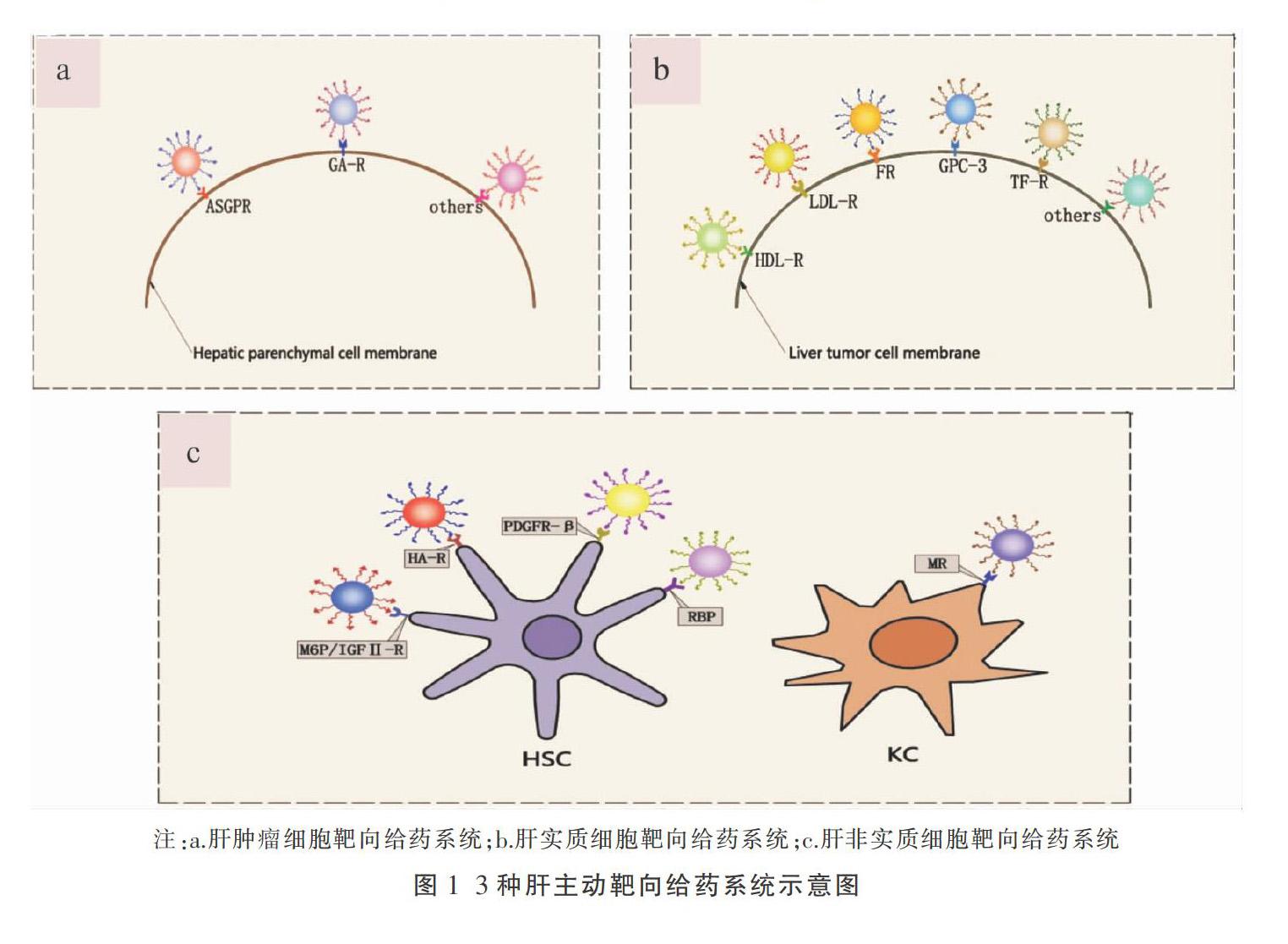
肝细胞由肝实质和肝非实质细胞组成,其中肝实质细胞约占肝脏总细胞数的60%~70%[3],是肝脏的基本组成单位之一。肝实质细胞发挥着代谢、胆汁产生和糖原合成等功能,与急性肝炎、肝硬化、肝脓肿等病理生理变化有关,因此,肝实质细胞病变的治疗尤其重要。肝实质细胞表面含有去唾液酸糖蛋白受体(asialoglycoprotein receptor, ASGPR)、甘草次酸(glycyrrhetic acid, GA)受体等多种受体,利用受体与其相应的配体间的特异性结合,可实现药物的肝主动靶向,见图1a。
1.1 ASGPR介导的肝靶向给药系统
ASGPR也称为半乳糖受体,是第一个被鉴定的哺乳动物凝集素,它主要在肝实质细胞表面大量表达[每个细胞约含有(1~5)×105个结合位点],在肝外细胞上很少发现[4],这使其成为靶向肝细胞的理想进入途径。ASGPR能識别末端携带半乳糖(galactose,Gal)或N-乙酰半乳糖胺(N-acetylgalactosamine,GalNAc)残基的去唾液化糖蛋白,具有高度亲和力,还能通过网格蛋白介导的内吞作用促进内化。因此,可将配体引入药物中,再通过受体-配体结合实现肝脏靶向[5]。ASGPR介导的肝靶向给药研究主要集中在肝炎、肝癌的治疗。例如,罗利华[6]制备了多烯紫杉醇半乳糖化胆固醇配体脂质体,体内研究显示,经半乳糖配体修饰后的脂质体在大鼠体内分布速率加快,在血液中的清除速度加快,且药物在小鼠肝脏中的累积明显大于其他器官。赵丽云[7]制备了半乳糖化载白藜芦醇纳米球,体内和体外研究显示,半乳糖化的纳米球比普通纳米球的细胞摄取率高,能通过提高去乙酰化酶活性,抑制固醇调节元件结合蛋白-1c的表达,改善非酒精性脂肪肝。ASGPR介导的基因肝靶向递送多见于反义药物(通常指反义寡核苷酸),已成为目前国内外基因治疗研究的热点之一。ASGPR介导的肝靶向给药系统具有高效的肝靶向性,是目前肝实质细胞靶向研究中最广泛的一类。
1.2 GA受体介导的靶向给药系统
GA是从甘草根中提取的甘草酸的主要水解产物,具有保肝抗炎、抗肿瘤等药理作用[8],GA可以抑制半胱氨酸蛋白酶-10诱导的激活,从而在肝细胞中产生保护作用;且有较高的肝组织分布特性和肝细胞靶向性,可利用肝细胞膜表面的GA特异性结合位点,通过受体介导的内吞,发挥肝靶向作用[9],是一种具有应用前景的肝靶向配体。研究者们在实验室研究阶段已充分证实了GA介导的肝靶向给药体系能特异性地靶向至肝病变部位,如 Rohilla等[10]以GA作为靶向配体,通过离子凝胶化过程制备GA修饰的载阿托伐他汀壳聚糖(glycyrrhetinic acid-modified chitosan, mGA-suc-CTS)纳米颗粒。药代动力学研究和器官分布研究表明,mGA-suc-CTS纳米颗粒较未修饰阿托伐他汀壳聚糖纳米颗粒显示出相对较高的肝摄取和更高的血浆浓度,以及更小的肝细胞毒性,并且在肝脏中的累积比未修饰纳米颗粒高近2.59倍,具有显著的肝靶向性。肖璐[11]合成了具有肝实质细胞靶向和长循环功能的新型高分子材料丁二酸胆固醇单酯-聚乙二醇-甘草次酸乙酯(cholesterol succinate monoester-polyethylene glycol-
glycyrrhetinic acid ethyl ester, Chol-PEG-GA),同时制备了载有马钱子碱的修饰脂质体(brucine liposome modified with cholesterol succinate monoester-
polyethylene glycol-glycyrrhetinic acid ethyl ester,CPGL),大鼠药动学研究结果发现,CPGL的曲线下面积(area under curve,AUC)比普通脂质体高出了 2.31倍,显示经过合成材料修饰的CPGL能够显著延长药效时间,且在肝中分布的浓度最高。目前,GA与药物通过偶联形成的GA-药物复合物也已被证实具有肝靶向性,但研究尚不深入。
1.3 其他靶向给药体系
除以上几种肝靶向给药系统外,亦有胆汁酸受体(bile acid receptor, BAR)和清道夫受体(scavenger receptor, SR)介导的肝靶向给药系统的研究报道[12-13]。
2 肝非实质细胞靶向给药系统
肝脏非实质细胞包括枯否细胞(kupffer cells, KCs)、肝窦内皮细胞(sinusoidal endothelial cells, SECs)、肝星状细胞(hepatic stellate cells, HSCs)等,约占肝脏细胞数的30%,肝脏体积的8%[14]。KCs属于肝血窦内的巨噬细胞,占机体单核-巨噬细胞总量的80%以上,是肝脏损伤和修复的關键介质,起重要的防御功能,可以吞噬和清除血液中的异物[15]。SECs是高度特化的内皮细胞,可在肝细胞癌的发展、以及与炎症和感染等有关的肝脏病变中发挥作用[16]。HSCs是肝脏分泌细胞外基质的主要细胞,是肝纤维化的主要驱动力[17]。因此,肝非实质细胞对治疗肝脏疾病具有重要意义。下文将介绍几种肝非实质细胞靶向给药系统,见图1 c。
2.1 甘露糖受体(mannose receptor, MR)介导的肝靶向给药系统
MR属于C型凝集素样受体,以其与甘露糖的结合特性而得名,在肝内皮细胞表面大量存在,具有广泛的结合特异性。MR在识别病原体,呈递抗原和维持内部环境的动态平衡方面起着重要作用[18]。研究者[19]利用脂肪酶催化合成甘露糖-月桂二酸酯-胆固醇(mannose-diester lauric diacid-cholesterol,Man-DLD-Chol)靶向配体,制备甘露糖化胆固醇配体修饰甘草次酸脂质体(glycyrrhetinic acid liposomes containing ligand of mannose-diester lauric diacid-cholesterol conjugate, Man-DLD-Chol-GA-Lp)。细胞毒性结果显示,Man-DLD-Chol-GA-Lp在规定浓度范围内,与空白脂质体相比,细胞毒性作用更小,安全性更高。小鼠组织分布试验结果显示,Man-DLD-Chol-GA-Lp的靶向参数[(靶向效率(targeting efficiency, Te)、相对靶向效率(relative targeting efficiency, RTe)、相对摄取率(relative uptake rate, Re)、峰浓度比(peak concentration ratio, Ce)]均优于GA-Lp,其中Te高达54.67%。表明Man-DLD-Chol配体有效提高了肝靶向效率。此外,甘露糖受体在肝炎、肝癌等基因靶向治疗方面亦取得了一定的进展。
2.2 甘露糖-6-磷酸/胰岛素样生长因子(mannose-6-phosphate/insulin-like growth factor, M6P/IGF Ⅱ)受体介导的肝靶向给药系统
M6P/IGFⅡ受体是一种多功能受体,存在于HSCs的细胞膜上,能与甘露糖糖基结合。因肝细胞受损而释放的肝纤维因子,会激活HSCs,进而上调其表面的M6P/IGFⅡ受体水平,因此,M6P/IGFⅡ可作为治疗肝纤维化的特异性靶点[20]。甘露糖-6-磷酸修饰的人血清白蛋白(mannose-6-phosphate modified
human serum albumin, M6P-HSA)对M6P/IGFⅡ受体具有选择性,可在活化的HSCs表面累积。利用M6P/IGFⅡ受体与M6P-HSA两者特异性结合,以M6P-HSA为靶标,可以实现肝靶向给药[21]。例如董志领[22]制备了M6P-HSA靶向脂质体,采用荧光材料异硫氰酸酯(fluorescein isothiocyanate, FITC)标记,以未偶联M6P配体的HSA-FITC组为对照,与HSC-T6细胞培养24 h后观察荧光。结果M6P-HSA-FITC组培养后可以观察到明亮的绿色荧光,而没有偶联M6P配体的HSA-FITC几乎没有荧光,可见M6P-HSA特异的靶向性。
2.3 透明质酸(hyaluronic acid, HA)受体介导的肝靶向给药系统
HA是构成细胞外基质和细胞间质的主要成分,主要由肝星状细胞合成并被正弦内皮细胞降解,具有良好的生物兼容性、生物可降解性等特点,是常用的药物递送载体[23]。肝细胞膜表面含有多种HA受体,包括其受体分化抗原簇44(cluster of differentiation 44, CD44)、细胞游走受体(receptor of hyaluronic acid mediated motility, RHAMM)等,其中RHAMM主要存在于HSC细胞。Thomas等[24]制备了包载氯沙坦的透明质酸(HA)胶束,并分析了其在C3H/HeN小鼠模型中减弱HSC细胞活化的可能性。研究结果表明,HA胶束可更多地累积在纤维化肝脏中,随着氯沙坦的递送增加,HSCs的特异性摄取也增加,小鼠的血清酶水平和胶原蛋白沉积显著降低,表明其通过HSC靶向机制可改降低肝纤维化指标。此外,还有研究者开展了透明质酸与紫杉醇、5-氟尿嘧啶、多柔比星等抗肿瘤药物以及基因治疗药物的靶向递药体系研究,证实了经HA修饰后的微粒给药系统能改善药物的稳定性、提高靶向性。
2.4 视黄醇结合蛋白介导的肝靶向给药系统
视黄醇结合蛋白(retinol binding protein, RBP)是一种亲脂载体蛋白,负责维生素A(vitamin A, VA)的摄取与储存,HSCs储存了占全身80%的VA[25]。VA可以与HSCs表面的RBP特异性结合进入HSCs内,可用于靶向治疗肝脏疾病[26]。Qiao等[27]制备了VA修饰的经聚乙二醇化处理的聚合物胶束,实验结果显示,HSCs对VA修饰的胶束的吸收比未修饰的高50%,此外,经修饰后的胶束在肝脏中的累积量大于其他器官,即使在5 d后,仍然能在肝脏中检测到该胶束。表明了VA修饰的经聚乙二醇化处理的聚合物胶束对肝细胞具有靶向性。
除以上报道,还有研究表明血小板衍生生长因子受体(platelet derived growth factor receptors, PDGFR)能刺激伤口愈合并调节组织动态平衡,当肝纤维化时,肝组织中PDGFR-β表达明显增加[28]。人血小板衍生生长因子BB(PDGF-BB)中的主要活性位点环肽PPB是PDGFR-β特异性配体,基于此可设计PDGFR-β介导的肝靶向制剂,但PDGFR-β存在生产成本较高的局限性,限制了其临床应用和推广。
3 肝肿瘤细胞靶向给药系统
肝癌主要包括原发性肝癌和继发性肝癌两大类型,其中肝细胞癌约占原发性肝癌的90%[29]。肝肿瘤细胞靶向给药系统能靶向性递送药物至肿瘤细胞,提高药物濃度,有效降低不良反应和毒副作用。常见的肝肿瘤细胞靶向给药系统如下,见图1 a。
3.1 抗体介导的肝靶向给药系统
单克隆抗体简称单抗,是由一种识别特定抗原决定簇的杂交瘤细胞株分泌,具有特异性强、灵敏度高等特点,已被广泛用于生物医药领域。单克隆抗体可与放射性同位素、化疗药物及毒素等,结合形成免疫偶联物,是目前肝脏疾病的治疗途径之一。抗体介导的肝靶向给药系统中单抗主要组成部分,抗体自身的强弱直接影响靶向治疗效果。随着生物工程技术的不断发展,靶向性更强、副作用更小的抗体分子在不断出现。
3-型磷脂酰肌醇蛋白聚糖(3-glypican, GPC-3)是一种细胞表面蛋白,在肝细胞癌的细胞膜上表达丰富[30]。到目前为止,针对GPC-3研发出了多种高亲和力抗体(如GCC-3、HN3、HS20和YP7),其中 GCC-3已进入临床试验。GPC-3可调节Wnt、YAP和Hh等多种信号通路,是肝癌治疗的特异性靶点之一。Gan等[31]开发了一种连接了GPC-3的新型加载索拉非尼(sorafenib, SFB)的聚合物纳米粒子(sorafenib-loaded polymeric nanoparticle, NP-SFB-Ab),体内抗肿瘤实验结果显示,NP-SFB-Ab对 HepG2细胞的杀伤能力,强于相同浓度的游离SFB、SFB纳米粒(NP-SFB)以及非药物负载的纳米粒(NP),且NP-SFB-Ab能显著抑制肿瘤生长,远优于SFB和NP-SFB。Qin等[32]以抗人甲胎蛋白单克隆抗体与马钱子碱纳米粒为材料,制备出具有靶向特点的马钱子碱抗体纳米粒(brucine immuno-nanoparticles, BIN)。实验结果表明,与马钱子碱和马钱子碱纳米粒相比,BIN对肝癌细胞迁移的抑制作用最强;BIN能特异性靶向肝细胞膜,具有较强的抑制肝癌细胞生长的时间依赖性和剂量依赖性。单抗介导的肝肿瘤靶向给药系统有其独有的优势,但仍存在一些问题,如各类靶点的抗体体内作用机制并不明确;药物、抗体及载体三者靶向系统的构建方式仍有待进一步研究;单克隆抗体制剂售价昂贵等。
3.2 转铁蛋白受体介导的肝靶向给药系统
转铁蛋白受体(transferrin receptor, TFR)是一类广泛分布于脊椎动物体内的跨膜糖蛋白,在正常细胞中表达水平低,但在肿瘤细胞中含量较高[33]。根据这种特性,可将其作为肝癌细胞的特异性靶头。Hu等[34]合成了pH和氧化还原双响应转铁蛋白(transferrin, TF)修饰的聚酰胺型胺树枝状大分子共轭物,将阿霉素(doxorubicin, DOX)负载在其疏水腔中,来制造pH和氧化还原双响应TF修饰的纳米载体(transferrin conjugated pH and Redox-Responsive histidine polyamidoamine dendrimer/doxorubicin,
HP-ss-PEG-TF/DOX)复合物。体外和体内的研究表明,HP-ss-PEG-TF/DOX具有较高的药物含量和优异的肿瘤细胞摄取能力,可在HepG2肿瘤细胞中迅速积聚,能增强肝肿瘤细胞的凋亡活性,且具有较小的心脏和肾脏毒性。
3.3 叶酸受体介导的肝靶向给药系统
叶酸受体(folate receptor, FR)是一类糖基磷脂酰肌醇,叶酸可通过FR介导的内吞作用进入细胞[35]。因FR高度表达于人肿瘤细胞表面,而很少存在于正常细胞中,这就使FR递送的药物可以高度靶向于肿瘤细胞,提高药物的选择性[36]。Liu等[37]制备了负载去甲斑蝥素的二酸代谢产物(diacid metabolite of norcantharidin, DM-NCTD)的叶酸(folic acid, FA)改性的聚乙二醇化(diacid metabolite of norcantharidin/folicacid-modified polyethylene glycol, DM-NCTD / FA-PEG)脂质体,产品具有规则的球形形态,平均粒径约为200 nm,包封率>80%。MTT细胞毒性试验表明,与未经过FA修饰的PEG脂质体相比,DM-NCTD/FA-PEG脂质体对H22肝癌细胞系的细胞毒性作用明显增强。生物分布研究表明DM-NCTD脂质体改善了肿瘤靶向效率,且DM-NCTD/FA-PEG脂质体对H22荷瘤小鼠的肿瘤抑制作用优于游离的DM-NCTD或DM-NCTD/PEG脂质体,表明装载DM-NCTD的FA修饰的脂质体可能具有潜在的肝细胞癌靶向治疗作用。目前,FR介导的肝靶向给药系统的研究比较成熟,载药量高;能够协同递送多种药物,实现双重或多重靶向,亦可与磁性靶向协同使用。
3.4 低密度脂蛋白受体介导的肝靶向给药系统
低密度脂蛋白(low density lipoprotein,LDL)受体已被证实在肝癌等许多癌细胞系的表面上调[38]。Ao等[39]制备了低密度脂蛋白修饰的共递送多西他赛(docetaxel, DTX)和沙利度胺(thalidomide, TDD)二氧化硅纳米粒子(a docetaxel and thalidomide co-
delivery system based on low density lipoprotein modified
silica nanoparticles, LDL/SLN/DTX/TDD),体外分析显示,LDL/SLN/DTX/TDD具有良好载药能力,能够通过靶向低密度脂蛋白受体来提高递送效率,HepG2细胞毒性比未修饰的二氧化硅纳米粒子和游离药物高。体内成像和抗癌试验还证实了LDL/SLN/DTX/TDD具有较好的肿瘤归巢和协同抗癌作用。
3.5 其他靶向给药体系
此外,还有研究者开展了胰岛素、高密度脂蛋白、表皮生长因子、整合素配体[40-43]等修饰的肝主动靶向给药系统的研究。
4 小结与展望
作为一种新型给药系统,肝主动靶向制剂可将药物靶向输送至肝细胞,提高靶区的药物浓度,实现增效减毒的作用,是目前国内外研究的热点之一。研究者们对不同类型的肝主动靶向给药制剂的制备工艺、表征、药动学研究、肝靶向性评价、药效学评价等开展了较为系统的研究,但目前仍存在一些问题,如:新的肝特异性靶标尚有待探索;新发现靶点的肝靶向作用仍有待深入研究;大量载体材料仍处于实验研究阶段,载体系统的分子量、取代位置、载药量等能否达到预期效果,仍不确定;肝主动靶向给药系统在体内的吸收、分布、代谢、排泄机制大多尚不明确;药物体内蓄积、肝靶向毒理学等临床试验安全性评价较少;生产工艺复杂、生产成本普遍较高,在生产上市和临床应用上任重道远。
高度特异性、作用靶点多样性、药物高效性和低毒性等可能是未来肝主动靶向給药进一步的研发方向。未来,随着载体材料的发展、制剂技术的创新、新靶标和新配体的发现及靶向机制的研究等,肝主动靶向给药系统将继续发挥其特有的优势,安全、有效、精准地将治疗药物传递到肝细胞内,为肝脏疾病提供更加有效的治疗手段。
参考文献
[1] HUANG X, LEROUX J C, CASTAGNER B. Well-defined multivalent ligands for hepatocytes targeting via asialoglycoprotein receptor[J]. Bioconjugate Chemistry, 2017, 28(2): 283-295.
[2] 赵美萍,陈清锋,罗小敏,等.宁波市奉化区100例乙型肝炎原发性肝癌临床流行病学调查[J].现代实用医学,2018,30(3):348-349.
[3] 周 涛,朱美意,周 杰,等.大鼠肝损伤过程中肝组织神经营养因子神经突蛋白水平变化及其意义研究[J].中国全科医学,2018,21(6):670-676.
[4] SCHARNER J, QI S, RIGO F, et al. Delivery of GalNAc-conjugated splice-switching ASOs to non-hepatic cells through ectopic expression of asialoglycoprotein receptor[J]. Molecular Therapy-Nucleic Acids, 2019, 16: 313-325.
[5] DAS S, KUDALE P, DANDEKA P, et al. Asialoglycoprotein Receptor and Targeting Strategies[M]. Switzerland:Springer, 2019: 353-381.
[6] 罗利华.半乳糖化胆固醇配体介导的多烯紫杉醇脂质体的药物动力学及其组织分布研究[D].广州:广州中医药大学,2015:1-83.
[7] 赵丽云.肝靶向纳米球载白藜芦醇对非酒精性脂肪肝的干预作用研究[D].邯郸:河北工程大学,2018:1-57.
[8] CHEN M, ZHU J, KANG J, et al. Exploration in the Mechanism of Action of Licorice by Network Pharmacology[J]. Molecules, 2019, 24(16):2959-2973.
[9] LV Y, LI J J, CHEN H L, et al. Glycyrrhetinic acid-functionalized mesoporous silica nanoparticles as hepatocellular carcinoma-targeted drug carrier[J]. International Journal of Nanomedicine, 2017, 12: 4361-4370.
[10] ROHILLA R, GARG T, BARIWAL J, et al. Development, optimization and characterization of glycyrrhetinic acid-chitosan nanoparticles of atorvastatin for liver targeting[J]. Drug Delivery, 2016, 23(7): 2290-2297.
[11] 肖 璐.马钱子碱主动靶向脂质体的研究[D].南京:南京中医药大学,2012:1-64.
[12] ZHANG Z, LI H X, XU G R, et al. Liver-targeted delivery of insulin-loaded nanoparticles via enterohepatic circulation of bile acids[J]. Drug Delivery, 2018, 25(1): 1224-1233.
[13] ALLEN R J, MATHEW B, RICE K G. PEG-peptide inhibition of scavenger receptor uptake of nanoparticles by the liver[J]. Molecular Pharmaceutics, 2018, 15(9): 3881-3891.
[14] DENG X, ZHANG X, LI W P, et al. Chronic liver injury induces conversion of biliary epithelial cells into hepatocytes[J]. Cell Stem Cell, 2018, 23(1): 114-122.
[15] 刘 彦,吴 皓,龚建平,等.阻断Kupffer细胞的TIM-4蛋白功能对小鼠肝脏缺血再灌注损伤的影响[J].第三军医大学学报,2019, 41(1):48-55.
[16] YU X, CHEN L, LIU J Q, et al. Immune modulation of liver sinusoidal endothelial cells by melittin nanoparticles suppresses liver metastasis[J]. Nature Communications, 2019, 10(1): 574-588.
[17] 張扬武,罗伟生,陈 姗,等.枇杷叶熊果酸对大鼠肝星状细胞增殖抑制作用及对PPAR-γ、TGF-β1表达的影响[J].中国药理学通报,2017,33(4):517-521.
[18] LI T P, GUAN S H, WANG Q, et al. Soluble mannose receptor as a predictor of prognosis of hepatitis B virus-related acute-on-chronic liver failure[J]. World Journal of Gastroenterology, 2019, 25(37): 5667-5675.
[19] 陈 静.甘露糖化胆固醇配体修饰甘草次酸脂质体的肝靶向研究[D].广州:广州中医药大学,2018:1-126.
[20] LI X, YAO Q Y, LIU H C, et al. Placental growth factor silencing ameliorates liver fibrosis and angiogenesis and inhibits activation of hepatic stellate cells in a murine model of chronic liver disease[J]. Journal of Cellular and Molecular Medicine, 2017, 21(10): 2370-2385.
[21] KLEIN S, FROHN F, MAGDALENO F, et al. Rho-kinase inhibitor coupled to peptide-modified albumin carrier reduces portal pressure and increases renal perfusion in cirrhotic rats[J]. Scientific Reports, 2019, 9(1): 2256-2267.
[22] 董志领.6-磷酸甘露糖受体靶向肝星状细胞脂质体的研究[D]. 武汉:华中科技大学,2013:1-78.
[23] PANDOLFI L, FRANGIPANE V, BOCCA C, et al. Hyaluronic acid-decorated liposomes as innovative targeted delivery system for lung fibrotic cells[J]. Molecules (Basel, Switzerland), 2019, 24(18): 3291-3306.
[24] THOMAS R G, MOON M J, KIM J H, et al. Effectiveness of losartan-loaded hyaluronic acid (HA) micelles for the reduction of advanced hepatic fibrosis in C3H/HeN mice model[J]. PLoS One, 2015, 10(12): e0145512.
[25] EL-MEZAYEN N S, EL-HADIDY W F, EL-REFAIE W M, et al. Hepatic stellate cell-targeted imatinib nanomedicine versus conventional imatinib: A novel strategy with potent efficacy in experimental liver fibrosis[J]. Journal of Controlled Release, 2017, 266: 226-237.
[26] ZHAO Y, LI C J, ZHOU X. Transcriptomic analysis of porcine
granulosa cells overexpressing retinol binding protein 4[J]. Genes, 2019, 10(8): 615-630.
[27] QIAO J B, FAN Q Q, XING L, et al. Vitamin A-decorated biocompatible micelles for chemogene therapy of liver fibrosis[J]. Journal of Controlled Release, 2018, 283: 113-125.
[28] 何 萍,吳雅峰,杨唤英,等.大麻素受体-2激动剂AM1241对肝纤维化小鼠肝组织血小板衍生生长因子表达的影响[J].中华肝脏病杂志,2017,25(11):841-846.
[29] YANG J D, HAINAUT P, GORES G J, et al. A global view of hepatocellular carcinoma: Trends, risk, prevention and management[J]. Nature Reviews Gastroenterology & Hepatology, 2019, 16(10): 589-604.
[30] SUN B, HUANG Z, WANG B, et al. Significance of glypican-3 (GPC3) expression in hepatocellular cancer diagnosis[J]. Medical Science Monitor, 2017, 23: 850-855.
[31] GAN H, CHEN L, SUI X, et al. Enhanced delivery of sorafenib with anti-GPC3 antibody-conjugated TPGS-b-PCL/Pluronic P123 polymeric nanoparticles for targeted therapy of hepatocellular carcinoma[J]. Materials ence & Engineering C, 2018, 91: 395-403.
[32] QIN J M, YIN P H, LI Q, et al. Anti-tumor effects of brucine immuno-nanoparticles on hepatocellular carcinoma[J]. International Journal of Nanomedicine, 2012, 7: 369-379.
[33] JOSHI H A, ATTAR E S, DANDEKAR P, et al. Transferrin Receptor and Targeting Strategies[M]. Switzerland: Springer, 2019: 457-480.
[34] HU Q, WANG Y F, XU L, et al. Transferrin conjugated pH- and redox-responsive poly(amidoamine) dendrimer conjugate as an efficient drug delivery carrier for cancer therapy[J]. International Journal of Nanomedicine, 2020, 15: 2751-2764.
[35] JONES S K, SARKAR A, FELDMANN D P, et al. Revisiting the value of competition assays in folate receptor-mediated drug delivery[J]. Biomaterials, 2017, 138: 35-45.
[36] KALLI K R, BLOCK M S, KASI P M, et al. Folate Receptor Alpha Peptide Vaccine Generates Immunity in Breast and Ovarian Cancer Patients[J]. Clinical Cancer Research, 2018, 24(13): 3014-3025.
[37] LIU M C, LIU L, WANG X R, et al. Folate receptor-targeted liposomes loaded with a diacid metabolite of norcantharidin enhance antitumor potency for H22 hepatocellular carcinoma both in vitro and in vivo[J]. International Journal of Nanomedicine, 2016, 11:1395-1412.
[38] STOPECK A T, NICHOLSON A C, MANCINI F P, et al. Cytokine regulation of low density lipoprotein receptor gene transcription in HepG2 cells[J]. The Journal of Biological Chemistry, 1993, 268(23): 17489-17494.
[39] AO M, XIAO X, AO Y Z. Low density lipoprotein modified silica nanoparticles loaded with docetaxel and thalidomide for effective chemotherapy of liver cancer[J]. Revista Brasileira De Pesquisas Medicas e Biologicas, 2018, 51(3): 1-10.
[40] 陳 滨,郭洁文,何 素,等.叶下珠复方Ⅱ号对肝癌细胞增殖和胰岛素样生长因子-1受体信号通路转录的作用[J].中国实验方剂学杂志,2018,24(14):108-114.
[41] 王宝龙.重组高密度脂蛋白—阿霉素复合物用于肿瘤治疗的研究[D].上海:复旦大学,2014:1-77.
[42] WANG T, PHILIPPOVICH S, MAO J, et al. Efficient Epidermal Growth Factor Receptor Targeting Oligonucleotide as a Potential Molecule for Targeted Cancer Therapy[J]. International Journal of Molecular Sciences, 2019, 20(19):4700-4713.
[43] BENEDICTO A, MARQUEZ J, HERRERO A, et al. Decreased expression of the β2 integrin on tumor cells is associated with a reduction in liver metastasis of colorectal cancer in mice[J]. BMC Cancer, 2017, 17(1): 827.
