慢性肾脏病血管钙化大鼠模型血清中HIF-1α、β-catenin 的表达及意义
2021-05-27陈琪琪谭茹瑜朱婷婷张丽玲欧三桃
陈琪琪,谭茹瑜,朱婷婷,张丽玲,欧三桃
(1.西南医科大学附属医院肾病内科,四川 泸州 646000;2.四川省肾脏病临床医学研究中心,四川 泸州 646000)
慢性肾脏病(chronic kidney disease,CKD)的发病率和患病率不断增加,已成为世界范围内严重的公共卫生问题[1]。心血管并发症是CKD 患者的首要死因,而血管钙化是CKD 患者心血管并发症的独立危险因素和预测因素之一[2],是导致死于心血管并发症的终末期肾脏疾病患者(end stage renal disease,ESRD)增多主要原因之一[3,4]。CKD 血管钙化发生机制复杂且缺乏敏感的早期生物标志物,因此深入探索其机制,寻找新的血清学标志物十分必要。既往有学者发现Wnt/β-catenin 通路可能是CKD 血 管 钙 化 发 生 的 机 制 之 一[5,6],且 钙 化 时 低 氧诱导因子-1α(HIF-1α)表达也明显增加[7,8],但血管钙化时血清HIF-1α、β-连环蛋白(β-catenin)水平变化如何,与血管钙化是否相关尚不明确。因此本研究旨在探索血管钙化大鼠血清HIF-1α、β-catenin 变化与血管钙化的关系,寻找敏感的血管钙化早期生物标志物。
1 材料与方法
1.1 实验动物
清洁级雄性Sprague Dawley(SD)大鼠30 只,体重180~270 g,6~8 周龄,购自西南医科大学动物实验中心,适应性饲养1 周后将其随机分为正常对照组(CON 组,10 只)和CKD 血管钙化组(CKD 组,20 只)。
1.2 试剂
腺嘌呤(Sigma 公司,美国),含磷1.2%的高磷饲料(北京科澳协力饲料有限公司,中国),戊巴比妥钠(Sigma 公司,美国),全组织冯库萨(Von kossa)钙染色试剂盒(上海杰美基因医药科技有限公司,中国),钙含量测定试剂盒(C004-2)(南京建成生物工程研究所,中国),大鼠HIF-1α、β-catenin ELISA 试剂盒(上海泛柯实业有限公司,中国),全自动生化分析仪(西门子,德国),全自动酶标仪(Bio-Rad 公司,美国)。
1.3 实验方法
1.3.1 CKD 大鼠血管钙化模型建立 CKD 组大鼠给予1.2% 高磷饲料喂养及2.5% 腺嘌呤250 mg/(kg·d)灌胃;对照组(CON 组)给予普通饲料喂养,并予以等量等频次生理盐水灌胃。第6 周末,收集尿液后处死大鼠,留取大鼠血液、肾脏及主动脉标本。
1.3.2 24 h 尿蛋白、血尿素、肌酐、钙、磷检测 留取24 h 尿检测大鼠24 h 尿蛋白量,腹主动脉采血并检测血尿素氮(BUN)、血肌酐(Scr)、钙(Ca)和磷(P),并计算钙磷乘积。
1.3.3 主动脉Von kossa 染色 GENMED 清理液清洗大鼠新鲜全段主动脉后加入GENMED 固定液,在室温下孵育1 h 后吸去固定液,清理液清洗2次后再次加入GENMED 染色液,孵育1 h 后清洗并加入平衡液,孵育5 min 后再次清洗,观察并拍照,黑色染色为阳性。
1.3.4 肾脏HE 染色 将肾脏包埋成石蜡块并切片,烤片,二甲苯、乙醇脱蜡脱水,蒸馏水洗5 min,重复2 次后苏木素染液染色5 min,冲洗,伊红染液染色3 min,冲洗,酒精、二甲苯脱水,封片,观察。
1.3.5 ELISA 法 检 测 血 清HIF-1α、β-catenin 水 平标准品及样品的稀释与加样;温育,洗涤,重复5 次,加酶,温育,洗涤,显色,终止,测定OD 值。计算标准曲线方程,据样品OD 值算出的样品浓度×稀释倍数=各样品的浓度。
1.3.6 主动脉钙含量检测 主动脉组织经液氮研磨、匀浆,留取上清液,配制工作液,按说明书将空白孔、标准孔、测定孔加样,混匀,静置,测定各孔在波长610 nm时的OD值。组织蛋白浓度采用BCA法测得。组织中钙含量(mmol/g prot)=(测定OD 值-空白OD 值)/(标准OD 值-空白OD 值)×标准品浓度(1 mmol/L)÷样本蛋白浓度(mmol/g)。
1.4 统计学处理
2 结果
2.1 大鼠肾功能及24 h 尿蛋白定量
与CON 组相比,CKD 组大鼠24 h 尿蛋白量、BUN、Scr 均明显升高,差异具有统计学意义(P<0.05),见表1。
2.2 大鼠血清钙(Ca)、磷(P)及钙磷乘积(Ca×P)
与CON组相比,CKD组大鼠血清磷、钙磷乘积均较CON组增高,差异均具有统计学意义(P均<0.01),血钙降低,差异具有统计学意义(P<0.01),见表1。
表1 两组大鼠肾功能、24 h 尿蛋白及生化指标水平(±s)Tab 1 The levels of renal function,24 h urine protein and biochemical indexes of rats in two groups(±s)

表1 两组大鼠肾功能、24 h 尿蛋白及生化指标水平(±s)Tab 1 The levels of renal function,24 h urine protein and biochemical indexes of rats in two groups(±s)
组别CON 组CKD 组n 10 20 tP 24 h 尿蛋白(g/24 h)0.00±0.00 0.02±0.00 9.086<0.05 BUN(mmol/L)5.22±0.67 37.64±7.24 19.849<0.05 Scr(μmol/L)33.50±2.28 145.45±31.99 15.569<0.05 Ca(mmol/L)1.97±0.25 1.32±0.26 6.503<0.05 P(mmol/L)2.56±0.86 6.62±0.86 12.126<0.05 Ca×P(mmol2/L2)5.19±2.32 8.65±1.77 4.532<0.05
2.3 大鼠主动脉钙化情况
肉眼观察见CON 组主动脉光滑柔软,富有弹性;CKD 组主动脉弹性差,质脆,管壁僵硬,表面凹凸不平,可见明显的节段性钙化结节。Von Kossa染色示:CON 组无黑色染色,CKD 组见黑色物质沉积在血管上,见图1。
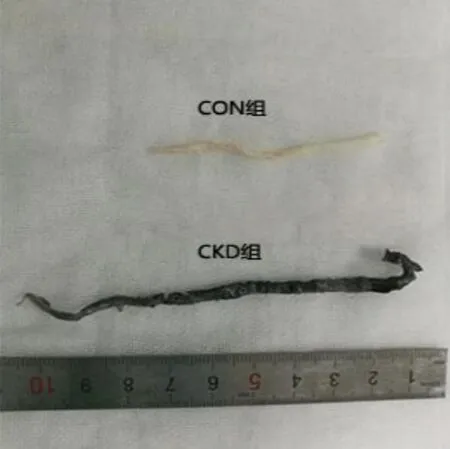
图1 大鼠主动脉Von Kossa 染色Fig 1 Von Kossa staining of aorta of rats
2.4 肾脏病理改变
肾组织HE 染色示CON 组肾小球、小管及间质结构、形态未见异常。CKD 组大鼠肾组织形态结构紊乱,肾小球数量减少,部分萎缩伴囊腔扩张,见棕黄色物质沉积;肾小管扩张伴部分管腔断裂;肾间质呈纤维化改变,伴有炎性细胞浸润,见图2。
2.5 主动脉钙含量检测
与CON 组比较,CKD 组大鼠主动脉钙含量升高,差异具有统计学意义(P<0.05),见表2。
2.6 血清HIF-1α、β-catenin 表达水平
与CON 组相比较,CKD 组大鼠血清HIF-1α、β-catenin 水平明显升高,差异具有统计学意义(P<0.05),见表3。
表2 两组大鼠主动脉钙含量(±s)Tab 2 The levels of calcium content of aorta of rats in two groups(±s)
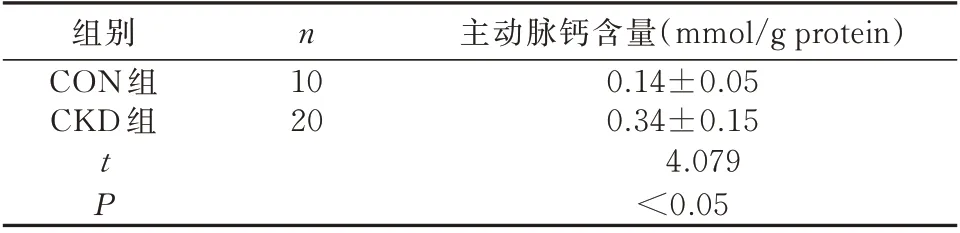
表2 两组大鼠主动脉钙含量(±s)Tab 2 The levels of calcium content of aorta of rats in two groups(±s)
组别CON 组CKD 组n 10 20 tP主动脉钙含量(mmol/g protein)0.14±0.05 0.34±0.15 4.079<0.05
表3 两组大鼠血清HIF-1α、β-catenin 水平(pg/mL,±s)Tab 3 The levels of serum HIF-1α and β-catenin of rats in two groups(pg/mL,±s)

表3 两组大鼠血清HIF-1α、β-catenin 水平(pg/mL,±s)Tab 3 The levels of serum HIF-1α and β-catenin of rats in two groups(pg/mL,±s)
组别CON 组CKD 组n 10 20 t P HIF-1α(pg/mL)0.25±0.04 0.35±0.04 6.9<0.05 β-catenin(pg/mL)0.24±0.02 0.46±0.01 35.509<0.05
2.7 相关性分析
血清P、Ca×P、血清HIF-1α、β-catenin 水平与大鼠主动脉钙含量呈正相关(P<0.05),而血Ca 与主动脉钙含量无显著相关性(P>0.05),见表4。
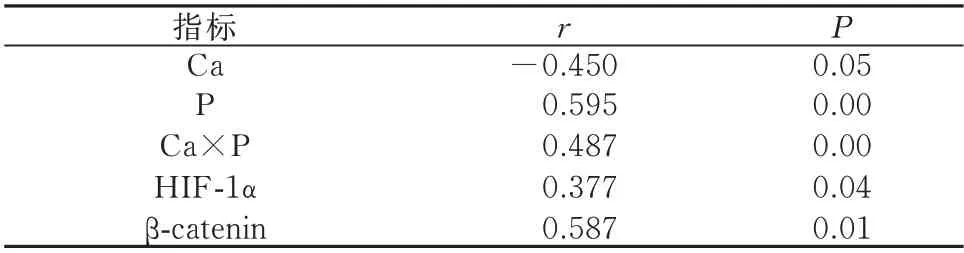
表4 相关指标与主动脉钙含量的相关性分析Tab 4 Correlation analysis of related indexes and aortic calcium content

图2 两组大鼠肾脏HE 染色Fig 2 H & E staining of kidney sections of rats in two groups
3 讨论
血管钙化是CKD 患者心血管并发症的独立危险因素,导致CKD 患者心血管死亡率明显增加,但血管钙化发生机制复杂,目前临床上也缺乏早期识别血管钙化的生物标志物。本研究通过采用腺嘌呤灌胃及高磷饲料喂养的方法成功建立CKD 血管钙化大鼠模型,笔者发现血清HIF-1α 水平在CKD血管钙化大鼠组明显增高,且与主动脉钙含量呈正相关[9]。HIF-1α 是缺氧状态下介导下游基因表达的主要转录因子[10],而多种肾脏疾病中普遍存在缺氧的情况,大量研究发现HIF 系统在多种肾脏疾病的发生发展起着重要作用,比如糖尿病肾病[11]、急性肾损伤、IgA 肾病等。同时,HIF-1α 通过调节血管平滑肌细胞(vascular smooth muscle cells,VSMCs)向成骨样细胞转分化、糖代谢途径、炎症、氧化应激、Notch 信号通路等多个机制参与CKD 的血管钙化[9]。有研究发现没有心血管疾病的糖尿病患者血清HIF-1α 水平随着其冠状动脉钙化(coronary artery calcification,CAC)程度的加重而明显增加,提示血清HIF-1α 可能可预测CAC 的发生及其严重程度[12]。一项有关维持性血液透析(MHD)患者的研究也发现患者血清中HIF-1α 水平明显升高,并且与冠状动脉钙化积分呈正相关[13]。本课题组的前期研究也发现CKD 大鼠主动脉上存在HIF-1a-VEGF-Notch 信号通路的激活。本研究与上述研究结果一致,这表明HIF-1α 可能可早期反映CKD 血管钙化的发生及其严重程度,甚至可能预测血管钙化的进展。但是由于HIF 也参与了CKD 肾性贫血、肾脏纤维化、微炎症状态等多种病理状态的发生,且其具体作用目前尚不明确,因此仍需进行后续研究进一步证实。
β-catenin 是Wnt 通路的效应分子,可与转录因子结合,激活下游一系列靶基因的表达[14,15]。Wnt/β-catenin 通路与ESRD 患者钙磷代谢的关系十分密切,而长期钙磷代谢紊乱可继发血管钙化[16]。有研究发现在高磷、骨形态发生蛋白-2(BMP-2)、β-甘油磷酸、高迁移率族蛋白B1 诱导的VSMCs 钙化模型中,β-catenin 的表达明显增加,而阻断β-catenin 的表达 则 可 以 改 善 甚 至 逆 转VSMCs 的 钙 化[5,17]。进 一步的体内研究发现人参皂苷Rb1 可以通过抑制Wnt/β-catenin 信号通路减轻CKD 血管钙化[18]。有研究人员在ESRD 患者的血管中发现了Wnt/βcatenin 通路的激活,且β-catenin 的表达随血管钙化的加重而增加[19]。本研究发现CKD 血管钙化大鼠血清β-catenin 水平明显高于CON 组,且与主动脉钙含量呈正相关,这表明不仅是组织中,血清的βcatenin 水平可能也参与了CKD 血管钙化的发生,可能可一定程度上反映血管钙化的存在,未来可进一步探索血管钙化患者的血清β-catenin 水平与钙化的关系。
综上,针对CKD 血管钙化目前仍缺乏有效的诊治手段及早期敏感的血清学标志物,而本研究发现CKD 血管钙化大鼠中,其血清HIF-1α、β-catenin 水平明显增高,且与主动脉钙化程度密切相关,有望成为预测、评价CKD 血管钙化的血清学指标,对防治CKD 血管钙化具有重要意义。
