中药调控肿瘤细胞自噬的研究进展
2021-05-27刘茂伦徐海波
何 曼,陈 莉,曾 沙,孙 强,赵 晖,刘茂伦,杨 寒,任 珊,张 梦,徐海波
成都中医药大学药学院 药理系,四川 成都 611137
自噬是细胞自我吞食并通过溶酶体降解丧失功能的废旧细胞器和蛋白质等细胞内物质,以实现循环再利用、产生能量、对抗饥饿应激等生物学现象。自噬可以分为巨自噬、微自噬、分子伴侣介导自噬3种类型,其中巨自噬存在最广泛[1]。在自噬相关基因(autophagy-related gene,ATG)和Beclin-1等调控下,具有双层膜结构的自噬泡通过P62调节蛋白等介导吞食、包裹细胞内物质形成自噬体,此时自噬相关蛋白LC3-Ⅰ与磷脂酰乙醇胺结合形成脂化的LC3-Ⅱ并转移至自噬体膜上。随后,自噬体与溶酶体融合形成具有单层膜结构的自噬溶酶体,后者所含的水解酶进一步降解其吞食的内容物[2]。细胞自噬受哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)依赖性和非mTOR依赖性2类信号通路的调控。mTOR是自噬的负性调控因子,蛋白激酶B(protein kinase B,PBK/Akt)/mTOR通路、有丝分裂原激活的蛋白激酶(mitogen-activated protein kinase,MAPK)/mTOR通路可抑制细胞自噬;而单磷酸腺苷活化的蛋白激酶(adenosine monophosphate-activated protein kinase,AMPK)和p53抑制mTOR,形成AMPK/mTOR和p53/mTOR的正性调控自噬通路[3]。非mTOR依赖性自噬调控通路主要有活性氧簇(reactive oxygen species,ROS)/c-Jun N端蛋白激酶(c-Jun N-terminal kinase,JNK)氧化应激通路、CCAAT增强子结合蛋白的同源蛋白(CCAAT-enhancer-binding proteins homologous protein,CHOP)通路等[4]。
早在2004年,Shintani等[5]报道了自噬与肿瘤之间的紧密关系。目前发现,肿瘤细胞存在具有自我保护作用的生理性自噬,以实现肿瘤的增殖、抗凋亡、转移和产生耐药性。但是,抗癌药物又可以诱导肿瘤细胞发生过度的死亡性自噬,以产生抗癌作用[6]。近几年,中药对肿瘤细胞自噬的调控是中医药领域的研究热点,但由于肿瘤细胞存在保护性自噬和死亡性自噬2种截然不同的现象,以及中药多成分、多靶点的作用特点,导致中药调控肿瘤细胞自噬的作用及其机制甚为复杂。因此,本文系统地综述了近年来中药对肿瘤细胞自噬调控的研究进展,旨在从细胞自噬方面探讨中药抗肿瘤的机制。
1 中药增强肿瘤细胞自噬
1.1 中药增强自噬以抗肿瘤
大量研究表明,中药可增强肿瘤细胞自噬以促进肿瘤细胞凋亡、抑制肿瘤侵袭与转移、降低肿瘤耐药性等。
1.1.1 诱导肿瘤细胞凋亡 中药可增强肿瘤细胞自噬以促进肿瘤细胞凋亡。自噬抑制剂氯喹与大黄素共同处理结直肠癌SW480细胞后,LC3-Ⅱ蛋白表达量较氯喹组显著升高,促凋亡基因半胱氨酸蛋白酶-3(cysteinyl aspartate specific proteinase-3,Caspase-3)、p53表达量上调,而ROS抑制剂N-乙酰半胱氨酸能逆转大黄素引发的自噬性凋亡[7]。丹参酮ⅡA能促进骨肉瘤143B细胞异种移植小鼠后肿瘤组织中自噬相关蛋白Beclin-1、ATG5、ATG7表达,增加脱氧核苷酸末端转移酶(terminal deoxynucleotidyl transferase,TdT)介导的dUTP缺口末端标记(TdTmediated dUTP nick-end labeling,TUNEL)技术阳性细胞数量,降低抗凋亡蛋白B淋巴细胞瘤-2蛋白(B-cell lymphoma-2,Bcl-2)的表达水平,从而诱导移植瘤发生凋亡[8]。泽泻醇A通过诱导乳腺癌MDA‑MB‑231细胞中ROS产生和DNA损伤,提高LC3-Ⅱ水平,进而促进依赖于自噬的凋亡蛋白Caspase-3、Caspase-9表达[9]。
1.1.2 抑制肿瘤侵袭与转移 重楼皂苷Ⅰ能提高胃癌HGC-27细胞中LC3-Ⅱ和上皮标志物钙粘附蛋白E的表达水平,抑制基质金属蛋白酶-9、波形蛋白和纤维连接蛋白表达,提示重楼皂苷Ⅰ通过诱导细胞自噬抑制胃癌上皮间质转化(epithelialmesenchymal transition,EMT)和转移进程[10]。青藤碱可升高胶质瘤U-87细胞内游离Ca2+浓度,启动内质网应激反应,进而增强自噬,抑制上皮性间充质标志蛋白Snail和Slug表达和肿瘤侵袭。内质网应激抑制剂4-苯基丁酸、自噬抑制剂3-甲基腺嘌呤或沉默ATG5基因能减弱青藤碱的抗肿瘤转移作用[11]。
1.1.3 降低肿瘤耐药性 研究发现,黄芩苷可以提高顺铂耐药性宫颈癌C-33A细胞的LC3-Ⅱ/LC3-Ⅰ值,促进细胞内Beclin-1、ATG5、ATG12基因表达,提高细胞自噬水平,增强C-33A细胞对顺铂的敏感性[12]。长春新碱能促进耐药性胃癌SGC7901细胞中ATG12基因表达,提高细胞自噬水平,恢复胃癌细胞对5-氟尿嘧啶和顺铂的化疗敏感性[13]。
1.2 中药增强自噬以促进肿瘤发生发展
某些抗癌中药能诱导肿瘤细胞发生保护性自噬,从而促进肿瘤细胞增殖、抑制肿瘤细胞凋亡。
1.2.1 促进肿瘤增殖 羟基喜树碱诱导的自噬能促进A549细胞增殖,使用自噬抑制剂3-甲基腺嘌呤能增强羟基喜树碱抗肺癌细胞的作用[14]。苦参碱可引发白血病K562细胞和伊马替尼耐药性K562/IM细胞产生防御性的自噬反应,从而在一定程度上促进白血病细胞增殖[15]。
1.2.2 抑制肿瘤细胞凋亡 酸浆果红素A通过促进黑色素瘤A375-S2细胞中一氧化氮合酶表达而提高细胞NO水平,诱导癌细胞发生保护性自噬,进而抑制NO生成,而NO有促癌细胞凋亡作用,表明自噬和NO生成可形成负反馈回路,最终保护癌细胞免于凋亡[16]。枸杞多糖可诱导肝癌HepG2细胞凋亡,同时升高细胞LC3-Ⅱ/LC3-Ⅰ值,诱导HepG2细胞自噬。枸杞多糖组凋亡率低于枸杞多糖和3-甲基腺嘌呤联用组,提示枸杞多糖诱导的自噬能抵抗凋亡、保护肝癌细胞[17]。
2 中药抑制肿瘤细胞自噬
大量文献报道,中药可抑制肿瘤细胞的保护性自噬,延缓或逆转多药耐药性。但未见报道中药抑制肿瘤细胞的死亡性自噬。
云南藤黄提取物oblongifolin C可阻断宫颈癌HeLa细胞中自噬体与溶酶体融合,下调溶酶体蛋白水解酶表达,从而抑制肿瘤细胞自噬,减弱肿瘤细胞对饥饿的耐受,最终发挥抗肿瘤作用。同时,限制小鼠能量摄入也促进oblongifolin C的体内抗肿瘤作用[18]。同样地,北豆根碱和北豆根苏林碱也可抑制自噬过程中自噬体与溶酶体融合和溶酶体降解,导致HeLa细胞保护性自噬减弱,从而使HeLa细胞对喜树碱的抗肿瘤作用增敏[19]。芒柄花素能抑制乳腺癌耐药性MCF-7/ADR细胞增殖,其机制在于下调耐药蛋白P-糖蛋白和自噬标志物LC3A/B表达,抑制癌细胞的保护性自噬[20]。Wang等[21]发现小檗碱也能抑制MCF-7/ADR细胞自噬,逆转乳腺癌细胞对阿霉素的耐药性。另外,黄芪甲苷Ⅱ可抑制肝癌Bel-7402/5-FU细胞自噬流,表现为升高肝癌细胞内LC3-Ⅱ和P62蛋白水平,抑制溶酶体蛋白水解酶表达,影响溶酶体酸化,从而提高肝癌细胞对顺铂的敏感性[22]。
3 中药双向调控肿瘤细胞自噬
中药对肿瘤自噬的调控作用可能因疾病阶段、细胞株种类、药物剂量、作用时间而异,甚至对自噬产生促进和抑制双向调控作用。如连花汤处理子宫内膜癌Ishikawa细胞12 h可升高细胞LC3mRNA水平而激活自噬,但处理24 h则降低LC3mRNA表达而抑制细胞自噬[23]。熊果酸可促进小鼠肺癌TC-1细胞的线粒体自噬蛋白PINK1和Nix表达,诱导TC-1细胞发生死亡性自噬[24],但是自噬抑制剂3-甲基腺嘌呤能增强熊果酸抗肺癌PC9细胞增殖的作用,提示熊果酸可能诱导PC9细胞发生保护性自噬[25]。另外,蟾蜍灵能够引发肝癌HCC细胞、胃癌MGC803细胞和U-87细胞的保护性自噬,以对抗肿瘤细胞凋亡[26-28],但是蟾蜍灵也可诱导结直肠癌HT-29和Caco-2细胞及肝癌SK-HEP-1、Huh7、Hep3B和HA22T细胞发生死亡性自噬,并促进肿瘤细胞凋亡[29-30]。
4 中药调控肿瘤细胞自噬相关的信号通路
调控细胞自噬的信号通路主要有mTOR依赖性和非mTOR依赖性2类,其中mTOR依赖性信号通路占主导作用。研究发现,中药对这2类自噬相关的信号通路都具有调控作用。
4.1 mTOR依赖性信号通路
竹节香附素A抑制结直肠癌HCT116细胞增殖,诱导HCT116细胞凋亡,并增强自噬相关蛋白Beclin-1和LC3表达以及自噬体形成从而激活自噬,其机制在于降低mTOR蛋白磷酸化水平,以抑制mTOR信号通路活性[31]。粉防己碱是一种L型Ca2+通道拮抗剂,能够通过灭活乳腺癌MCF-7细胞mTOR信号,诱导细胞发生非Ca2+依赖性的自噬性死亡[32]。愈创木醇可升高A549细胞LC3-Ⅱ/LC3-Ⅰ值,引发细胞自噬性死亡,抑制肺癌细胞增殖,其机制在于抑制细胞mTOR磷酸化以减弱mTORC1和mTORC2信号[33]。
4.1.1 Akt/mTOR信号通路 某些中药可通过调节Akt/mTOR信号通路以诱导肿瘤细胞发生死亡性自噬。如半枝莲总黄酮抑制小鼠异种移植的黑色素瘤B16细胞生长,促进肿瘤凋亡,诱导肿瘤死亡性自噬,提高肿瘤内LC3-Ⅱ/LC3-Ⅰ值,同时伴有p-磷脂酰肌醇-3激酶(phosphoinositide 3-kinase,PI3K)、p-Akt及p-mTOR蛋白表达降低[34]。雷公藤红素可抑制HeLa细胞增殖,阻滞细胞周期于G0/G1期,并诱导HeLa细胞自噬,表现为提高LC3-Ⅱ/LC3-Ⅰ值和Beclin-1表达,其机制在于抑制细胞Akt、P70核糖体蛋白S6激酶(P70 ribo-somalproteinS6kinase,P70S6K)及mTOR磷酸化水平[35]。槐耳提取物能抑制MCF-7细胞增殖和转移,诱导细胞凋亡,同时也可通过抑制Akt/mTOR信号通路,诱导乳腺癌细胞自噬[36]。
另一些中药能够调节Akt/mTOR信号通路以引发肿瘤保护性自噬。如大根香叶酮通过诱导前列腺癌PC-3和22RV1细胞凋亡而抗癌细胞增殖,但大根香叶酮也增强LC3B-Ⅱ蛋白表达,引发肿瘤细胞的保护性自噬,其机制在于抑制Akt和mTOR磷酸化以下调Akt/mTOR信号通路活性[37]。海蓬子皂苷甲可诱导MCF-7细胞发生保护性自噬,其机制在于减少mTOR磷酸化,抑制mTOR下游P70S6K蛋白丝氨酸、苏氨酸磷酸化以及4EBP1磷酸化,并降低Akt和蛋白激酶样内质网激酶(protein kinase R-like endoplasmic reticulum kinase,PERK)表达[38]。另外,β-榄香烯通过抑制PI3K/Akt/mTOR信号通路诱导A549细胞发生保护性自噬[39]。
少数中药能够调节Akt/mTOR信号通路以抑制肿瘤自噬。如小檗碱能逆转MCF-7细胞对阿霉素的耐药性,抗MCF-7/ADR细胞增殖,同时减少肿瘤细胞中LC3-Ⅱ水平和自噬体形成,增加P62蛋白蓄积,从而抑制自噬,其机制在于增强磷脂酶和张力蛋白同源物(phosphataseandtensinhomolog,PTEN)/Akt/mTOR信号通路活性[21]。
4.1.2 AMPK/mTOR信号通路 某些中药可通过调节AMPK/mTOR信号通路以诱导肿瘤细胞发生死亡性自噬。如新藤黄酸抗B16细胞增殖,诱导B16细胞线粒体自噬,表现为AMPK、沉默调节蛋白3(recombinant Sirtuin 3,SIRT3)及LC3-Ⅱ蛋白水平上调,而LC3-Ⅰ和mTOR蛋白减少,提示新藤黄酸通过抑制AMPK/mTOR信号通路诱导肿瘤死亡性自噬[40]。雷公藤甲素抑制前列腺癌LNCaP、C4-2和PC-3细胞增殖,诱导癌细胞凋亡,并提高细胞LC3-Ⅱ蛋白水平,抑制P62蛋白表达,促进肿瘤细胞形成自噬体和自噬流,从而诱导自噬发生。其机制在于雷公藤甲素能激发细胞内质网应激反应,促进AMPK磷酸化以激活AMPK,进而抑制mTOR激酶的活性[41]。
红景天苷诱导HCT116细胞发生保护性自噬,增强自噬相关蛋白LC3B和Becline-1表达,其机制在于提高p-AMPK蛋白水平以激活AMPK,减少mTOR磷酸化从而抑制AMPK/mTOR通路活性[42]。另外,紫参提取物抗肿瘤环己肽RA-XⅡ能够抗HepG2细胞增殖,诱导HepG2细胞凋亡,并减少HepG2细胞中AMPK蛋白磷酸化,激活mTOR/P70S6K信号通路,从而抑制肝癌细胞保护性自噬[43]。
4.1.3 MAPK/mTOR信号通路 中药可通过抑制MAPK/mTOR信号通路而诱导肿瘤细胞自噬。如甘草查耳酮A能诱导口腔癌SCC-25细胞凋亡,并增强细胞LC3-Ⅱ、beclin1蛋白表达,从而诱导癌细胞自噬,其机制在于降低SCC-25细胞中MAP4K3和p-mTOR蛋白水平,以抑制MAP4K3-mTOR信号级联[44]。据报道,灵芝三萜类可抑制HT-29细胞增殖,阻滞细胞分裂于G0/G1期,并且通过抑制p38 MAPK激酶活性,促进LC-3和Beclin-1蛋白表达以及自噬泡形成,从而诱导细胞自噬[45]。另外,丹参酮ⅡA抑制143B细胞增殖,诱导癌细胞凋亡,升高PI3KC3蛋白水平,激活MAP4K4,诱导细胞发生sestrin 2依赖性而非Beclin-1依赖性自噬[8]。
4.2 非mTOR依赖性信号通路
4.2.1 ROS/JNK信号通路 雷公藤红素可以抑制骨肉瘤HOS细胞生长,阻滞细胞分裂于G2/M期,诱导细胞凋亡,并促进自噬体形成和LC3B-Ⅱ聚集以诱导细胞自噬,其机制在于促进细胞产生ROS以激活JNK[46]。青藤碱能够抑制U-87细胞活性,通过产生ROS和激活自噬-溶酶体途径,诱导细胞发生死亡性自噬,表现为细胞内LC3-Ⅱ蓄积增多、自噬流形成和JNK活性增强[47]。
4.2.2 CHOP信号通路 蟾蜍灵可抑制神经胶质瘤细胞增殖,诱导细胞凋亡,并促进自噬泡和自噬溶酶体形成以及LC3-Ⅱ蓄积,从而引发瘤细胞保护性自噬,其机制在于调节细胞内质网应激反应和PERK/磷酸化α亚基真核起始因子2(phosphorylated αsubunit of eukaryotic initiation factor 2,eIF2α)/CHOP信号通路[28]。此外,18β-甘草次酸可诱导肝癌SMMC-7721、HLF、HLE、LM3、HepG2和Hep3B细胞凋亡,阻滞细胞分裂于G0/G1期,并通过激活转录激活子4(activating transcription factor 4,ATF4)/CHOP通路而诱导肝癌细胞发生保护性自噬[48]。
4.2.3 其他信号通路 目前发现,中药还可通过调控STAT3、Hedgehog等信号通路来影响肿瘤自噬[49]。如贞术消积汤能抑制小鼠肝癌H22细胞荷瘤生长,促进肿瘤体组织中自噬体和自噬溶酶体形成,诱导肝癌细胞自噬,其机制在于降低瘤体组织STAT3和Survivin蛋白表达,从而抑制STAT3/Survivin信号通路活性[50]。
5 结语与展望
相比正常细胞,肿瘤细胞存在更强的保护性自噬,以加快废物循环利用,提供细胞能量代谢,从而支撑肿瘤细胞的快速增殖,乃至转移和产生抗药性。但是,过度的自噬又可导致肿瘤细胞死亡,发生死亡性自噬。由于不同类型肿瘤的不同疾病阶段、以及不同癌细胞系的自噬水平不同,因此药物调控自噬的精准性对于自噬的基础研究和转化应用至关重要。
中药对于肿瘤细胞自噬具有增强、抑制或双向调控等多重作用(表1),这些正是中药多成分、多靶点作用特点的体现。在评价中药对自噬的影响时,应综合考量中药的多成分对自噬过程的多环节、多个信号靶点的整合作用。在基于自噬调控评价中药的抗肿瘤作用时,也应纳入中药对肿瘤细胞凋亡、焦亡、铁死亡等现象的影响,系统评估中药的抗肿瘤疗效和机制。
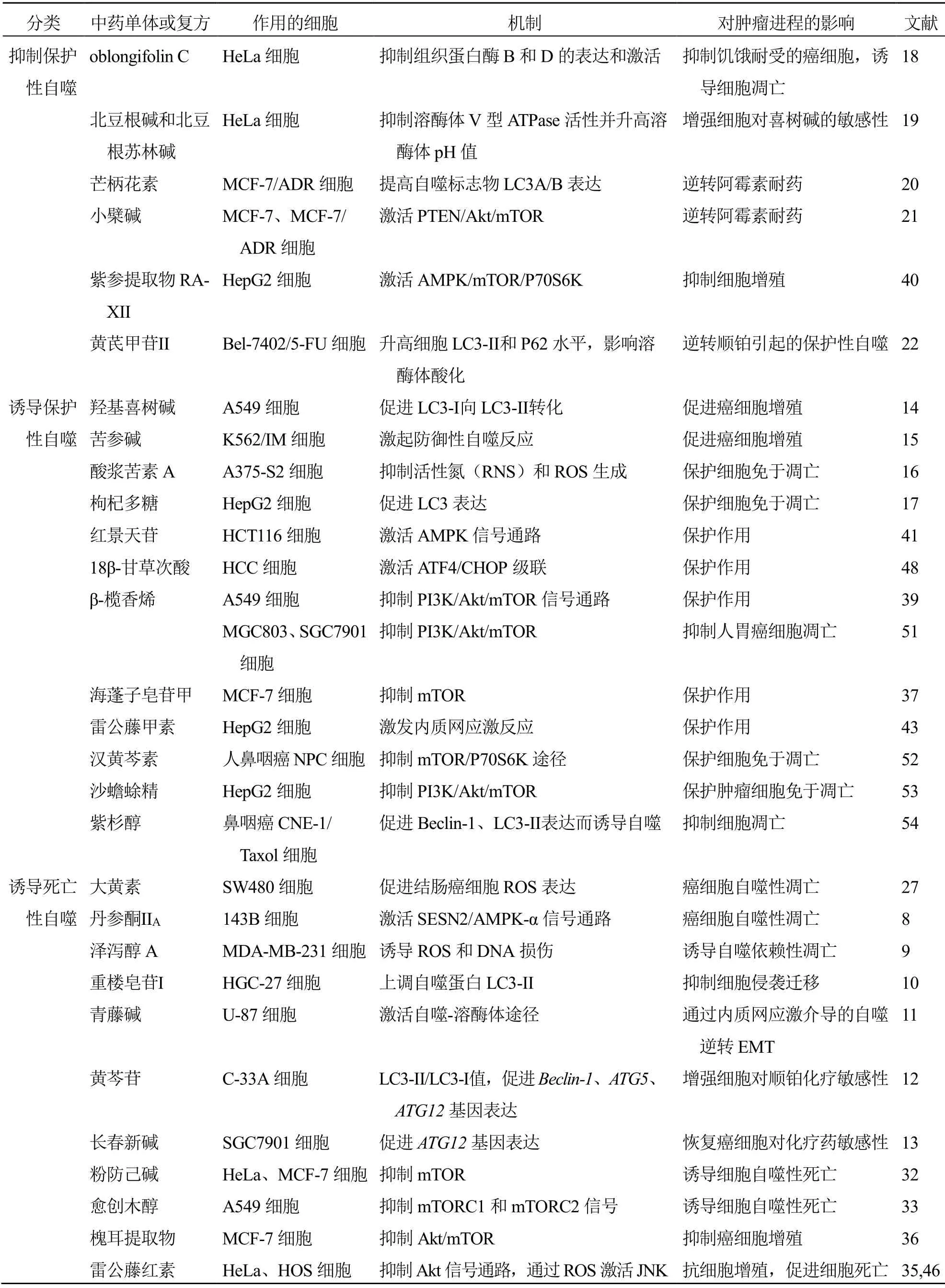
表1 中药调控肿瘤细胞自噬Table 1 Regulation and control of traditional Chinese medicine on autophagy of tumor cells

续表1
目前,中药调控肿瘤细胞自噬的研究大多是针对巨自噬。为了全面揭示中药对肿瘤细胞自噬的影响,需要进一步研究中药对肿瘤细胞的微自噬和分子伴侣介导自噬的调控作用。关于中药经非mTOR依赖性信号通路调控肿瘤自噬的研究,也需要拓展至ROS/JNK、CHOP以外,以便全面揭示中药调控肿瘤细胞自噬的机制。随着自噬生物学的发展,研究开发基于精准调控细胞自噬的抗癌中药,将助力临床肿瘤的防治。
利益冲突所有作者均声明不存在利益冲突
