川芎苯酞类成分对氧糖剥夺/再灌注诱导MDCK-MDR1细胞损伤的作用及机制
2021-05-27刘姗姗岳鹏飞帅书苑刘小金胡鹏翼
刘姗姗,郑 琴,岳鹏飞,杨 明,帅书苑,刘小金,胡鹏翼
江西中医药大学 现代中药制剂教育部重点实验室,创新药物与高效节能降耗制药设备国家重点实验室,江西 南昌330004
脑卒中具有极高的致死率和致残率,其发病机制复杂,细胞凋亡、氧化应激和炎性反应等均为导致脑卒中病情加重的重要原因。美国脑卒中协会揭示缺血性脑卒中是脑卒中最常见的形式,占所有脑卒中病例的87%[1-2]。目前溶栓、降纤为脑卒中主要治疗手段,但血液循环恢复后,神经元损伤,再灌注损伤加重脑梗死程度,导致神经功能障碍,这一病理过程为脑缺血再灌注损伤(cerebral ischemia reperfusion injury,CIRI)。CIRI会损伤大脑的血脑屏障,血脑屏障功能紊乱可导致严重继发性损伤如炎性损伤、脑水肿等,因此,血脑屏障的保护和恢复被认为是减少脑损伤的新型治疗策略。
补阳还五汤、天麻钩藤汤、血府逐瘀汤、圣愈汤、当归芍药散[3-5]在防治CIRI、保护血脑屏障完整性、抑制细胞凋亡、抑制炎性反应等方面都具有一定的疗效。补阳还五汤和血府逐瘀汤中含有赤芍和川芎,圣愈汤和当归芍药散中含有川芎和白芍,芍药苷为赤芍和白芍的活性成分,可减轻急性脑梗死大鼠的组织损伤程度,抑制缺血后脑组织中氧自由基的形成,降低脂质过氧化程度[6]。课题组前期研究表明,川芎中的3个苯酞类成分藁本内酯、洋川芎内酯A和洋川芎内酯I可增加芍药苷、天麻素和松果菊苷在MDR1转染犬肾细胞(MDCK-MDR1)模型上的跨膜转运,其机制与下调P-糖蛋白(P-glycoprotein,P-gp)、claudin-5和ZO-1表达有关[7-9]。本研究采用氧糖剥夺/再灌注(oxygen-glucose deprivation/reperfusion,OGD/R)诱导MDCK-MDR1细胞建立体外脑缺血再灌注损伤模型,探讨藁本内酯、洋川芎内酯A和洋川芎内酯I对OGD/R损伤MDCK-MDR1细胞的保护作用以及对配伍药物芍药苷跨膜转运的影响,为其防治缺血性脑血管疾病提供依据。
1 材料
1.1 细胞
MDCK-MDR1细胞购自上海中亚生物基因研究所。
1.2 药品与试剂
对照品藁本内酯(批号wkqq9011005,质量分数>98%)、洋川芎内酯I(批号DST190902-009,质量分数>98%)、洋川芎内酯A(批号PCS0323,质量分数>98%)、芍药苷(批号S-010-180710,质量分数>98%)购自成都瑞芬思生物科技有限公司;3460型Transwell小室(孔径0.4 μm,直径12 mm,表面积1.12 cm2)、培养瓶购自美国Costar公司;乳酸脱氢酶(lactate dehydrogenase,LDH)试剂盒(批号KG02448)、高糖DMEM培养基(批号KGM12800S-500)购自江苏凯基生物技术股份有限公司;无糖DMEM培养基(批号10566-016)购自美国Gibco公司;胎牛血清、非必需氨基酸、Hank’s平衡盐溶液(Hank’s balanced salt solution,HBSS)购自美国Gibco公司;RIPA裂解液(批号C1053)购自北京普利莱基因技术有限公司;PVDF膜(批号IPVH00010)购自美国Millipore公司;BCA蛋白定量试剂盒(批号CW0014S)购自北京康为世纪生物科技有限公司;超敏发光液(批号RJ239676)购自美国Thermo Fisher Scientific公司;P-gp抗体(批号ab170904)、ZO-1抗体(批号ab96587)、occludin抗体(批号ab167161)、葡萄糖转运蛋白-1(glucose transporter-1,GLUT-1)抗体(批号ab115730)购自美国Abcam公司;claudin-5抗体(批号29235)购自美国SAB公司;β-actin抗体(批号TA-09)、HRP辣根酶标记山羊抗小鼠IgG抗体(批号L3032-2)、HRP辣根酶标记山羊抗兔IgG抗体(批号L3012-2)购自北京中杉金桥生物技术有限公司;乙腈为HPLC级;水为双蒸水。
1.3 仪器
AB Triple Quad 4500复合三重四极杆线性离子阱质谱,配备ESI离子源及Analyst 1.6数据处理软件(美国AB SCIEX公司);BT25S型十万分之一电子天平(赛多利斯科学仪器有限公司);3-18K型高速冷冻离心机(美国Sigma公司);SW-CJ-2F型超净工作台(苏州净化设备有限公司);CO2恒温培养箱(美国Thermo Fisher Scientific公司);YCP-10S型三气培养箱(长沙华曦电子科技有限公司);Eclipse TS100型倒置显微镜(日本Nikon公司);HHS型恒温水浴锅(上海博迅实业有限公司);TDZ4A-WS型台式低速离心机(湖南湘仪实验室仪器开发有限公司);血球计数板(上海求精生化试剂仪器有限公司);MERS00002型跨膜电阻仪(美国Millipore公司);WD-2102B型全自动酶标仪(北京六一生物科技有限公司)。
2 方法
2.1 MDCK-MDR1细胞培养
MDCK-MDR1细胞用含10%胎牛血清、1%非必需氨基酸和1%双抗的高糖DMEM培养基,于37 ℃、5% CO2的培养箱中培养。隔天更换培养基,当细胞融合度达到80%~90%,弃去培养基,用37 ℃的HBSS溶液洗涤2次,以0.25%胰酶-0.02%乙二胺四乙酸(EDTA)消化。
2.2 藁本内酯、洋川芎内酯A和洋川芎内酯I对MDCK-MDR1细胞存活率的影响
取处于对数生长期的MDCK-MDR1细胞,以1×105/mL接种至96孔板中,设置对照组,模型组,藁本内酯低、中、高剂量(20、40、80 μg/mL)组,洋川芎内酯A低、中、高剂量(20、40、80 μg/mL)组和洋川芎内酯I低、中、高剂量(20、40、80 μg/mL)组[9]。对照组加入高糖DMEM培养基,于37 ℃、5% CO2的培养箱中培养;模型组和各给药组加入无糖DMEM培养基,于95% N2、5% CO2、37 ℃三气培养箱中培养6 h造成OGD损伤;藁本内酯、洋川芎内酯A、洋川芎内酯I溶于无水乙醇配制成质量浓度为10 mg/mL的母液,以高糖DMEM培养基稀释至相应质量浓度。各给药组再加入相应药物,模型组加入不含药物的高糖DMEM培养基,于37 ℃、5% CO2的培养箱中培养12 h进行再灌注[10]。再灌注结束后,弃去上清液,每孔加入20 µL MTT(5 mg/mL)溶液,孵育4 h,加入150 μL二甲基亚砜(DMSO),振荡10 min,采用酶标仪检测490 nm处吸光度(A)值,计算细胞存活率。
细胞存活率=A给药/A对照
2.3 藁本内酯、洋川芎内酯A和洋川芎内酯I对MDCK-MDR1细胞上清液LDH释放率的影响
按“2.2”项下方法处理细胞,收集上清液,按试剂盒说明书测定细胞上清液LDH释放率。
2.4 藁本内酯、洋川芎内酯A和洋川芎内酯I对MDCK-MDR1细胞凋亡的影响
取处于对数生长期的MDCK-MDR1细胞,以1×106/mL接种至6孔板中,按“2.2”项下方法处理细胞,收集细胞,加入100 μL结合缓冲液,制成1×106/mL的细胞悬液,加入5 μL Annexin V-FTTC和5 μL碘化丙啶(PI),室温避光放置15 min,加入400 μL结合缓冲液,1 h内采用流式细胞仪检测细胞凋亡情况。
2.5 藁本内酯、洋川芎内酯A和洋川芎内酯I对MDCK-MDR1细胞ZO-1、claudin-5、occludin、P-gp和GLUT-1蛋白表达的影响
取处于对数生长期的MDCK-MDR1细胞,以1×106/mL接种至6孔板中,按“2.2”项下方法处理细胞,收集细胞,加入RIPA裂解液,4 ℃、12 000 r/min离心10 min,吸取上清液,采用BCA蛋白定量试剂盒测定蛋白质量浓度,加入上样缓冲液,95 ℃煮沸10 min使蛋白变性。蛋白样品经10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,于5%脱脂奶粉封闭2 h,加入ZO-1抗体(1∶500)、claudin-5抗体(1∶500)、occludin抗体(1∶50 000)、P-gp抗体(1∶1000)、GLUT-1抗体(1∶100 000)和β-actin抗体(1∶2000),4 ℃孵育24 h,TBST洗涤3次;加入HRP辣根酶标记山羊抗小鼠/兔IgG抗体(1∶5000)孵育1 h,TBST洗涤3次,加入ECL发光试剂显影,采用Image J和Quantity One软件对蛋白条带进行灰度扫描及图像分析。
2.6 藁本内酯、洋川芎内酯A和洋川芎内酯I对芍药苷在MDCK-MDR1细胞跨膜转运的影响
取处于对数生长期的MDCK-MDR1细胞,以2.5×105/mL接种至Transwell小室,0.5 mL/孔,培养7 d,每2天换液1次,测定细胞跨膜电阻值,当跨膜电阻值>300 Ω/cm2时,按“2.2”项下方法处理细胞,吸去Transwell小室内培养基,PBS洗涤2次,加入0.5 mL含芍药苷(200 μg/mL)的高糖DMEM培养基,Transwell下室加入1.5 mL高糖DMEM培养基,培养4 h,吸取200 μL下室培养基,加入180 μL甲醇,涡旋3 min,16 000 r/min离心10 min,取上清液,按课题组前期方法LC-MS系统测定芍药苷质量浓度[7],计算芍药苷的表观渗透系数(Papp)。
Papp=dQ/(dt·A·C0)
dQ/dt为转运时间dt内的药物转运速率(μg/s);A为细胞单层表面积(cm2);C0为Transwell小室内芍药苷的初始质量浓度(μg/mL)
2.7 统计学分析
采用SPSS 20.0软件进行统计分析,计数资料以±s表示,完全随机设计的多个样本均数比较采用单因素方差分析(One-Way ANOVA)进行处理,两组间相互比较,满足方差齐性时用LSD检验,不满足方差齐性时用T2检验。
3 结果
3.1 藁本内酯、洋川芎内酯A和洋川芎内酯I对MDCK-MDR1细胞形态的影响
如图1所示,对照组MDCK-MDR1细胞清晰透亮,呈“铺路石”状,排列紧密,紧密连接清晰可见。与对照组比较,模型组细胞间隙增大,藁本内酯、洋川芎内酯A、洋川芎内酯I组随着剂量增加,细胞间隙明显增大;藁本内酯(80 μg/mL)、洋川芎内酯A(80 μg/mL)组细胞整体回缩变圆,贴壁细胞数减少,紧密连接破坏严重;洋川芎内酯I组细胞形态与对照组相近,呈“铺路石”状,排列紧密。

图1 藁本内酯、洋川芎内酯A和洋川芎内酯I对MDCK-MDR1细胞形态的影响 (×100)Fig.1 Effect of ligustilide,senkyunolide A,and senkyunolide I on morphology of MDCK-MDR1 cells (× 100)
3.2 藁本内酯、洋川芎内酯A和洋川芎内酯I对MDCK-MDR1细胞存活率的影响
如图2所示,与对照组比较,模型组MDCK-MDR1细胞存活率显著降低(P<0.01);与模型组比较,藁本内酯(80 µg/mL)组、洋川芎内酯A组细胞存活率显著降低(P<0.01),洋川芎内酯I(80 µg/mL)组细胞存活率显著升高(P<0.05)。表明洋川芎内酯A(20~80 µg/mL)对细胞毒性较大,洋川芎内酯I在同等质量浓度范围内细胞毒性较小,且高剂量可提高OGD/R损伤的细胞存活率。

图2 藁本内酯、洋川芎内酯A和洋川芎内酯I对MDCK-MDR1细胞存活率的影响 ()Fig.2 Effect of ligustilide,senkyunolide A,and senkyunolide I on survival rate of MDCK-MDR1 cells(±s ,n=6)
3.3 藁本内酯、洋川芎内酯A和洋川芎内酯I对MDCK-MDR1细胞上清液LDH释放率的影响
以细胞上清液中LDH释放作为细胞损伤的指标,结果如图3所示,与对照组比较,模型组细胞上清液中LDH释放率显著升高(P<0.01);与模型组比较,藁本内酯(40、80 µg/mL)组、洋川芎内酯A组细胞上清液中LDH释放率显著升高(P<0.01),洋川芎内酯I(40、80 µg/mL)组细胞上清液中LDH释放率显著降低(P<0.05、0.01)。表明洋川芎内酯I可改善OGD/R诱导的细胞损伤。

图3 藁本内酯、洋川芎内酯A和洋川芎内酯I对MDCK-MDR1细胞上清液LDH释放率的影响(±s ,n=6)Fig.3 Effectof ligustilide,senkyunolide A,and senkyunolide I on LDH release rate in supernatant of MDCK-MDR1 cells (±s ,n=6)
3.4 藁本内酯、洋川芎内酯A和洋川芎内酯I对MDCK-MDR1细胞凋亡的影响
如图4所示,与对照组比较,模型组细胞凋亡率显著升高(P<0.01);与模型组比较,藁本内酯(20、40 µg/mL)组、洋川芎内酯I组细胞凋亡率显著降低(P<0.01),藁本内酯(80 µg/mL)组、洋川芎内酯A(40、80 µg/mL)组细胞凋亡率显著升高(P<0.05、0.01)。
3.5 藁本内酯、洋川芎内酯A和洋川芎内酯I对MDCK-MDR1细胞ZO-1、claudin-5、occludin、P-gp和GLUT-1蛋白表达的影响
如图5所示,与对照组比较,模型组细胞claudin-5、occludin和ZO-1蛋白表达水平显著降低(P<0.01),GLUT-1和P-gp蛋白表达水平显著升高(P<0.01);与模型组比较,藁本内酯(20 µg/mL)组细胞claudin-5、occludin和ZO-1蛋白表达水平显著升高(P<0.05、0.01),GLUT-1和P-gp蛋白表达水平显著降低(P<0.01);藁本内酯(40 µg/mL)组细胞claudin-5、ZO-1和GLUT-1蛋白表达水平显著降低(P<0.01),occludin蛋白表达水平显著升高(P<0.01);藁本内酯(80 µg/mL)组细胞claudin-5、occludin、ZO-1和GLUT-1蛋白表达水平显著降低(P<0.01),P-gp蛋白表达水平显著升高(P<0.01);洋川芎内酯A(20 µg/mL)组细胞claudin-5、ZO-1和P-gp蛋白表达水平显著降低(P<0.01),occludin和GLUT-1蛋白表达水平显著升高(P<0.01);洋川芎内酯A(40、80 µg/mL)组细胞claudin-5、occludin、ZO-1、GLUT-1和P-gp蛋白表达水平显著降低(P<0.01);洋川芎内酯I(20 µg/mL)组细胞claudin-5蛋白表达水平显著升高(P<0.01),GLUT-1和P-gp蛋白表达水平显著降低(P<0.01);洋川芎内酯I(40 µg/mL)组细胞claudin-5、occludin、ZO-1和P-gp蛋白表达水平显著升高(P<0.05、0.01),GLUT-1蛋白表达水平显著降低(P<0.01);洋川芎内酯I(80 µg/mL)组细胞claudin-5、occludin和P-gp蛋白表达水平显著升高(P<0.01),ZO-1和GLUT-1蛋白表达水平显著降低(P<0.01)。
3.6 藁本内酯、洋川芎内酯A和洋川芎内酯I对芍药苷在MDCK-MDR1细胞跨膜转运的影响
以芍药苷为探针药物[11],研究藁本内酯、洋川芎内酯A、洋川芎内酯I对芍药苷在OGD/R诱导的MDCK-MDR1细胞上跨膜转运的影响,如图6所示,与对照组比较,模型组细胞紧密连接受损,细胞膜通透性增加,芍药苷Papp显著升高(P<0.05);与模型组比较,藁本内酯(20 μg/mL)组、洋川芎内酯A(40、80 μg/mL)组和洋川芎内酯I组芍药苷Papp显著升高(P<0.05、0.01),促进芍药苷的跨膜转运。
4 讨论

图4 藁本内酯、洋川芎内酯A和洋川芎内酯I对MDCK-MDR1细胞凋亡的影响 (±s ,n=6)Fig.4 Effect of ligustilide,senkyunolide A,and senkyunolide I on apoptosis of MDCK-MDR1 cells (±s ,n=6)

图5 藁本内酯、洋川芎内酯A和洋川芎内酯I对MDCK-MDR1细胞ZO-1、claudin-5、occludin、P-gp和GLUT-1蛋白表达的影响 (±s ,n=3)Fig.5 Effect of ligustilide,senkyunolide A and senkyunolide I on ZO-1,claudin-5,occludin,P-gp,and GLUT-1 protein expressions in MDCK-MDR1 cells (±s ,n=3)
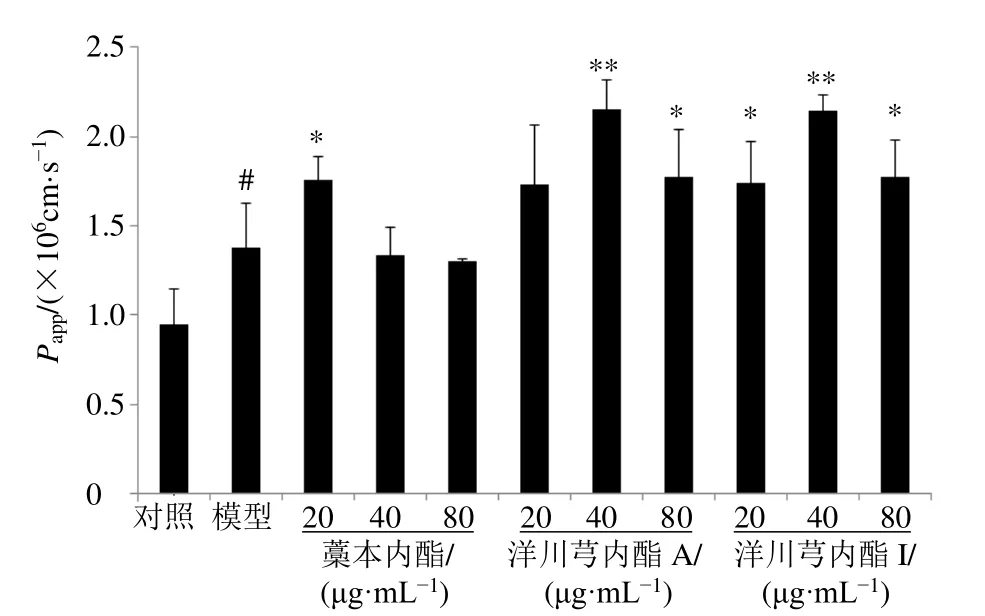
图6 藁本内酯、洋川芎内酯A和洋川芎内酯I对芍药苷在MDCK-MDR1细胞跨膜转运的影响 (±s ,n=3)Fig.6 Effect of ligustilide,senkyunolide A,and senkyunolide I on transport of paeoniflorin across membrane of MDCK-MDR1 cells (±s ,n=3)
脑卒中是我国成年人致死、致残的首位病因,也是我国疾病致寿命损失的首位病因。目前最有效的治疗手段是溶栓、降纤,但脑组织在缺血状态下恢复供血,会加重脑损伤,病情进一步恶化,从而出现CIRI,抑制细胞凋亡可以缓解缺血再灌注造成的伤害[12]。本研究结果表明,洋川芎内酯A和藁本内酯(80 μg/mL)会加剧OGD/R诱导的MDCKMDR1细胞损伤,洋川芎内酯I(80 μg/mL)显著升高OGD/R诱导的MDCK-MDR1细胞存活率;洋川芎内酯I(40、80 μg/mL)显著抑制OGD/R诱导的MDCK-MDR1细胞上清液中LDH释放率,藁本内酯(40、80 μg/mL)和洋川芎内酯A显著促进OGD/R诱导的MDCK-MDR1细胞上清液中LDH释放;藁本内酯(20、40 µg/mL)和洋川芎内酯I显著抑制细胞凋亡,藁本内酯(80 µg/mL)和洋川芎内酯A(40、80 µg/mL)显著促进细胞凋亡。因此,与藁本内酯和洋川芎内酯A相比,洋川芎内酯I在相同质量浓度下对OGD/R诱导的MDCK-MDR1细胞毒性较小,可抑制OGD/R诱导的MDCK-MDR1细胞凋亡和LDH释放,从而提高细胞膜的稳定性,保护受损细胞。低剂量藁本内酯具有类似洋川芎内酯I的作用,高剂量藁本内酯加速细胞损伤。洋川芎内酯A(20~80 µg/mL)对OGD/R诱导的MDCK-MDR1细胞毒性较大,促进细胞凋亡和LDH释放。
血管内皮细胞间的紧密连接是血脑屏障维持结构与功能的重要基础。紧密连接蛋白ZO-1是其重要组成蛋白之一,血脑屏障的变化与ZO-1水平密切相关[13]。Claudin-5是血脑屏障中最主要的跨膜蛋白,是紧密连接蛋白的主要组成部分,主要在脉络膜丛和脑毛细血管的内皮细胞中高表达[14-15]。Occludin是一种由细胞内氨基和羧基末端组成的四通路跨膜蛋白,也是细胞旁屏障的功能成分[16]。血脑屏障的损伤在CIRI的发生发展中起重要作用。缺血性脑卒中再灌注后,缺血区线粒体能量代谢障碍、呼吸链受阻,导致活性氧自由基(reactive oxygen species,ROS)大量产生,ROS攻击细胞膜并破坏细胞骨架,降解跨膜蛋白和胞质附着蛋白,破坏紧密连接蛋白复合体(tight junction protein systerm,TJPs),从而破坏血脑屏障[17]。炎性反应是缺血性脑卒中再灌注后损伤发生发展的重要病理过程,CIRI引起炎性因子如肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)和IL-6大量释放,TNF-α和IL-1β刺激中性粒细胞进一步产生炎性因子,从而诱发炎性级联反应,导致TJPs结构损坏,进而增加血脑屏障通透性[18-19]。通过药物干预保护脑CIRI大鼠TJPs结构能够有效降低血脑屏障通透性并缓解脑水肿,减轻CIRI[20]。藁本内酯(5、10、20µmol/L)能够通过上调紧密连接蛋白表达,保护OGD诱导的体外血脑屏障共培养细胞损伤[21]。本研究结果表明,20 µg/mL藁本内酯能够通过上调紧密连接蛋白ZO-1、occludin和claudin-5蛋白表达水平,恢复OGD/R诱导的MDCK-MDR1细胞生物屏障功能,但随剂量增加,紧密连接蛋白表达水平降低,血脑屏障膜通透性增加;洋川芎内酯I(20~80 µg/mL)可上调紧密连接蛋白ZO-1、occludin和claudin-5蛋白表达水平,恢复OGD/R诱导的MDCK-MDR1细胞生物屏障功能;洋川芎内酯A(20~80 µg/mL)下调紧密连接蛋白表达水平,加剧血脑屏障损伤。
P-gp是一种跨膜糖蛋白,在肝、肠、脑、肾、等组织中表达,P-gp可通过促进外源性化合物外排,对组织器官起到保护作用[22]。缺血性脑卒中使P-gp水平显著升高,导致神经保护药物生物利用度降低、疗效减小[23]。抑制P-gp蛋白表达,可以增加P-gp底物维拉帕米细胞内质量浓度[24]。本研究结果显示,洋川芎内酯A(20~80 µg/mL)可抑制外排蛋白P-gp表达水平,增加配伍药物的跨膜转运,从而提高疗效。20 µg/mL藁本内酯、洋川芎内酯I可下调P-gp蛋白表达水平,但剂量升高时,可上调P-gp蛋白表达水平,不利于配伍药物的跨膜转运。
缺血性脑卒中大鼠缺血后葡萄糖水平降低,再灌注后葡萄糖水平略有提升,但再灌注24 h后仍未恢复到基线水平[25];由于缺血再灌注后大脑的能量需求增加,葡萄糖及其代谢显著影响缺血性脑卒中的疗效和长期恢复[26-27],增加血脑屏障葡萄糖转运,缓解能量代谢障碍,可减少神经元死亡[28]。本研究结果显示,与对照组比较,模型组GLUT-1蛋白表达水平显著升高,表明葡萄糖需求增加,细胞代偿性上调GLUT-1用于自我修复。尼古丁/可替宁和含有尼古丁的电子烟蒸气可以显著降低缺血性脑卒中大脑葡萄糖的利用,加剧病情,其机制与下调GLUT-1蛋白表达水平有关[29]。与模型组比较,20 μg/mL洋川芎内酯A显著增加GLUT-1蛋白表达水平,藁本内酯(20~80 µg/mL)、洋川芎内酯I(20~80 µg/mL)和洋川芎内酯A(40~80 µg/mL)均显著抑制GLUT-1蛋白表达水平,由于藁本内酯、洋川芎内酯I和洋川芎内酯A均可不同程度地下调OGD/R诱导的MDCK-MDR1细胞GLUT-1蛋白表达水平,减少细胞对葡萄糖的需求,因此可能加剧细胞损伤,但仍需进一步研究验证。
课题组前期研究表明芍药苷为难透血脑屏障的药物,其跨膜转运以被动扩散为主,兼有主动转运,为P-gp蛋白的底物,受到P-gp的外排作用。本研究结果表明,藁本内酯(20 μg/mL)显著增加芍药苷在OGD/R诱导的MDCK-MDR1细胞上的跨膜转运,藁本内酯(20 μg/mL)可上调紧密连接蛋白ZO-1、claudin-5和occludin表达水平,恢复血脑屏障的生物屏障功能,减小芍药苷的细胞间隙转运,但可能由于以抑制P-gp蛋白表达、增加芍药苷跨膜转运为主,最终表现为芍药苷跨膜转运增加。藁本内酯(80 μg/mL)可以显著减少芍药苷在OGD/R诱导的MDCK-MDR1细胞上的跨膜转运,由于藁本内酯(80 μg/mL)下调紧密连接蛋白ZO-1、claudin-5和occludin蛋白表达水平,增加膜通透性,增加芍药苷的细胞间隙转运,但可能由于以上调P-gp蛋白表达水平、减少芍药苷跨膜转运为主,最终表现为芍药苷跨膜转运减小。洋川芎内酯A促进芍药苷跨膜转运,可能与洋川芎内酯A抑制紧密连接蛋白和P-gp外排蛋白表达水平有关;洋川芎内酯I细胞毒性最低,使细胞紧密相连,显著上调P-gp蛋白表达,但仍增加了芍药苷的转运,可能与其他机制有关。
利益冲突所有作者均声明不存在利益冲突
