三七皂苷R1-低相对分子质量三七多糖纳米粒的制备及其对SH-SY5Y细胞损伤的保护作用
2021-05-27张梦雪王瑞莹吴晨阳郑婷婷邹佩志郭一飞孙桂波董政起
张梦雪,王瑞莹,李 楠,吴晨阳,郑婷婷,邹佩志,韩 杰,张 运,黎 迎,郭一飞,2,孙桂波,2,董政起,2*
1.中国医学科学院北京协和医学院 药用植物研究所,北京 100193
2.中国医学科学院 基于经典名方的新药发现重点实验室,北京 100193
三七Panax notoginseng(Burk.) F.H.Chen被称为“中药之最珍贵者”,《中国药典》2020年版中规定,三七皂苷R1含量作为判定三七质量的主要指标之一。三七皂苷R1是三七总皂苷的特征化合物,具有抗炎、改善糖尿病性视网膜病变[1]、保护心肌细胞[2]、减轻脑损伤[3]、促进骨细胞生成[4]、抗肿瘤[5]、抑制血管平滑肌细胞增殖[6]等多重药理作用。在临床用药过程中发现三七皂苷R1的生物利用度较低,这主要是由于三七皂苷R1属于生物制药分类系统(biopharmaceutics clas-sification system,BCS)分类中Ⅳ类(低溶低渗)药物[7],低溶低渗的特性造成三七皂苷R1在经口服给药后,不易被转运吸收。
纳米给药体系(nanometer drug delivery system,NDDS)是纳米级的递送系统,在药物递送过程中具有增溶、缓释、提高生物利用度等优势[8]。为了提高三七皂苷R1的口服生物利用度,提高药效。目前有以纳米材料为载体制备三七皂苷R1纳米给药体系的相关研究,如三七皂苷R1-聚乳酸-羟基乙酸共聚物(PLGA)纳米微球[9]、三七皂苷R1壳聚糖纳米粒[10]等,证明均可提高三七皂苷R1的口服生物利用度。在纳米载体的选择上,目前常添加表面活性剂类,如聚山梨酯80;有机溶剂类,如聚乙二醇[11];环糊精[12]等对难溶药物进行增溶。虽然起到了很好的作用,但此类外源化合物载体可能会引发安全性问题,出现不良反应等[13-14]。拟在三七自身寻找一种“自源性”成分作为药物载体,在提高三七皂苷R1溶解度同时增强其治疗效果。
近年来,天然多糖因其生物相容性好、来源广泛、易降解等优势被广泛关注[15]。提取三七皂苷类成分后的三七药材残渣中常含有水溶性的三七多糖(Panax notoginsengpolysaccharide,PNP),安全、无毒、可降解,官能团众多,水溶性良好且具有一定黏性。此外PNP还具有降血糖[16]、促进骨细胞生成[17]、抗氧化[18]、改善脂质代谢紊乱[19]、抗肿瘤[20]、免疫调节[21]、抗衰老[22]等药理作用。
基于多糖载体在纳米给药体系中的应用,借鉴同源载体及药物的协同作用,本实验拟通过研究同样源自于三七药材的成分三七多糖,对其进行分级纯化得到低相对分子质量三七多糖(low molecular weightPanax notoginsengpolysaccharide,PNP-L)作为递送三七皂苷R1的载体,通过乳化溶剂挥发法形成纳米粒,方法简单且未添加其他外源辅料,保证了制剂的安全性。探索PNP-L作为三七皂苷R1载体的优势以及联用后对于缺氧/复氧诱导的SH-SY5Y细胞损伤的保护作用,使其用于更多心脑疾病的治疗。
1 仪器与材料
1.1 仪器
Agilent 1200高效液相色谱仪,美国Agilent公司;岛津LC-20AD液相色谱仪,日本岛津公司;Secura224-1CN电子分析天平,德国Satrorius公司;Zetasizer Nano ZS纳米粒度及Zeta电位分析仪,英国Malvern公司;KQ-500DE型数控超声波清洗器,昆山市超声仪器有限公司;SP131010-33Q加热磁力搅拌器,美国Barnstead Thermolyne;RE-5205旋转蒸发仪,上海亚荣生化仪器厂;JEM-1200EX(120 kV)透射电子显微镜(TEM),JEOL公司;Spark多功能酶标仪,瑞士Tecan公司;Pion μDiss药物溶解吸收测试系统,美国Pion公司;L550台式低速大容量离心机,德国Eppendorf公司;371二氧化碳培养箱,美国Thermo Scientific公司;Type III型厌氧手套培养箱,美国COY Laboratory;超净工作台,上海力申科学仪器有限公司;25 cm2培养瓶、96孔板,美国Corning公司。
1.2 药品与试剂
三七皂苷R1(质量分数为99.06%)、三七多糖(质量分数>98%),上海融禾医药科技发展公司;娃哈哈纯净水;窄分布聚乙二醇(polyethylene glycol,PEG)标样组(质量分数>99%),日本TOSOH(TSK东曹)公司;对照品葡萄糖、甘露糖、半乳糖、木糖、岩藻糖质量分数≥99%,对照品阿拉伯糖、N-乙酰-氨基半乳糖、核糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、N-乙酰-氨基葡萄糖质量分数≥98%,单糖对照品均购于中国食品药品检定研究院;甲醇、乙腈、乙醇、浓硫酸、盐酸,天津市北联精细化学品开发有限公司;磷酸二氢钾、氢氧化钠、苯酚,天津市大茂化学试剂厂;正丁醇,北京化工厂;三氯甲烷,北京市通广精细化工公司;硝酸钠、叠氮化钠、1-苯基-3-甲基-5-吡唑啉酮(PMP)、三氟乙酸,上海麦克林生化科技有限公司;醋酸双氧铀,北京中镜科仪技术有限公司;人神经母细胞瘤SH-SY5Y细胞,购于中国医学科学院基础医学研究所基础医学细胞中心;Cell Counting Kit-8,日本同仁公司;DMEM培养基、进口胎牛血清,美国Gibco公司;胰酶细胞消化液,Beyotime公司;二甲基亚砜,美国Sigma-Aldrich公司。
2 方法与结果
2.1 三七多糖的制备及性质研究
2.1.1 三七多糖的分级纯化 将三七多糖用Sevage法除蛋白后,根据葡聚糖凝胶色谱柱分子筛原理对其进行分级色谱,每次取三七多糖100.0 mg溶解于2.0 mL水中,过0.45 μm滤膜,经Sephadex G-100凝胶色谱柱(100 cm×2.0 cm),用纯水洗脱,经苯酚-硫酸法显色后于波长490 nm处测定吸光度,直至检测不到吸光度,并绘制管数-吸光度曲线,得到2部分三七多糖,分开收集并冻干机冷冻干燥24 h,记为高相对分子质量三七多糖(high molecular weightPanax notoginsengpolysaccharide,PNP-H)、PNP-L。为确保每次多糖分离的重现性,需保证柱内凝胶体积一致,上样量与质量浓度一致,如若体积流量变慢,则需更换新的凝胶,每次多糖分离均采用苯酚-硫酸法进行吸光度测定,以此保证实验的重现性。
2.1.2 三七多糖相对分子质量的测定 选用TSK gel G4000 PWXL凝胶色谱柱;流动相为0.05 mol/L硝酸钠+0.06%叠氮化钠水溶液;体积流量0.6 mL/min;柱温35 ℃;PEG标样组,相对分子质量500~500 000;手动六通阀进样器(定量环20 μL)。取三七多糖、PNP-H、PNP-L粉末,加纯净水制成10 mg/mL溶液,25 ℃超声10 min,静置3 h使其充分溶解,摇匀,5000 r/min离心10 min,取上清液作为供试品进样分析。另取PEG标样组,作为对照品溶液做标准曲线,相对校正法测三七多糖、PNP-H、PNP-L的相对分子质量。
重均相对分子质量(Mw)和数均相对分子质量(Mn)测定结果见表1,Mn=3124的PNP-L占比较大,约占三七多糖的82.21%,其余为Mn=34 173的PNP-H。从相对分子质量分布系数(Mw/Mn)来看,PNP-L值较小,说明相对均一,通过观察发现PNP-L水溶性优于PNP-H。通常情况下低相对分子质量多糖相比于高相对分子质量多糖水溶性好,生物相容度高,相对生物活性也更高[23];此外,有研究发现低相对分子质量多糖较高相对分子质量多糖更易被益生菌利用,促进益生菌的增殖效果更为显著,对于肠道吸收的药物具有现实意义[24],因此,后续研究主要针对三七多糖和PNP-L展开。

表1 三七多糖、PNP-H、PNP-L相对分子质量Table 1 Molecular weight of PNP,PNP-H and PNP-L
2.1.3 单糖组成的测定 为进一步了解多糖的组成,采用PMP衍生化/HPLC法对三七多糖、PNP-L水解产物的单糖组分进行鉴定并用单标定量法计算各单糖组分的质量分数。
(1)色谱条件:岛津LC-20AD液相色谱仪;色谱柱为Xtimate C18柱(200 mm×4.6 mm,5 μm);柱温30 ℃;体积流量1.0 mL/min;检测波长250 nm;进样量20 μL;流动相为0.05 mol/L磷酸二氢钾溶液(氢氧化钠溶液调pH 6.70)-乙腈(83∶17)。
(2)对照品溶液:精密称取甘露糖、核糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、N-乙酰-氨基葡萄糖、葡萄糖、N-乙酰-氨基半乳糖、半乳糖、木糖、阿拉伯糖、岩藻糖对照品适量,加水溶解稀释至各对照品均为50 μg/mL的混合对照溶液。
(3)对照品溶液衍生:精确吸取250 μL混合对照溶液到5 mL EP管中,加入250 μL 0.6 mol/L NaOH水溶液、500 μL 0.4 mol/L PMP甲醇溶液,70 ℃条件下反应1 h,冷水中冷却10 min;加入500 μL 0.3 mol/L HCl水溶液中和,再加入1 mL氯仿漩涡1 min,3000 r/min离心10 min,小心取上清液,重复萃取3次,上清液用于HPLC分析。
(4)待测样品水解:精密称取三七多糖、PNP-L样品适量至5 mL安培瓶中,加入5 mL,2 mol/L三氟乙酸于5 mL安瓿中,封管,110 ℃酸解4 h,取出挥干三氟乙酸后加1.0 mL水复溶。
(5)样品溶液衍生:精确吸取250 μL样品溶液到5 mL EP管中,加入250 μL 0.6 mol/L NaOH水溶液,500 μL 0.4 mol/L PMP甲醇溶液,70 ℃条件下反应1 h,冷水中冷却10 min;加入500 μL 0.3 mol/L HCl中和,再加入1 mL氯仿漩涡1 min,3000 r/min离心10 min,小心取上清液,重复萃取3次,取上清液,即得。
HPLC结果见图1,单糖组成结果见表2,三七多糖主要由葡萄糖、阿拉伯糖、木糖,还有少量葡萄糖醛酸、甘露糖、岩藻糖和半乳糖组成;PNP-L主要由葡萄糖、木糖、阿拉伯糖,还有少量甘露糖、葡萄糖醛酸、半乳糖、岩藻糖组成。与三七多糖相比,PNP-L葡萄糖、甘露糖比例更高。

图1 混合对照品 (A)、三七多糖 (B)、PNP-L (C) HPLC图Fig.1 HPLC of mixed reference substances (A),PNP (B)and PNP-L (C)
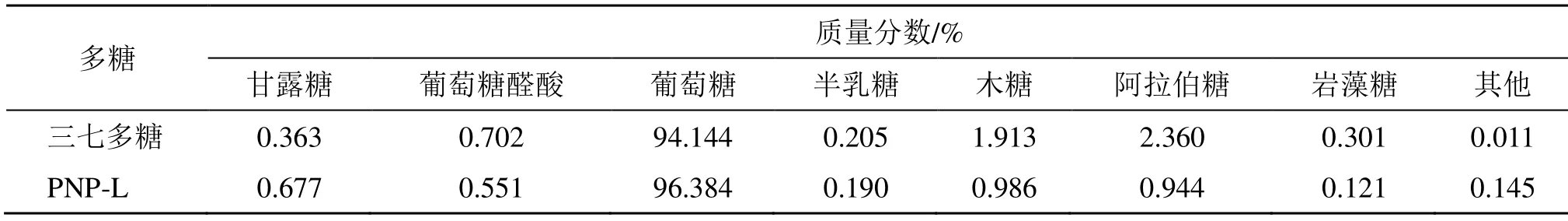
表2 三七多糖、PNP-L单糖组成Table 2 Monosaccharide ratio of PNP and PNP-L
2.2 三七皂苷R1纳米粒载体的筛选
HPLC法建立标准曲线测定纳米粒中三七皂苷R1,通过考察和比较R1-PNP纳米粒和R1-PNP-L纳米粒的载药量和包封率,筛选出三七皂苷R1纳米粒最佳的多糖载体。
2.2.1 纳米粒制备方法 采用溶剂挥发法制备纳米粒,将三七多糖和PNP-L配制成1.0 mg/mL水溶液,三七皂苷R1配制为2.0 mg/mL乙醇溶液,按照药载质量比1∶2制备纳米粒,用注射器(13 mm×0.45 mm)将三七皂苷R1乙醇溶液分别逐滴加入三七多糖和PNP-L水溶液中,超声20 min,使其形成纳米乳液,室温下在磁力搅拌器上搅拌2 h除去有机溶剂,以13 000 r/min超速离心30 min收集纳米粒,45 ℃真空干燥48 h后即得三七皂苷R1-三七多糖(R1-PNP)纳米粒和三七皂苷R1-PNP-L(R1-PNP-L)纳米粒。
2.2.2 三七皂苷R1含量测定方法
(1)色谱条件:色谱柱为Agilent TC-C18柱(250 mm×4.6 mm,5 μm);流动相为乙腈-水(22∶78);柱温30 ℃;体积流量为1.0 mL/min;检测波长为203 nm;进样量10 μL;理论塔板数应不低于3000[10]。
(2)标准曲线的绘制:将三七皂苷R1配制成0.050、0.100、0.125、0.250、0.500、1.000 mg/mL甲醇溶液,超声后过0.45 μm滤膜,用HPLC测定三七皂苷R1质量浓度,计算线性回归方程。以峰面积对质量浓度的回归方程为Y=2.803 2X-30.699,r=0.999 9,其线性范围良好,线性范围为0.050~1.000 mg/mL。
(3)精密度试验:分别配制低、中、高(0.050、0.125、1.000 mg/mL)3个质量浓度的三七皂苷R1对照品,测得各质量浓度三七皂苷R1日内精密度RSD分别为1.06%、0.25%、0.38%,日间精密度分别为1.75%、1.26%、1.19%,RSD均<2%,表明该方法精密度良好。
(4)稳定性试验:配制0.1 mg/mL三七皂苷R1对照品甲醇溶液,在室温下放置0、2、4、6、8 h,测定其峰面积并计算得到RSD为1.22%,表明在室温下8 h内稳定性良好,可满足自动进样的要求。
(5)重复性试验:平行制备6份0.1 mg/mL三七皂苷R1对照品溶液,相同条件下进样测定,计算得到RSD为1.43%,说明重复性良好。
(6)回收率试验:取未经冷冻干燥空白纳米粒1 mL,分别加入0.4、0.6、1.0 mg/mL的三七皂苷R1对照品甲醇溶液1 mL,每个浓度平行3次,根据标准曲线计算得到平均回收率分别为98.27%、98.64%、99.21%,RSD分别为1.32%、1.86%、1.55%,符合含量测定的方法学要求。
2.2.3 载药量和包封率的测定 制备纳米粒时的药物投入量记为W1,精确称定冻干后的纳米粒粉末,质量记为W2;加入适量的甲醇溶液使纳米粒完全溶解,采用“2.2.2”项下色谱条件测定三七皂苷R1质量浓度,得到纳米粒中三七皂苷R1质量(W3),根据下述公式计算载药量和包封率。由表3可见,R1-PNP-L纳米粒比R1-PNP纳米粒载药量和包封率均有显著提高,因此,选择PNP-L作为三七皂苷R1载体。
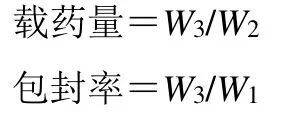
表3 纳米粒的载药量、包封率测定结果 (±s,n=3)Table 3 Measurement results of drug loading and encapsulation efficiency (±s,n=3)

表3 纳米粒的载药量、包封率测定结果 (±s,n=3)Table 3 Measurement results of drug loading and encapsulation efficiency (±s,n=3)
纳米粒 载药量/% 包封率/%R1-PNP 23.92±0.12 71.76±1.27 R1-PNP-L 28.62±0.14 85.85±1.21
2.3 纳米粒对三七皂苷R1溶解度的影响
按照“2.2.1”项下方法制备R1-PNP-L纳米粒,将三七皂苷R1与PNP-L按照质量比1∶2溶于纳米粒等体积的水中,玻璃棒搅拌至溶解即得物理混合制剂组,考察PNP-L的加入与不同结合方式对三七皂苷R1溶解度的影响。
采用Pion μDiss药物溶解吸收测试系统,将过量的三七皂苷R1、R1-PNP-L物理混合制剂及R1-PNP-L纳米粒溶于20 mL水中,并置于样品杯中(保持三七皂苷R1质量浓度相同),动态监测三七皂苷R1、R1-PNP-L物理混合制剂及R1-PNP-L纳米粒中三七皂苷R1的溶解度,37 ℃条件下以200 r/min的速度搅拌,采集间隔为60 s,直至溶解度在1 h内保持稳定,并按公式增溶倍数=物理混合制剂或纳米粒中三七皂苷R1溶解度/三七皂苷R1溶解度计算得相应增溶倍数。由图2可知,R1-PNP-L物理混合制剂将三七皂苷R1溶解度提升至22.75倍,纳米粒将三七皂苷R1溶解度提升至32.26倍。

图2 物理混合制剂、纳米粒对三七皂苷R1溶解度的影响Fig.2 Solubilization effect of physical mixing and nanoparticles on notoginsenoside R1
实验均采用单因素方差分析(One-Way ANOVA),P<0.05为差异有统计学意义。2种制剂与单独使用三七皂苷R1相比,均具有显著性(P<0.001),纳米粒组对于物理混合制剂组对提高溶解度也具有显著性差异(P<0.001),说明PNP-L与三七皂苷R1联用,可以有效提高三七皂苷R1在水中的溶解度,纳米粒制剂在提高溶解度方面具有更加明显的优势。
2.4 R1-PNP-L纳米粒测量与表征
2.4.1 平均粒径、多分散指数(PDI)、Zeta电位测定 取一定量的R1-PNP-L纳米粒,在纳米粒度及Zeta电位分析仪上分析其平均粒径、PDI及Zeta电位,结果R1-PNP-L纳米粒的平均粒径为(139.17±7.22)nm,PDI为0.41±0.19,Zeta电位为(−19.14±3.14)mV。纳米粒粒径较小,Zeta电位较大。但PDI较大,这与PNP-L自身性质有关,PNP-L成分复杂,已作均质处理,为确保PNP-L保持其药理活性,此处未针对PNP-L的PDI进行过多优化处理。
2.4.2 R1-PNP-L纳米粒晶型分析 用DSC差示扫描量热仪对三七皂苷R1、PNP-L、R1-PNP-L物理混合制剂、R1-PNP-L纳米粒进行分析。以空白坩埚为参比物,另一坩埚放入6~10 mg样品,温度范围为40~200 ℃,10 ℃/min。氮气作为保护气,保护气体积流量为60 mL/min;吹扫气体体积流量为40 mL/min。由图3可知,三七皂苷R1在174.43 ℃有1吸热峰,判定为其熔融峰,在结晶之后熔融,PNP-L熔融峰为154.06 ℃,R1-PNP-L物理混合制剂在145.23、158.88 ℃存在2个熔融峰,说明没有形成一稳定物质,R1-PNP-L纳米粒熔融峰为156.90 ℃,纳米粒中三七皂苷R1的熔融峰完全消失,说明三七皂苷R1被包载在载体中,该纳米粒在人工模拟的胃肠液中6 h内可稳定存在,粒径变化范围较小,无肉眼可见沉淀产生,推测可有效减少三七皂苷R1在胃中被酸性环境破坏。
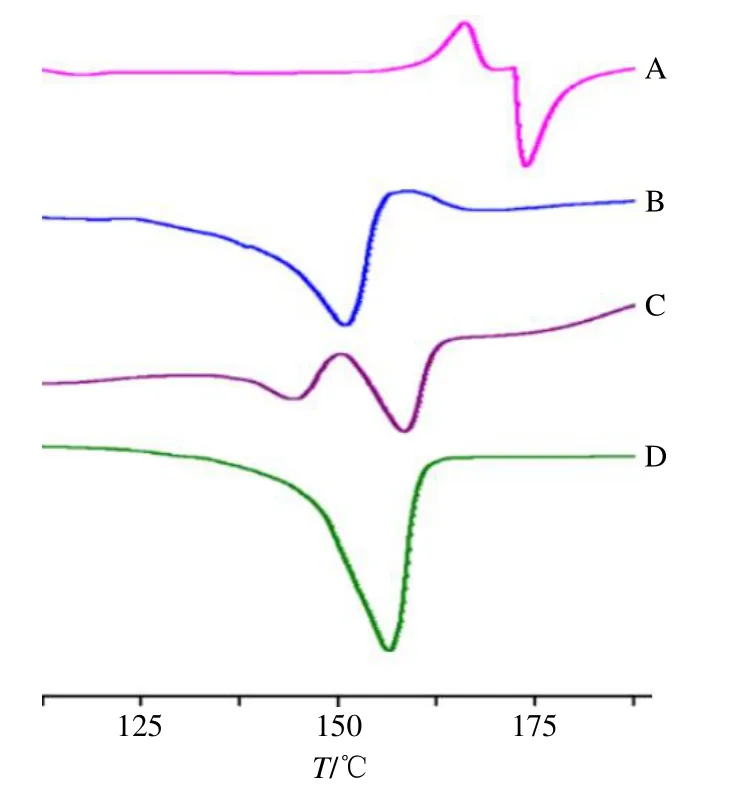
图3 三七皂苷R1 (A)、PNP-L (B)、三七皂苷R1与PNP-L物理混合制剂 (C)、R1-PNP-L纳米粒 (D) 的DSC图Fig.3 DSC thermograms of notoginsenoside R1 (A),PN-L(B),physical mixed preparation of notoginsenoside R1 and PNP-L (C) and R1-PNP-L nanoparticles (D)
2.4.3 R1-PNP-L纳米粒的形态学考察 将R1-PNPL纳米粒负染制样:将镀碳支持膜铜网放到封口膜上,滴1滴样品(约30 μm)到支持膜上,停留2~5 min,用带尖的滤纸从边缘部分吸去多余的溶液,拿到滤纸上停留10 min左右。再把干燥后的支持膜放到封口膜上,滴1滴醋酸双氧铀染液,染色90 s,用带尖的滤纸吸去多余的染液,夹到滤纸上干燥3 h,在透射电镜下观察。如图4所示,纳米粒呈球状,粒径均为200 nm下。
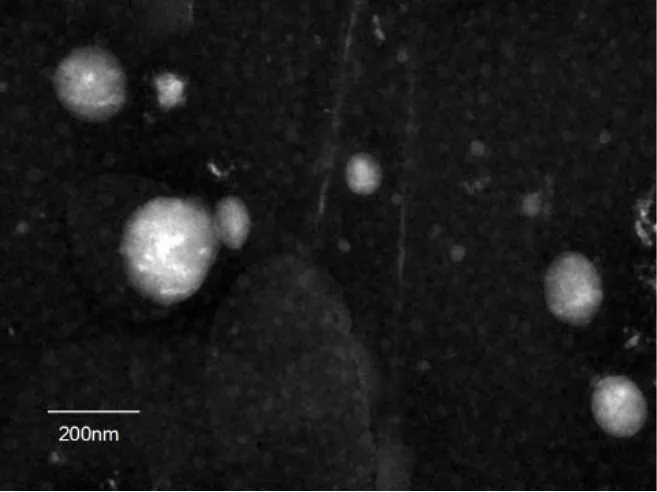
图4 R1-PNP-L的TEM图Fig.4 TEM image of R1-PNP-L
2.5 体外释药特性研究
精密吸取三七皂苷R1质量浓度均为1 mg/mL的三七皂苷R1原料药、R1-PNP-L物理混合制剂、R1-PNP-L纳米粒各5 mL,装入经蒸馏水浸泡处理过的透析袋(相对分子质量3000)内,将袋口扎紧,以50 mL 磷酸盐缓冲液(PBS)为释放介质。在37 ℃水浴恒温搅拌(100 r/min)。在预设时间点(0、1、2、4、6、8、10、12 h)取样1 mL,同时补加相同体积释放介质。由于更换溶质为PBS,因此按照“2.2.2”项下的色谱条件,重新进样测定后绘制标准曲线,得到峰面积对质量浓度的线性回归方程为Y=4.013 2X-0.316 4,r=0.999 6,线性范围49.2~1 000.4 μg/mL。将所取样品10 000 r/min离心10 min后,取上清液通过HPLC法测定释放介质中三七皂苷R1的含量,计算累积释放率(实验平行3份),绘制体外释放曲线。由图5可知,与三七皂苷R1原料药相比,R1-PNP-L物理混合制剂组中的三七皂苷R1释放速度略有减慢,说明与PNP-L联用可减缓三七皂苷R1释放速率,但并不明显;而纳米粒组释放速度明显减慢,在4 h时,累积释放率达到80.07%,10 h后累积释放率达到90%以上,说明具有一定的缓释作用。这可能是由于三七皂苷R1与PNP-L通过氢键结合形成相对稳定的结构,可有效减缓三七皂苷R1的释放速度。

图5 三七皂苷R1体外释放曲线 (±s,n=3)Fig.5 In vitro release curve of notoginsenoside R1 (±s,n=3)
2.6 R1-PNP-L纳米粒细胞毒性评价
培养SH-SY5Y神经细胞,按照1×105个/mL的密度铺板,并在实验前生长36 h。在96孔板中,移入SH-SY5Y神经细胞,加入含10%胎牛血清DMEM培养基,每孔100 μL,37 ℃、5% CO2条件下孵育至铺满96孔板后,弃去原培养液。取三七皂苷R1、PNP-L、三七皂苷R1与PNP-L物理混合制剂、R1-PNP-L纳米粒,用不含胎牛血清DMEM培养基配制成不同质量浓度(12.5、62.5、125.0、250.0、500.0 μg/mL)的各药物作为给药组,以直接加入不含胎牛血清的DMEM培养基作为对照组,用CCK-8试剂盒检测细胞活力,用酶标仪在450 nm下测量每个孔的吸光度,计算细胞活力,SPSS软件计算是否有显著性差异,P<0.05为差异有统计学意义。
细胞活力=(给药组或模型组细胞吸光度值-本底吸光度值)/(对照细胞吸光度值-本底吸光度值)
由图6可知,三七皂苷R1、PNP-L、R1-PNP-L物理混合制剂、R1-PNP-L纳米粒在500.0 μg/mL内对正常SH-SY5Y细胞安全、无毒性,与对照组相比无显著性差异,可在此范围内选择适合的浓度开展实验。

图6 三七皂苷R1 (a)、PNP-L (b)、R1-PNP-L物理混合制剂 (c)、R1-PNP-L纳米粒 (d) 对SH-SY5Y细胞活力的影响Fig.6 Effects of notoginsenoside R1 (a),PNP-L (b),R1-PNP-L physical mixed preparation (c),and R1-PNP-L nanoparticles (d) on viability of SH-SY5Y cells
2.7 R1-PNP-L纳米粒对SH-SY5Y细胞损伤的保护作用
培养SH-SY5Y细胞接种在含10%胎牛血清(FBS)的DMEM培养液中,在37 ℃,5% CO2培养箱中培养。0.25%胰酶消化并收集对数生长期的SH-SY5Y细胞,用含10%胎牛血清的DMEM培养液混悬细胞,调整细胞悬液浓度1×105个/mL并加入到96孔板中,每孔加入100 μL细胞悬液,在5%CO2,37 ℃培养条件下孵育24 h,至细胞达到70%~80%融合率,弃旧培养液,依次加入12.5、25.0、50.0、100.0 μg/mL质量浓度的三七皂苷R1、R1-PNP-L物理混合制剂、R1-PNP-L纳米粒。作用2 h后,在厌氧培养箱中缺氧处理4.5 h,再移入CO2培养箱中复氧2 h构建缺氧/复氧模型。复氧2 h后,避光加入CCK-8,每孔10 μL。1.5 h后,在酶标仪上450 nm波长处测定吸光度值,计算每孔细胞活力,SPSS软件计算是否有显著性差异。
由图7可知,R1-PNP-L物理混合组相比于三七皂苷R1,细胞活力略有提高,在低质量浓度12.5 μg/mL时,差异显著(P<0.01),三七皂苷R1、R1-PNP-L纳米粒对SH-SY5Y细胞缺氧/复氧诱导的凋亡具有抑制作用,并均呈剂量相关性,随着药物质量浓度的提高,存活的细胞比例升高。各质量浓度R1-PNP-L纳米粒与三七皂苷R1单用相比,细胞活力均有显著提高。

图7 三七皂苷R1、R1-PNP-L物理混合、R1-PNP-L纳米粒对SH-SY5Y缺氧复氧损伤的保护作用Fig.7 Protective effects of notoginsenoside R1,R1-PNP-L physical mixed preparation,R1-PNP-L nanoparticles on SH-SY5Y hypoxia-reoxygenation
在100 μg/mL时,纳米粒组与单独用三七皂苷R1相比,细胞活力从49.66%提升至61.60%。推测PNP-L具有PNP的抗氧化、抗炎等多重作用,与三七皂苷R1联用在低浓度时有效抑制了缺氧/复氧诱导的细胞凋亡,起到保护作用,而纳米粒组更易被细胞摄取发挥药效。
3 讨论
PNP-L水溶性良好,以溶剂挥发法包载三七皂苷R1,采用毒性较低的乙醇作为有机相且未引入其他外源辅料,可以最大限度保证制剂的“自源性”。由于多糖成分复杂且具有一定的黏性,有着大量官能团,因此,PNP-L在包载三七皂苷R1的过程中可能起到一种天然的表面活性剂的作用[25],能够有效提高中药成分的溶解度以提高生物利用度。由于人体内缺乏直接分解非淀粉类多糖的酶类,因此非淀粉类多糖难以被胃肠道消化吸收,并且对胃肠动力有一定的积极作用[26],这为多糖作载体的纳米粒提供了口服给药的可能性。
PNP-L相对分子质量相对均一,相比于PNP来说在水溶液中性质更加稳定,R1-PNP-L纳米粒在模拟人工胃、肠液中稳定性良好,6 h内粒径未有明显变化,无可见沉淀产生。由于PNP-L组成中主要单糖为葡萄糖,推测可给受损的SH-SY5Y细胞提供能量;此外,PNP也具有抗炎、抗氧化等多重药理作用,可能与三七皂苷R1配伍发挥协同作用,因此R1-PNP-L纳米粒比单独使用三七皂苷R1时对缺氧/复氧诱导的SH-SY5Y细胞凋亡效果增强。
作为药物递送载体,中药多糖本身成分复杂,因此如何控制多糖的质量,还需不断地探索,应从产地、运输方式、储存方法、含量及单糖组成等加以控制,才有可能大范围应用到临床用药中。本实验采用葡聚糖凝胶柱分离三七多糖,为保证分离完全,选择相对细且长的凝胶柱且上样量较小,可减少多糖在柱内凝胶的吸附,结果更加准确且有利于凝胶的重复利用。实验结果表明PNP-L有成为一种递送三七皂苷类成分良好载体的潜力,有利于三七资源可持续利用,对于其他皂苷成分是否具有普适性仍需继续验证。
利益冲突所有作者均声明不存在利益冲突
