人参皂苷Rg1调节氧化应激和炎症因子表达改善糖尿病大鼠周围神经损伤①
2021-05-26吴丽娜范晓萌武爽郭红艳徐晶刘颖黄丹璇张春晶赵正林
吴丽娜 范晓萌 武爽 郭红艳 徐晶 刘颖 黄丹璇 张春晶赵正林
(齐齐哈尔医学院医学技术学院,齐齐哈尔 161006)
糖尿病周围神经病变(diabetic peripheral neu-ropathy,DPN)是目前糖尿病最常见的慢性并发症之一,发病率高达50%以上;随着病程延续,严重者会造成截肢,致残率较高。DPN的发病机制复杂,至今尚未明确,多数研究者认为其与体内代谢紊乱导致的神经营养因子含量变化、微循环障碍与血管损伤、氧化应激、细胞炎症因子的堆积等因素有关[1‐2]。因其复杂的发病机制,临床上DPN尚无规范而效果良好的治疗药物。目前,中药治疗DPN受到广泛关注,而人参是常用的名贵药材,具有大补元气、养血生津、宁心益智等功效。人参皂苷Rg1(Ginsenoside Rg1,G‐Rg1)是人参的主要活性成分,具有多种生物学功效,包括调节内分泌系统和神经系统、增加机体免疫功能、调节血糖、抗肿瘤、抗氧化等多方面作用,其中包括对神经组织的再生与营养改善作用和保护作用[3‐4]。本研究利用链脲佐菌素(streptozotocin,STZ)诱发大鼠Ⅱ型糖尿病及其周围神经病变模型,观察G‐Rg1对DPN结构和功能的改善作用;同时,检测血清和组织中的氧化应激和炎症因子水平,检测氧化应激信号通路中核因子E2相关因子(nuclear fac-tor erythroid‐2‐related factor 2,Nrf2)及其下游基因血红素加氧酶‐1(heme oxygenase‐1,HO‐1)以及炎症信号通路中NF‐κB的表达变化,探索G‐Rg1对糖尿病大鼠坐骨神经损伤的保护作用及其机制,为G‐Rg1的进一步研发提供可靠的基础实验依据。
1 材料与方法
1.1 材料
1.1.1 主要试剂G‐Rg1购自韩国岭南药业公司,纯度高于98%;STZ购自美国Sigma公司;盐酸二甲双胍片(0.85 g/片)购自中美上海施贵宝制药有限公司;兔抗大鼠Nrf2、HO‐1、NF‐κB抗体、BCA蛋白浓度测定试剂盒购自美国Cell Signaling Technology;TNF‐α(货号F16960)和IL‐6(货号F15870)检测试剂盒购自上海西唐生物科技有限公司;TNF‐α、IL‐6和GAPDH引物由上海生工生物技术公司合成;TRIzol总RNA提取试剂盒、qPCR试剂盒购自美国Invitro-gen;HiFiScript cDNA合成试剂盒购自康为世纪生物科技有限公司;ROS测定试剂盒、MDA测定试剂盒购自南京建成科技有限公司。
1.1.2 仪器MDABL‐420E+生物机能实验系统(成都泰盟科技有限公司);瑞典LKB‐2088型超薄切片机(瑞典LKB公司);EM‐1200EX型透射电子显微镜(日本JEOLJ公司);电泳设备以及图像分析系统(美国Bio‐Rad公司);Q5实时荧光定量PCR仪(美国ABI公司)。
1.1.3 实验动物雄性健康SD大鼠体重为180~200 g,由齐齐哈尔医学院实验动物中心提供和饲养。在温度20~25℃、湿度30%~35%自动空气清洁设备条件下饲养,自由摄食。
1.2 方法
1.2.1 动物模型的建立、分组和给药取雄性健康SD大鼠80只,适应性喂养1周后,随机选取10只为正常对照组,给予标准饲料喂养;其余大鼠高糖高脂喂养4周后,禁食8 h,以0.1 mmol/L柠檬酸钠缓冲液(pH4.2)将STZ配成1%的溶液,40 mg/kg腹腔注射大鼠,正常对照组大鼠注射等量柠檬酸钠缓冲液。注射药物72 h和2周后,血糖测试仪取尾静脉血测空腹血糖,2次检测均大于11.1 mmol/L作为糖尿病大鼠模型[5]。糖尿病大鼠随机分为模型组、G‐Rg1小剂量组、G‐Rg1大剂量组和二甲双胍(Metformin)阳性对照组,10只/组。分组后立即开始给药,G‐Rg1小剂量组和大剂量组分别每日灌胃1次剂量分别为10 mg/kg和30 mg/kg的G‐Rg1,二甲双胍阳性对照组每日灌胃1次100 mg/kg的二甲双胍,连续给药8周[6]。正常对照组和模型组灌胃等量无菌蒸馏水。
1.2.2 坐骨神经传导速度的检测[7]末次给药1 h后,腹腔注射10%水合氯醛麻醉大鼠,俯卧位固定,沿坐骨神经走行切开皮肤,暴露坐骨神经,利用BL‐420E+生物机能实验系统记录近、远端坐骨神经产生动作电位的潜伏期,测定两记录电极间的距离,按公式计算坐骨神经传导速度。运动神经传导速度(motor nerve conduction velocity,MNCV)=记录电极间距离/动作电位潜伏期差值;感觉神经传导速度(sensory nerve conduction velocity,SNCV)测定时将刺激电极置于同侧足背,记录电极置于近端坐骨切迹处的电位。SNCV=刺激电极与记录电极间距离/潜伏期。重复刺激3次后取平均值。测定坐骨神经运动传导速度后,取大鼠右侧部分坐骨神经标本,立即冷冻备用于电镜观察。
1.2.3 电子显微镜观察坐骨神经形态学变化取坐骨神经,经戊二醛、饿酸双重固定以及系列丙酮脱水,EPON812和815混合树脂包埋后,进行半薄切片,经醋酸铀‐柠檬酸铅双重染色后,透射电子显微镜观察坐骨神经有髓神经及无髓神经纤维的超微结构变化。
1.2.4 测定空腹血糖(fasting blood glucose,FBG)及血清中炎症因子TNF‐α和ⅠL‐6水平末次给药后1 h,取尾静脉血用血糖测试仪检测各组大鼠FBG。实验结束后,收集大鼠全血,离心后取血清,ELISA法测定各组大鼠血清中炎症因子TNF‐α和IL‐6水平,实验严格按照试剂盒说明书操作。
1.2.5 坐骨神经组织中MDA和ROS的含量测定取左侧坐骨神经组织后用0.9%生理盐水制备匀浆,离心后取上清液,按照试剂盒说明测定各组坐骨神经MDA和ROS含量。
1.2.6 qPCR法 检 测 坐 骨 神 经TNF‐α和ⅠL‐6 mRNA表达处死实验动物后,提取坐骨神经总RNA,按照试剂盒说明书逆转录合成cDNA,实时定量PCR仪扩增。各引物序列如下:TNF‐α,F:5′‐AGGGAATTGTGGCTCTGGT‐3′,R:5′‐AGGCCACT‐ACTTCAGCGTCT‐3′,扩增片段为190 bp;IL‐6,F:5′‐ATTCTGTCTCGAGCCCACCA‐3′,R:5′‐AGGCA‐ACTGGCTGGAAGTCT‐3′,扩增片段为133 bp;GAP-DH,F:5′‐GACAAGATGGTGAACTGTCGGT‐3′,R:5′‐CTTTGGCATCGTGGAAGGGCTC‐3′,扩增片段为108 bp。扩增条件为95℃预变性2 min,95℃变性30 s,58℃退火30 s、72℃延伸30 s,共进行38个循环。利用qPCR数据分析系统软件,以相对定量值进行统计分析。
1.2.7 Western blot检测蛋白水平取坐骨神经组织匀浆上清液,按照蛋白浓度检测试剂盒说明进行蛋白质定量。用已获得的各组蛋白质按照常规操作方法进行电泳、转膜,分别加入特异性Ⅰ抗4℃反应24 h,再加入Ⅱ抗孵育1 h后,ECL显色。利用图像分析系统扫描,以β‐actin为对照。
1.3 统计学处理采用Grappad prism 5.0统计软件进行分析。数据均采用±s表示,多组间比较采用单因素方差分析(One‐Way ANOVA),组间两两比较采用Newman-Keuls法,P<0.05表示差异有统计学意义。
2 结果
2.1 G‐Rg1对糖尿病大鼠空腹血糖及坐骨神经MNCV和SNCV的改善作用由表1可知,模型组大鼠FBG显著高于正常对照组,而G‐Rg1大剂量组FBG与模型组相比明显降低(P<0.05),G‐Rg1小剂量组大鼠FBG与模型组相比差异无统计学意义(P>0.05);G‐Rg1大剂量组大鼠FBG与G‐Rg1小剂量组差异有统计学意义(P<0.05)。模型组大鼠坐骨神经MNCV和SNCV与正常对照组相比明显减慢(P<0.05);G‐Rg1连续给药8周后,G‐Rg1小剂量组和大剂量组大鼠坐骨神经MNCV和SNCV均有改善(P<0.05),同时,G‐Rg1大剂量组大鼠坐骨神经MNCV和SNCV高于G‐Rg1小剂量组(P<0.05),表现出剂量依赖性。
2.2 G‐Rg1保护糖尿病大鼠坐骨神经超微结构变化图1显示,透射电镜观察坐骨神经超微结构变化如下:正常对照组大鼠坐骨神经有髓神经纤维和无髓神经纤维结构完整,髓鞘质膜电子密度均匀,呈同心圆状排列整齐,层次明显,线粒体结构完整,可见微管和微丝分布均匀。模型组大鼠坐骨神经有髓神经纤维明显变性,多处可见空泡状变性,神经纤维多处有质膜分离形成裂隙或扭曲,电子密度不均匀,轴索肿胀或变形;无髓神经纤维的线粒体破坏,微管和微丝结构不均匀;G‐Rg1小剂量组大鼠坐骨神经有髓神经纤维和无髓神经纤维髓鞘结构有轻微髓鞘脱离,质膜层次明显,电子密度比较均匀;G‐Rg1大剂量组大鼠坐骨神经有髓神经纤维和无髓神经纤维髓鞘结构完整,无板层分离现象,未见空泡变性,线粒体无肿胀,嵴未见断裂,微管、微丝分布均匀,电子密度一致。
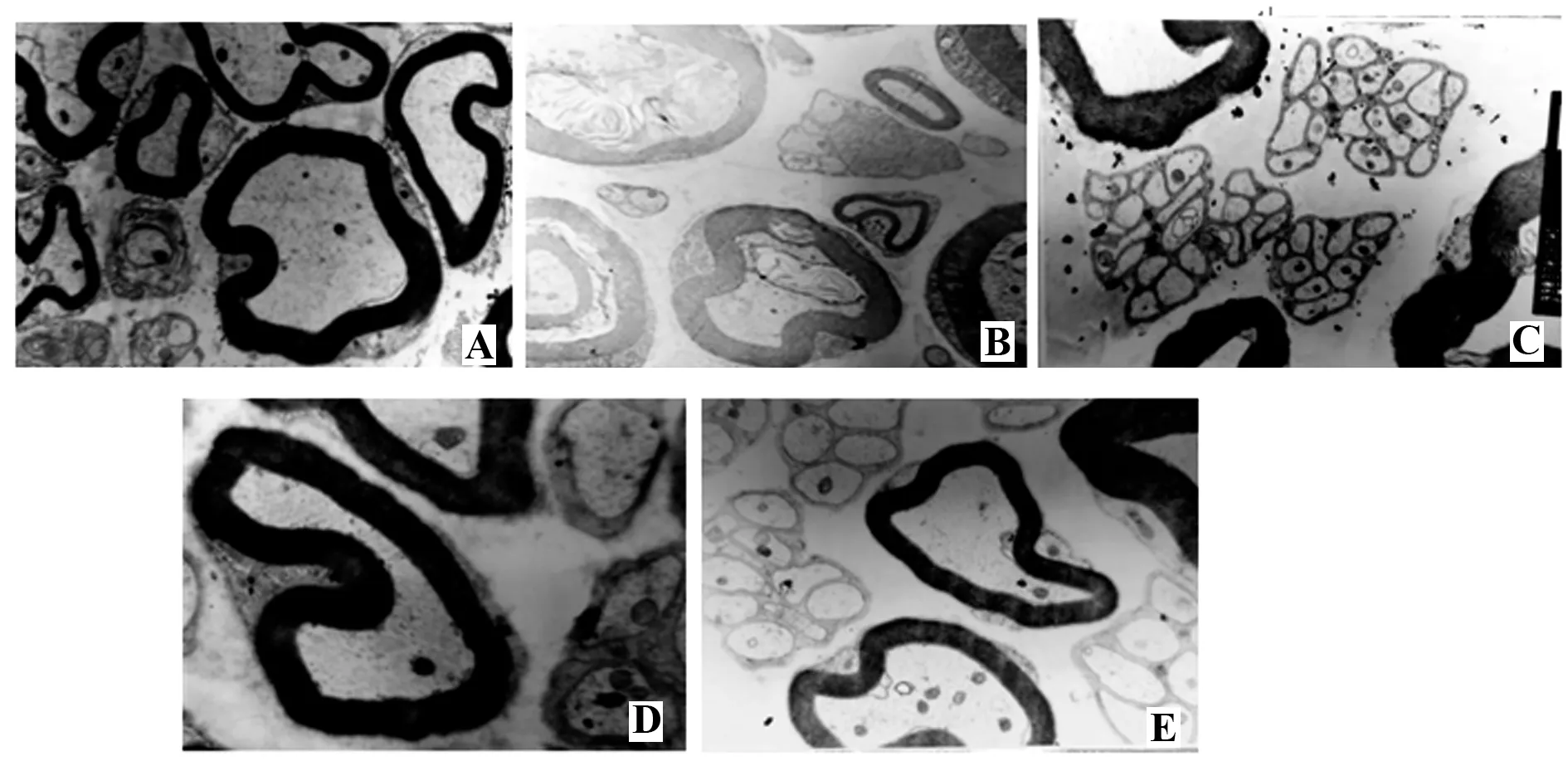
图1 G‐Rg1改善糖尿病大鼠坐骨神经超微结构变化(电镜,×4 000)Fig.1 Improvement of ultrastructural changes in sciatic nerve by G‐Rg1(electron microscopy,×4 000)

图2 G‐Rg1减 少 糖 尿 病 大 鼠 坐 骨 神 经TNF‐α和IL‐6 mRNA表达Fig.2 G‐Rg1 decreased TNF‐α and IL‐6 mRNA expres-sions in sciatic nerve tissues in diabetic rats
表1 G‐Rg1对糖尿病大鼠空腹血糖及坐骨神经MNCV和SNCV的改善作用(±s,n=10)Tab.1 Therapeutic effects of G‐Rg1 on fasting blood glu-cose levels,MNCV and SNCV in diabetic rats(±s,n=10)

表1 G‐Rg1对糖尿病大鼠空腹血糖及坐骨神经MNCV和SNCV的改善作用(±s,n=10)Tab.1 Therapeutic effects of G‐Rg1 on fasting blood glu-cose levels,MNCV and SNCV in diabetic rats(±s,n=10)
Note:1)P<0.05 vs Control group;2)P<0.05 vs Model group;3)P<0.05 vs Low G‐Rg1 group.
SNCV(m/s)38.89±4.22 18.58±3.651)23.97±3.292)28.65±4.582)3)24.36±3.772)Treatment Control Model Low G‐Rg1 High G‐Rg1 Metformin FBG(mmol/L)5.68±1.04 21.05±5.141)17.98±4.08 12.89±2.472)3)11.65±2.852)MNCV(m/s)40.56±4.88 25.34±3.141)30.97±5.292)38.38±6.482)3)33.48±5.092)

图3 G‐Rg1改善糖尿病大鼠Nrf2、HO‐1和NF‐κB总蛋白表达Fig.3 Improvement of the protein expressions of Nrf2,HO‐1 and NF‐κB in the sciatic nerve by G‐Rg1
表2 G‐Rg1降低糖尿病大鼠坐骨神经MDA和ROS以及血清TNF‐α和IL‐6的水平(±s,n=10)Tab.2 G‐Rg1 reduced levels of MDA and ROS of sciatic nerve tissues and concentrations of TNF‐α and IL‐6 of serumin di-abetic rats(±s,n=10)
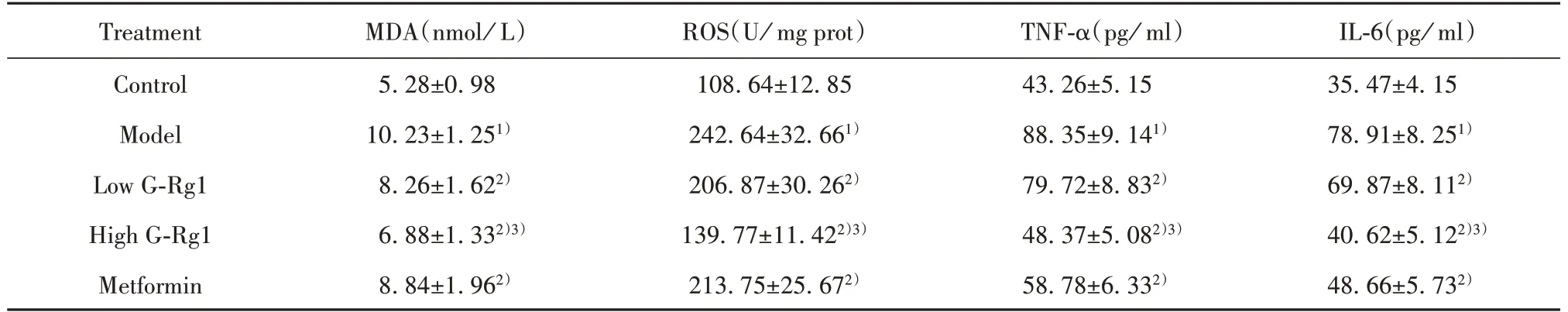
表2 G‐Rg1降低糖尿病大鼠坐骨神经MDA和ROS以及血清TNF‐α和IL‐6的水平(±s,n=10)Tab.2 G‐Rg1 reduced levels of MDA and ROS of sciatic nerve tissues and concentrations of TNF‐α and IL‐6 of serumin di-abetic rats(±s,n=10)
Note:1)P<0.05 vs Control group;2)P<0.05 vs Model group;3)P<0.05 vs Low G‐Rg1 group.
IL‐6(pg/ml)35.47±4.15 78.91±8.251)69.87±8.112)40.62±5.122)3)48.66±5.732)Treatment Control Model Low G‐Rg1 High G‐Rg1 Metformin MDA(nmol/L)5.28±0.98 10.23±1.251)8.26±1.622)6.88±1.332)3)8.84±1.962)ROS(U/mg prot)108.64±12.85 242.64±32.661)206.87±30.262)139.77±11.422)3)213.75±25.672)TNF‐α(pg/ml)43.26±5.15 88.35±9.141)79.72±8.832)48.37±5.082)3)58.78±6.332)
2.3 G‐Rg1降低糖尿病大鼠坐骨神经MDA和ROS以及血清中TNF‐α和ⅠL‐6水平由表2可知,模型组大鼠坐骨神经组织MDA和ROS水平明显高于正常对照组,差异有统计学意义(P<0.05);G‐Rg1小剂量和大剂量组大鼠坐骨神经组织中MDA和ROS水平明显受到抑制(P<0.05);G‐Rg1大剂量组MDA和ROS水平低于G‐Rg1小剂量组(P<0.05),表现出剂量依赖性。ELISA检测各组大鼠血清中TNF‐α和IL‐6的变化如下:与正常对照组相比,模型组大鼠血清中TNF‐α和IL‐6水平明显升高(P<0.05);G‐Rg1小剂量和G‐Rg1大剂量组大鼠血清中TNF‐α和IL‐6水平比模型组显著降低(P<0.05);G‐Rg1大剂量组血清中TNF‐α和IL‐6明显低于G‐Rg1小剂量组,差异有统计学意义(P<0.05),且呈剂量依赖性。
2.4 G‐Rg1减少糖尿病大鼠坐骨神经TNF‐α和ⅠL‐6 mRNA表达与正常对照组相比,模型组大鼠坐骨神经TNF‐α和IL‐6 mRNA表达明显升高,差异有统计学意义(P<0.05);G‐Rg1小剂量和G‐Rg1大剂量组大鼠坐骨神经TNF‐α和IL‐6 mRNA比模型组降低,差异有统计学意义(P<0.05,图2)。
2.5 G‐Rg1改善糖尿病大鼠坐骨神经Nrf2、HO‐1和NF‐κB总蛋白表达由图3可知,模型组Nrf2和HO‐1表达明显低于正常对照组(P<0.05);与模型组相比,G‐Rg1小剂量和G‐Rg1大 剂 量 组Nrf2和HO‐1表达增高(P<0.05);G‐Rg1大剂量组大鼠坐骨神经Nrf2和HO‐1比G‐Rg1小剂量组明显增多(P<0.05),显示出剂量依赖性。模型组NF‐κB表达明显高于正常对照组(P<0.05);与模型组相比,G‐Rg1小剂量和G‐Rg1大剂量组NF‐κB表达明显受到抑制(P<0.05)。
3 讨论
DPN是糖尿病患者常见的晚期并发症之一,发病率高,但临床上还没有疗效显著的药物。因此,目前对DPN发病机制及其治疗的研究是众多学者关注的热点问题[8‐9]。本研究利用STZ制作糖尿病大鼠模型,随着病程延长达到造模后8周时,模型组大鼠坐骨神经MNCV和SNCV明显减慢,符合DPN神经损伤的功能指标。同时利用电镜观察,可见DPN大鼠坐骨神经多处有明显的超微结构变化。这些功能与形态学的变化类似于人的DPN发病过程。
本研究发现G‐Rg1小剂量和大剂量治疗对DPN大鼠坐骨神经有明显的保护作用。已有文献报道G‐Rg1可有效降低糖尿病大鼠血糖水平,升高胰岛素和C肽,抑制体内氧化应激反应,调节糖代谢作用[10‐11]。本研究发现,G‐Rg1干预后,G‐Rg1大剂量组大鼠空腹血糖比模型组明显降低;小剂量组降血糖效果不明显,但仍然对DPN有疗效。因此认为G‐Rg1对神经组织的营养与保护作用不仅源于其降血糖作用,也源于其对神经组织的直接作用。
DPN的发生与多种机制相关,如非酶促蛋白糖基化、氧化应激、神经营养因子缺乏和炎症级联反应通路的激活等,其中氧化应激为其最重要、最普遍的机制之一。长期的高血糖诱导氧化应激状态,体内产生过多的ROS,使机体对抗氧化功能的负荷过重,最终导致体内氧化与抗氧化调节失衡,从而影响神经细胞功能,引起神经组织损伤。在此过程中,最受关注的是Nrf2和NF‐kB信号通路相关基因的表达[12‐14]。Nrf2和NF‐kB通路是体内调节氧化应激反应和炎症反应,维持细胞内环境稳态的关键途径。Nrf2是新型核转录因子,是CNC亮氨酸拉链转录激活因子家族成员,在代谢活跃的器官中高表达,是调控氧化与抗氧化系统的主要调节因子,维持氧化还原的相对平衡。其主要机制为正常情况下,Nrf2与细胞内的伴侣蛋白Kelch‐like ECH相关蛋白1(Ke-ap1)结合抑制其激活,但处于氧化应激状态时,在ROS的作用下Keap1与Nrf2分离,使Nrf2迅速进入核内,启动下游基因的转录[15]。尤其是在核内与特异性作用元件ARE结合,上调HO‐1表达,发挥细胞的自我防御功能。因为HO‐1具有较强抗氧化活性的同时也参与抗炎症因子的表达并调节各种免疫应答,抑制细胞凋亡等功能。多数研究报道,氧化应激状态下,组织中Nrf2和HO‐1表达明显受到抑制,因此提出上调Nrf2和HO‐1的表达作为DPN治疗的新靶点[16‐17]。本 研究 发现,DPN大 鼠 血清 中ROS和MDA水平升高,可以判断处于氧化应激状态,同时坐骨神经Nrf2与HO‐1表达明显降低,符合氧化与抗氧化失衡导致细胞自我保护机制破坏造成组织损伤的理论。NF‐κB是一种核转录因子,参与细胞的增殖分化及免疫应答相关的信号通路,对启动细胞内炎症因子表达起重要作用[18]。在正常生理活动时,NF‐κB与IκB在细胞质内结合形成多聚体,表现为无活性的NF‐κB。在DPN的发病过程中,高血糖导致细胞处于氧化应激状态,细胞内堆积的ROS和其他细胞因子可激活IκB激酶(IKK),使之发生磷酸化导致其与NF‐κB解离,游离的NF‐κB进入细胞核内启动炎症因子TNF‐α和IL‐6等的表达[19]。TNF‐α是炎症反应中重要的炎症介质之一,能激活各种炎症细胞增加血管内皮细胞通透性,促使其他细胞因子的合成与释放。IL‐6能诱导B细胞分化并产生抗体,促进T细胞活化增殖,参与机体免疫应答,介导并加快炎症反应进程。长期的高糖环境下,TNF‐α和IL‐6同时参与胰岛素抵抗和炎症反应会导致内皮细胞功能障碍和微血管病变引起神经损伤从而加快DPN发生。多数学者认为,破坏NF‐κB与其他各种核转录因子的相对稳定和动态平衡会导致神经组织损伤[9,14]。本研究发现,DPN大鼠坐骨神经NF‐κB表达明显增高,血清和坐骨神中的TNF‐α和IL‐6水平也增高,提示NF‐κB通路的激活诱导炎症因子表达,不管在全身还是局部组织的炎症均在DPN的病程中发挥作用,促进神经损伤。
中医学认为,DPN是因消渴日久,气阴两虚,阴阳气血亏虚,血行不畅,筋脉肌肉失养所致。二甲双胍为2型糖尿病临床治疗的常用药物,具有降糖效果和抗炎作用,且具有价格低廉、治疗效果明确等优点。但根据DPN发病机制的特点,治疗上提出以益气养阴和温阳通络为原则,利用中药药理作用多途径、多靶点、多系统的优势,开发多种中医药复方解决治疗DPN的难点[20]。人参作为药中之王,是常用的名贵中药材,具有补气固脱、宁心益智、养血生津、补脾益肺和大补元气之功效,能够调节中枢神经系统、改善心肌功能、增加机体免疫功能、调节血糖、抗肿瘤、抗氧化等。目前已经从人参中分离出40余种具有药理活性的单体成分,如人参皂苷Rg1、Rg3、Rb1、Re等。其中人参皂苷Rg1是应用最为广泛的单体成分,其对神经组织的调理和营养作用备受关注[21‐22]。因此,本实验观察到G‐Rg1大、小剂量组大鼠坐骨神经传导速度比模型组明显增高,同时电镜观察坐骨神经超微结构形态学变化明显改善,提示G‐Rg1对神经组织具有良好的营养作用,可促进周围神经组织再生,逐渐修复损伤的神经。为进一步证实G‐Rg1对坐骨神经的保护机制,本研究发现,G‐Rg1连续干预8周后,G‐Rg1治疗组大鼠坐骨神经组织和血清中MDA、ROS水平明显受到抑制,提示G‐Rg1可有效清除体内堆积的MDA和ROS,对坐骨神经组织的氧化应激有较好的改善作用,缓解氧化应激对神经的损伤,防止DPN进一步加重。同时G‐Rg1干预后,治疗组大鼠坐骨神经组织中Nrf2和HO‐1表达增多,而NF‐κB表达明显抑制而减少体内促炎因子TNF‐α和IL‐6表达。通过以上实验结果可以推测,G‐Rg1对DPN大鼠周围神经具有明显的保护作用和营养作用,主要表现在以氧化应激和炎症反应为主的DPN的发病机制中,通过氧化与抗氧化、炎症因子表达通路中Nrf2、HO‐1及NF‐κB的相互调节,能够发挥维持细胞内环境稳态,改善氧化应激状态,减少细胞炎症从而保护神经的作用。团队后期实验将进一步明确G‐Rg1的药理作用及其相关的信号通路,为DPN治疗药物的开发提供更加可靠而准确的基础实验依据。