龙胆苦苷下调LINC00520对肺癌细胞A549增殖和迁移的影响
2021-05-26薛晴苏州第九人民医院内科苏州215200
薛晴 (苏州第九人民医院内科,苏州 215200)
肺癌是一种恶性肿瘤,具有较高的发病率和死亡率。尽管在最近几十年中肺癌的诊断和治疗取得了进步,但是患者的5年总生存率并未显著提高[1]。约80%的肺癌患者被诊断出处于晚期,预后较差[2]。癌症细胞迁移影响肺癌的发展、转移和复发,实验证明选择抑制癌细胞生长和转移作为肺癌的临床治疗方案[3]。因此,需要进一步研究肺癌转移的潜在分子机制,以确定新的治疗方案。既往研究显示,龙胆根的甲醇提取物以剂量依赖性方式抑制肺癌细胞系HOP‐62和急性单核细胞白血病细胞系THP‐1癌细胞的生长,具有抗增殖特性[4]。龙胆苦苷是中药龙胆主要的活性成分,能够抑制肝癌HepG2和SMMC‐7721细胞的增殖,还对上皮性卵巢癌HO8910细胞表现出抗增殖、抗迁移和促凋亡作用[5‐7]。非编码RNA(long noncoding RNA,lncRNA)LINC00520位于人类染色体14q22.3,长度约为20 kb,是多种人类癌症致癌性的重要调节剂[8]。资料表明,LINC00520在喉鳞状细胞癌组织、神经胶质瘤细胞中过表达,并且LINC00520可抑制神经胶质瘤细胞的增殖、迁移和侵袭,但促进细胞凋亡[9‐10]。JIN等[11]在结直肠癌组织和细胞系中检测到了高表达的LINC00520,并且这种高表达与患者不良的临床病理参数以及较短的总生存期和无病生存期有关。在功能上,LINC00520的干扰导致结直肠癌细胞增殖、迁移、集落形成和侵袭的能力显著降低。然而尚未报道龙胆苦苷和LINC00520在肺癌中的确切作用。因此,本研究针对龙胆苦苷和LINC00520在肺癌细胞A549增殖、迁移中的功能进行考察,并进一步探索LINC00520是否参与龙胆苦苷介导的肺癌细胞增殖、迁移过程。
1 材料与方法
1.1 材料龙胆苦苷(含量97.1%)购自中国食品药品检定研究院,细胞A549购自美国典型培养物保藏中心,Dulbecco改良的Eagle培养基(DMEM)购自美国Gibco,LINC00520 siRNA si‐LINC00520、阴性对 照si‐NC、LINC00520过 表 达 质 粒pcDNA‐LINC00520、pcDNA购 自 上 海 吉 玛 公 司,Lipo-fectamine2000试剂购自美国Invitrogen公司,聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜购自美国Bio‐Rad公司,兔抗E‐钙黏蛋白(E‐cadherin)、兔抗N‐钙黏蛋白(N‐cadherin)、兔抗甘油醛‐3‐磷酸脱氢酶(glyceraldehyde‐3‐phosphate dehydrogenase,GAP-DH)抗体购自英国Abcam公司,标记羊抗兔IgG/HRP二抗购自北京博奥森公司。
1.2 方法
1.2.1 细胞培养与实验分组A549细胞在10%胎牛血清的DMEM中培养,并将细胞维持在37℃和5%CO2条件下。处于对数生长期的A549细胞被分为以下几组:对照组(正常培养)、龙胆苦苷低、中、高剂量组(10、20、40 µmol/L龙胆苦苷)、si‐NC组(转染si‐NC)、si‐LINC00520组(转染si‐LINC00520)、龙胆苦苷高剂量+pcDNA组(转染pcDNA+40µmol/L龙胆苦苷)、龙胆苦苷高剂量+pcDNA‐LINC00520组(转染pcDNA‐LINC00520+40 µmol/L龙胆苦苷)[7]。龙胆苦苷的给药时间均为48 h。通过使用Lipo-fectamine2000试剂将si‐LINC00520,si‐NC,pcDNA‐LINC00520和pcDNA转染到A549细胞中。首先,将A549细胞接种于6孔板(1×105个/孔)中培养24 h。当细胞密度达到70%时,按照Lipofectamine2000的指示,将si‐LINC00520,si‐NC,pcDNA‐LINC00520和pcDNA转染A549细胞6 h,转染的A549细胞在含10%胎牛血清的新培养基中再放置24 h。之后,用40µmol/L龙胆苦苷处理转染pcDNA‐LINC00520和pcDNA的A549细胞48 h。转染效率的验证采用qRT‐PCR进行。
1.2.2 qRT‐PCR测定LⅠNC00520表达按照制造商指定步骤使用TRIzol试剂从A549细胞中提取RNA。逆转录后使用ABI StepOnePlus系统进行扩增 反 应。引 物 如 下:LINC00520正 向5'‐CCT-GCTCCTTCAGGGACATC‐3'和LINC00520反 向5'‐TCCGCCCCTTGCTCAAATAG‐3';GAPDH正 向5'‐GTCAACGGATTTGGTCTGTATT‐3'和GAPDH反 向5'‐AGTCTTCTGGGTGGCAGTGAT‐3'。GAPDH为内参,用2‐ΔΔCt法计算LINC00520相对表达水平。
1.2.3 MTT法检测细胞活性接种于A549细胞(1×104个/孔)96孔板中以1.2.1中分组处理于37℃孵育48 h。将20µl的MTT(5 mg/ml)溶液添加到孔中,再孵育4 h。随后,将100µl二甲基亚砜添加至孔中以溶解甲瓒晶体,并使用酶标仪在490 nm的波长处测量光密度OD值。
1.2.4 克隆形成实验测定细胞克隆形成A549接种在6孔板(50个/孔)中24 h,然后以1.2.1中分组处理。2周后,A549细胞用3∶1甲醇‐乙酸固定,并在室温下用0.1%结晶紫染色10 min。染色板干燥后通过显微镜计数。
1.2.5 Transwell实验评估细胞迁移将1.2.1处理的A549细胞悬浮于500 µl无血清DMEM培养基。将A549细胞(1×105个)移到Transwell(孔径为8µm)的上腔室中,并在Transwell下腔室补充500µl含血清DMEM培养基。37℃下孵育48 h,随后用4%多聚甲醛固定5 min,并在37℃下用0.1%结晶紫染色30 min。使用Olympus倒置显微镜(放大倍数×200)在至少5个随机选择的视野中对迁移的A549细胞进行计数。
1.2.6 Western blot分 析E‐cadherin和N‐cadherin表达使用含有蛋白酶抑制剂的放射免疫沉淀分析RIPA裂解缓冲液从A549细胞中提取总蛋白。通过BCA蛋白质测定法确定蛋白浓度。在10%十二烷基硫酸钠‐聚丙烯酰胺凝胶电泳上80 V分离等量蛋白。然后将分离的蛋白在350 mA下转移至PVDF膜2 h。将膜在室温下用5%封闭液处理1 h,与一抗在4℃孵育过夜:兔抗E‐cadherin(1∶1 000),兔 抗N‐cadherin(1∶1 000)和 兔 抗GAPDH(1∶2 000)。用Tris‐HCl‐Tween缓冲盐溶液洗膜以去除未结合的抗体。添加二抗(标记羊抗兔IgG/HRP抗体),并在室温下孵育1 h。使用ECL显示蛋白信号,并使用Image J软件扫描蛋白条带的强度。以GAP-DH为参照,分析E‐cadherin和N‐cadherin相对蛋白表达。
1.3 统计学分析数据采用SPSS22.0软件进行统计分析,计量资料表示为±s。采用单因素方差分析进行多组间差异比较,SNK-q检验进行组间多重比较,t检验进行两组间差异比较,P<0.05为差异有统计学意义。
2 结果
2.1 龙胆苦苷对A549细胞活性和克隆形成的影响如图1、表1所示,与对照组相比,龙胆苦苷低剂量组A549细胞的活性、克隆形成数差异无统计学意义(P>0.05);与对照组或龙胆苦苷低剂量组相比,龙胆苦苷中、高剂量组A549细胞的活性、克隆形成数降低,差异有统计学意义(P<0.05);与龙胆苦苷中剂量组相比,龙胆苦苷高剂量组A549细胞的活性、克隆形成数降低,差异有统计学意义(P<0.05)。
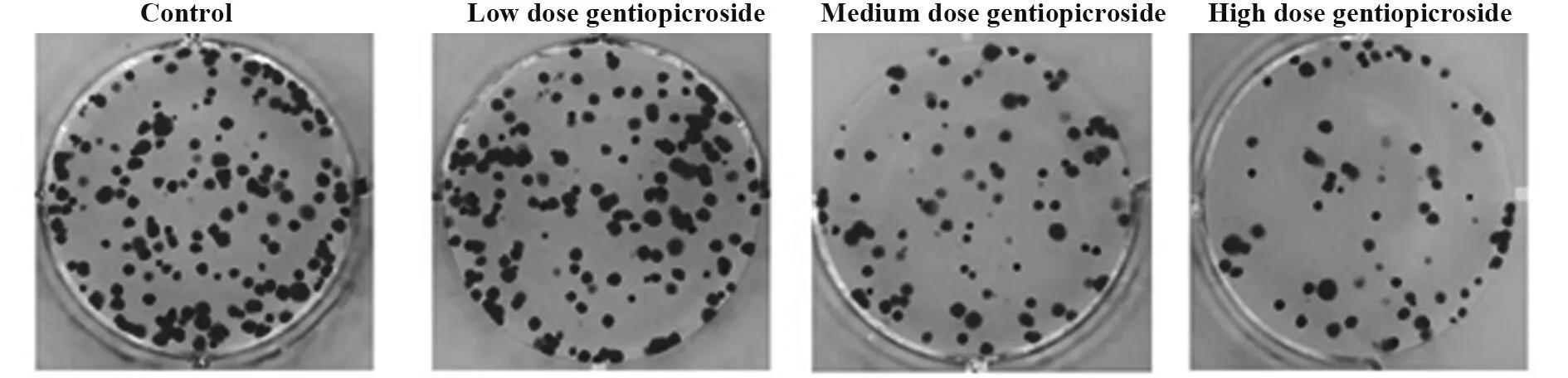
图1 龙胆苦苷对A549克隆形成的检测Fig.1 Detection of A549 clone formation by gentiopicro-side
2.2 龙胆苦苷对A549迁移及LⅠNC00520表达的影响如表2、图2所示,与对照组相比,龙胆苦苷低剂量组A549细胞的LINC00520表达量、迁移细胞数、E‐cadherin蛋白和N‐cadherin蛋白表达水平差异无统计学意义(P>0.05);与对照组或龙胆苦苷低剂量组相比,龙胆苦苷中、高剂量组A549细胞的LINC00520表达量减少,迁移细胞数减少,E‐cad-herin蛋白水平升高,N‐cadherin蛋白水平降低,差异有统计学意义(P<0.05);与龙胆苦苷中剂量组相比,龙胆苦苷高剂量组A549细胞的LINC00520表达量减少,迁移细胞数减少,E‐cadherin蛋白水平升高,N‐cadherin蛋白水平降低,差异有统计学意义(P<0.05)。
2.3 干扰LⅠNC00520对A549细胞活性和克隆形成的影响如表3、图3所示,si‐LINC00520组A549细胞活性和克隆形成数低于si‐NC组,差异有统计学意义(P<0.05)。
表1 A549细胞活性和克隆形成的检测(±s,n=3)Tab.1 Detection of A549 cell viability and clone forma-tion(±s,n=3)
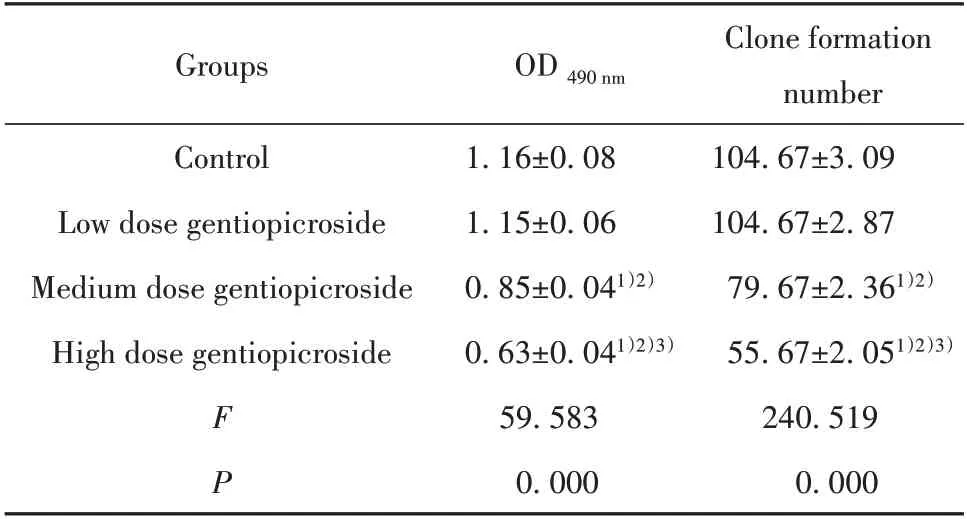
表1 A549细胞活性和克隆形成的检测(±s,n=3)Tab.1 Detection of A549 cell viability and clone forma-tion(±s,n=3)
Note:Compared with the control group,1)P<0.05;Compared with the low dose gentiopicroside group,2)P<0.05;Compared with the me-dium dose gentiopicroside group,3)P<0.05.
Clone formation number 104.67±3.09 104.67±2.87 79.67±2.361)2)55.67±2.051)2)3)240.519 0.000 Groups OD 490 nm Control Low dose gentiopicroside Medium dose gentiopicroside High dose gentiopicroside F P 1.16±0.08 1.15±0.06 0.85±0.041)2)0.63±0.041)2)3)59.583 0.000
表2 A549迁移细胞数及LINC00520表达的检测(±s,n=3)Tab.2 Detection of A549 migration cell number and LINC00520 expression(±s,n=3)
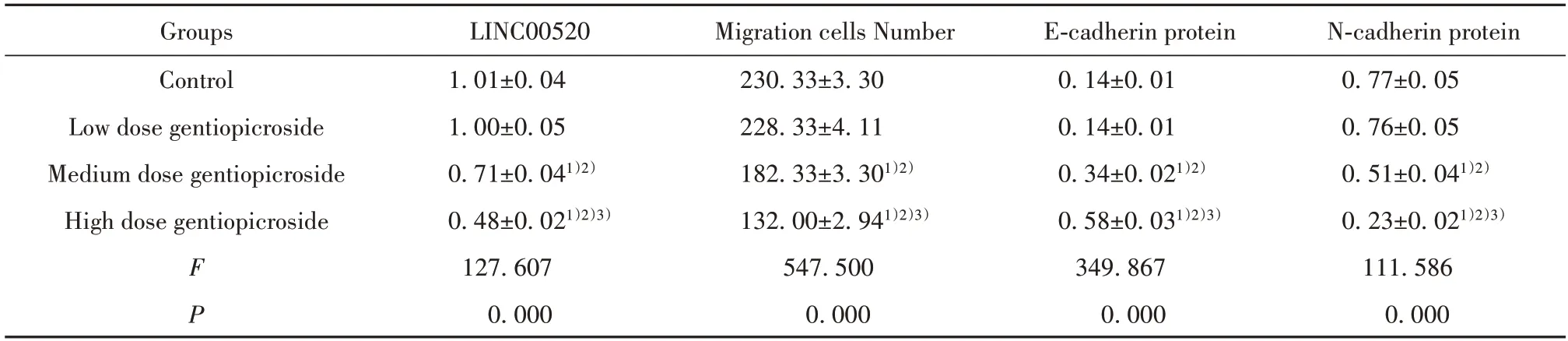
表2 A549迁移细胞数及LINC00520表达的检测(±s,n=3)Tab.2 Detection of A549 migration cell number and LINC00520 expression(±s,n=3)
Note:Compared with the control group,1)P<0.05;compared with the low dose gentiopicroside group,2)P<0.05;compared with the medium dose gen-tiopicroside group,3)P<0.05.
N‐cadherin protein 0.77±0.05 0.76±0.05 0.51±0.041)2)0.23±0.021)2)3)111.586 0.000 Groups Control Low dose gentiopicroside Medium dose gentiopicroside High dose gentiopicroside F P LINC00520 1.01±0.04 1.00±0.05 0.71±0.041)2)0.48±0.021)2)3)127.607 0.000 Migration cells Number 230.33±3.30 228.33±4.11 182.33±3.301)2)132.00±2.941)2)3)547.500 0.000 E‐cadherin protein 0.14±0.01 0.14±0.01 0.34±0.021)2)0.58±0.031)2)3)349.867 0.000
2.4 干扰LⅠNC00520对A549迁移的影响如表4、图4所示,干扰LINC00520后,si‐LINC00520组A549细胞的LINC00520的表达量为0.29±0.02,远远低于si‐NC组的0.99±0.05。并且,与si‐NC组相比si‐LINC00520组减少迁移细胞数,提高E‐cadherin蛋白水平,并且降低N‐cadherin蛋白水平,差异有统计学意义(P<0.05)。
2.5 过表达LⅠNC00520对龙胆苦苷处理的A549细胞活性和克隆形成的影响如表5、图5所示,龙胆苦苷高剂量+pcDNA‐LINC00520组A549细胞活性和克隆形成数均高于龙胆苦苷高剂量+pcDNA组,差异有统计学意义(P<0.05)。
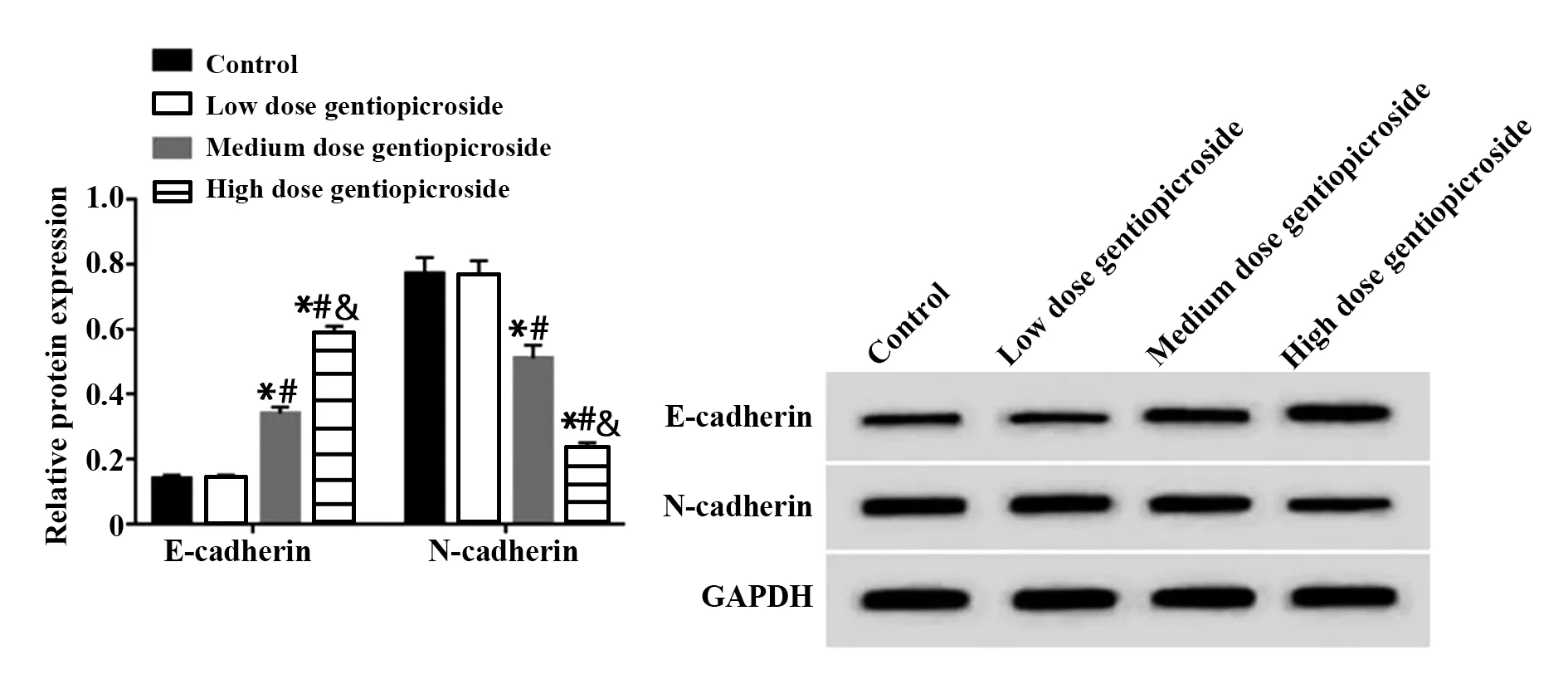
图2 龙胆苦苷对A549中E‐cadherin、N‐cadherin蛋白表达的影响Fig.2 Effect of gentiopicroside on the expression of E‐cad-herin and N‐cadherin in A549
表3 干扰LINC00520表达的A549细胞活性和克隆形成的检测(±s,n=3)Tab.3 Activity and clonal formation of A549 cells inter-fering with LINC00520 expression(±s,n=3)

表3 干扰LINC00520表达的A549细胞活性和克隆形成的检测(±s,n=3)Tab.3 Activity and clonal formation of A549 cells inter-fering with LINC00520 expression(±s,n=3)
Note:Compared with the si‐NC group,1)P<0.05.
Clone formation number 104.67±3.30 47.67±1.701)26.596 0.000 Groups si‐NC si‐LINC00520 t P OD 490 nm 1.16±0.08 0.50±0.031)13.380 0.000
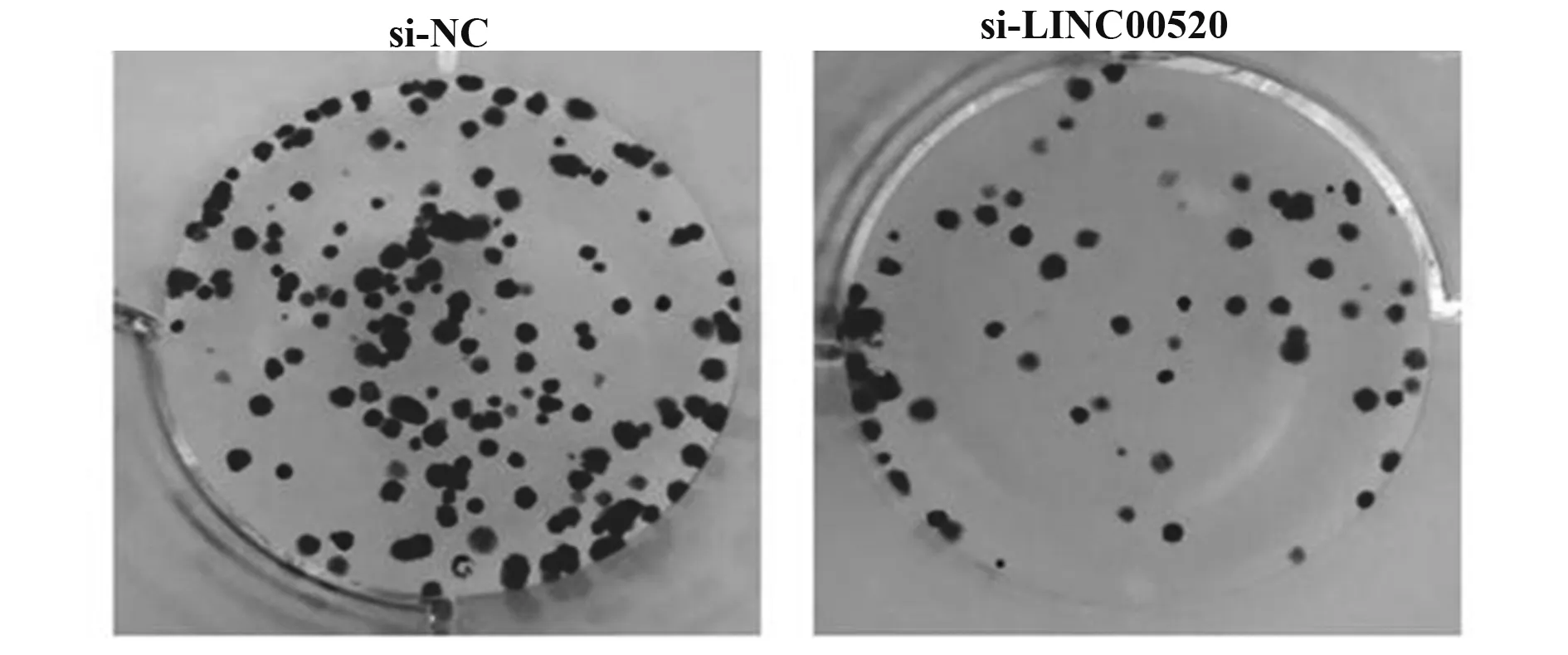
图3 干扰LINC00520对A549克隆形成的检测Fig.3 Detection of A549 clone formation by interference with LINC00520
2.6 过表达LⅠNC00520对龙胆苦苷处理的A549迁移的影响如表6、图6所示,龙胆苦苷高剂量+pcDNA‐LINC00520组A549细胞的LINC00520的表达量、迁移细胞数高于龙胆苦苷高剂量+pcDNA组,E‐cadherin蛋白水平低于龙胆苦苷高剂量+pcDNA组,以及N‐cadherin蛋白水平高于龙胆苦苷高剂量+pcDNA组,差异有统计学意义(P<0.05)。
表4 干扰LINC00520表达的A549迁移细胞数的检测(±s,n=3)Tab.4 Detection of A549 migration cells interfering with LINC00520 expression(±s,n=3)

表4 干扰LINC00520表达的A549迁移细胞数的检测(±s,n=3)Tab.4 Detection of A549 migration cells interfering with LINC00520 expression(±s,n=3)
Note:Compared with the si‐NC group,1)P<0.05.
N‐cadherin protein 0.78±0.05 0.13±0.011)22.079 0.000 Groups LINC00520 si‐NC si‐LINC00520 t P 0.99±0.05 0.29±0.021)22.514 0.000 Migration cells Number 230.67±3.30 112.00±2.451)50.010 0.000 E‐cadherin protein 0.13±0.01 0.67±0.041)22.685 0.000
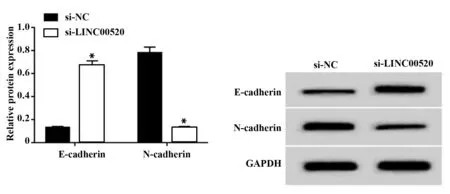
图4 干扰LINC00520对A549中E‐cadherin、N‐cadherin蛋白表达的影响Fig.4 Effect of LINC00520 interference on the expression of E‐cadherin and N‐cadherin in A549
表5 过表达LINC00520对龙胆苦苷处理的A549细胞活性和克隆形成的检测(±s,n=3)Tab.5 Detection of cell viability and clone formation of gentiopicroside treated A549 cells by overexpres-sion of LINC00520(±s,n=3)

表5 过表达LINC00520对龙胆苦苷处理的A549细胞活性和克隆形成的检测(±s,n=3)Tab.5 Detection of cell viability and clone formation of gentiopicroside treated A549 cells by overexpres-sion of LINC00520(±s,n=3)
Note:Compared with the high dose gentiopicroside+pcDNA group,1)P<0.05.
Groups OD 490 nm High dose gentiopicroside+pcDNA High dose gentiopicroside+pcDNA‐LINC00520 0.63±0.03 Clone forma-tion number 56.00±2.16 1.07±0.051)92.67±2.871)17.682 0.000 t P 13.070 0.000
表6 过表达LINC00520对龙胆苦苷处理的A549迁移细胞数的检测(±s,n=3)Tab.6 Number of A549 migration cells treated with gentiopicroside by overexpression of LINC00520(±s,n=3)

表6 过表达LINC00520对龙胆苦苷处理的A549迁移细胞数的检测(±s,n=3)Tab.6 Number of A549 migration cells treated with gentiopicroside by overexpression of LINC00520(±s,n=3)
Note:Compared with the high dose gentiopicroside+pcDNA group,1)P<0.05.
Groups High dose gentiopicroside+pcDNA High dose gentiopicroside+pcDNA‐LINC00520 LINC00520 Migration cells number E‐cadherin protein N‐cadherin protein 0.48±0.03 130.67±2.87 0.58±0.03 0.23±0.02 0.86±0.051)217.67±3.681)0.23±0.021)0.62±0.041)15.105 0.000 t P 11.288 0.000 31.865 0.000 16.813 0.000

图5 过表达LINC00520对龙胆苦苷处理的A549克隆形成的检测Fig.5 Detection of gentiopicroside treated A549 clone by overexpression of LINC00520
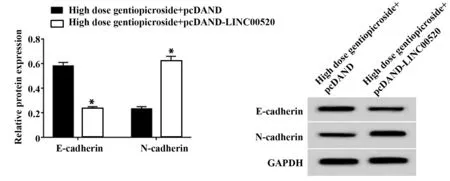
图6 过表达LINC00520对龙胆苦苷处理的A549中E‐cad-herin、N‐cadherin蛋白表达的影响Fig.6 Effect of overexpression of LINC00520 on expres-sion of E‐cadherin and N‐cadherin in gentiopicro-side treated A549
3 讨论
肺癌是致命的癌症之一,急需开发出新颖的治疗策略,以降低其发病率和死亡率。长期以来,植物来源的天然产物一直被认为是抗癌剂的来源[12‐13]。龙胆苦苷是一种重要的植物次生代谢产物,作为一种环烯醚萜苷类成分,它对癌症的治疗效果更好,毒性更低[14]。研究表明,龙胆苦苷通过剂量和时间依赖性来抑制细胞生长,诱导凋亡,并也通过抑制周期和抑制迁移对宫颈癌HeLa细胞表现出治疗作用,而对正常细胞系HUVEC的抑制作用较小[12]。LI等[15]观察到龙胆苦苷对SKOV3卵巢癌细胞显示出显著的抗癌活性,这归因于其诱导线粒体凋亡,细胞周期停滞以及抑制细胞迁移和侵袭。本研究对龙胆苦苷的抗肺癌作用进行评价,发现10 µmol/L龙胆苦苷对肺癌A549细胞增殖和迁移能力无明显影响,而20 µmol/L、40 µmol/L龙胆苦苷能够显著减弱肺癌A549细胞的活性、克隆形成数、迁移细胞数、N‐cadherin蛋白表达,增强E‐cad-herin蛋白表达,且40µmol/L龙胆苦苷作用效果更显著,这说明龙胆苦苷具有一定的抗肺癌能力。与前人研究[相吻合,为龙胆苦苷成为潜在的肿瘤抑制剂提供了新的证据[4,15]。
LINC00520是一种高度保守的lncRNA,在各种组织中广泛表达。资料显示,LINC00520在多种肿瘤中起作用,可能成为癌症治疗的有效靶标[16]。LINC00520高表达已在甲状腺乳头状癌组织和细胞系中得到验证,LINC00520干扰使甲状腺乳头状癌细胞增殖,迁移和体外侵袭显著减少,并导致细胞凋亡增加[17]。LINC00520被发现在黑色素瘤组织中过表达,其高表达是黑色素瘤患者预后的危险因素。LINC00520促进黑素瘤细胞的增殖,侵袭和迁移,发挥其致癌作用[18]。在头颈部鳞状细胞癌细胞和组织中,LINC00520被上调,沉默LINC00520可以促进放射敏感性,并抑制头颈部鳞状细胞癌中的细胞增殖,迁移[19]。由此可见,LINC00520是癌症中的致癌因子。但是,到目前为止,尚未研究LINC00520在肺癌中的作用。在这项研究中,干扰LINC00520还被证明可以显著抑制肺癌A549细胞的活性、克隆形成、迁移、N‐cadherin蛋白表达,促进E‐cadherin蛋白表达,显示出抑制肺癌效果。
研究表明,一些天然成分对肿瘤细胞的毒性作用过程和机制涉及lncRNA[20]。例如,盐酸青藤碱通过抑制卵巢癌细胞中lncRNA HOST2表达发挥抗肿瘤作用,小檗碱诱导的结直肠癌细胞活力抑制和细胞凋亡激活是通过上调lncRNA CASC2实现的[21‐22]。但是,肺癌细胞中LINC00520与龙胆苦苷之间的特定功能关联尚未可知。本实验通过qRT‐PCR分析,发现A549细胞 中LINC00520表 达 被20 µmol/L、40 µmol/L龙胆苦苷所抑制,提示LINC00520可能是龙胆苦苷抗肺癌细胞增殖和迁移的重要调节剂。此外,功能获得测定结果显示,过表达LINC00520后,龙胆苦苷抑制A549细胞活性、克隆形成数、迁移细胞数、N‐cadherin蛋白表达的作用,和其促进E‐cadherin蛋白表达的作用被逆转,说明龙胆苦苷通过下调LINC00520表达来发挥其抗肺癌作用。
总之,当前的研究表明,20 µmol/L、40 µmol/L龙胆苦苷可降低肺癌A549细胞的增殖和迁移能力。此外,机理研究表明,龙胆苦苷下调LINC00520的表达水平发挥其在肺癌中的抑制功能。因此,龙胆苦苷可能是肺癌患者的潜在治疗药物,靶向LINC00520可能作为龙胆苦苷抗肺癌作用的重要治疗靶点。