桦褐孔菌多糖通过NLRP3/NF‐κB信号通路对结肠炎相关结直肠癌小鼠的影响①
2021-05-26李佳威曲超陈一方郑金娟肖瑶黄学洙金丹李芳芳
李佳威 曲超陈一方 郑金娟 肖瑶 黄学洙 金丹 李芳芳
(延边大学医学院免疫学与病原生物学教研室,延吉 133002)
结直肠癌(colorectal cancer,CRC)是全世界范围内癌症死亡的关键原因之一[1]。由于饮食习惯的改变、经济发展的进步及生活质量的提高,CRC的发病率逐年上升。结肠炎相关结直肠癌(colitis‐as-sociated colorectal cancer,CAC)通常在患有长期肠道炎症的患者如炎症性肠病(inflammatory bowel dis-ease,IBD)患者中发展,且其肿瘤可能在体内其他部位形成。CAC是IBD的主要并发症,其发病率和死亡率呈逐年递增趋势[2]。目前关于慢性炎症性疾病和癌症之间的关联(包括有关IBD演变为CAC的各种理论)尚不明确。
桦褐孔菌(Inonotus obliquus)是一种名贵的药用真菌,具有多种活性物质,包括桦褐孔菌多糖、桦褐孔菌醇、超氧化物歧化酵素、氧化三萜类以及桦褐孔菌素和叶酸衍生物等多种化合物[3‐5]。其中以桦褐孔菌中多糖(Inonotus obliquuspolysaccharide,IOP)的研究最为深入。据报道,IOP在多种癌症中发挥抗肿瘤作用,且具有多层次、多靶点等作用[6‐8]。还有研究表明,IOP可通过NF‐κB或NLRP3信号通路预防肿瘤的发生发展,如肝癌,黑色素瘤等,但对于CRC的研究较为少见[9‐10]。课题组前期实验表明,IOP对DSS诱导的小鼠结肠炎具有抑制作用,但对于CAC的作用尚不明确[11]。基于以上研究,课题组提 出IOP通过 影响NF‐κB和NLRP3通 路 干 预CAC的发生发展的可能性。因此,本研究通过SW620细胞株及建立AOM/DSS诱导的CAC小鼠模型,初步研究IOP在CAC中的作用及机制。
1 材料与方法
1.1 材料
1.1.1 实验细胞及动物人结直肠癌细胞SW620购自中国科学院上海细胞库。6~8周龄BALB/c雄性小鼠购自亿斯实验动物技术有限公司,饲养于本校实验动物中心,饲养温度:(22±2)℃,湿度:40%~60%。本实验符合延边大学动物实验管理委员会相关规定。
1.1.2 主要试剂桦褐孔菌由本校药学院天然药物化学教研室鉴定,IOP由延边大学免疫生物学重点实验室提取;氧化偶氮甲烷(azoxymethane,AOM)购自Sigma公司;葡聚糖硫酸钠(dextran sulfate sodium,DSS)购自MP公司;DMEM培养基购自BI公司;TRIzol购自Invitrogen公司;M‐MLV,Oligo(dt)购自Promega公 司;rTaq购 自TaKaRa公 司;ASC、NF‐κBp65、Cleaved Caspase‐3、β‐actin抗体购自CST公司;NL-RP3、Caspase‐1、Bax、Bcl‐2抗体购自Abcam公司。
1.2 方法
1.2.1 细胞培养将SW620细胞置于DMEM培养基,于37℃、5%CO2的恒温箱中培养48 h。
1.2.2 小 鼠CAC模 型 的 建 立6~8周 龄 雄 性BALB/c小鼠随机分为正常组、模型组(AOM/DSS)和IOP组(150 mg/kg·d)。模型组和IOP组腹腔内单次注射10 mg/kg AOM,1周后,将含2.5%DSS(w/v)的饮用水给小鼠饮用1周,随后换成新鲜饮用水饮用2周,以每给予1周DSS和2周新鲜饮用水为1个周期,重复循环4次。IOP组隔天灌胃给予IOP溶液。在第101天建模结束后处死全部小鼠,并收集小鼠结肠及血液。
1.2.3 小鼠结肠组织的病理学检测 取小鼠结肠组织固定于4%甲醛溶液,并制成厚度为4µm的石蜡切片,HE染色观察小鼠结肠组织病理变化。评分标准见表1。

表1 病理学评分标准Tab.1 Pathological scoring standard
1.2.4 CCK‐8法检测细胞增殖细胞1×104个/孔接种于96孔板,加入不同浓度的IOP(0、50、100、150µg/ml)培养48 h,以10µl/孔加入CCK‐8溶液,孵育2 h后检测细胞增殖。
1.2.5 RT‐PCR检测基因表达以TRIzol法提取组织和细胞中的总RNA,取1 µl样品检测RNA质量,OD260/OD280在1.8~2.0之间可进行后续实验。使用M‐MLV及Oligo(dt)进行反转录,合成cDNA。最后以rTaq及相关引物进行PCR扩增。PCR扩增条件为95℃6 min,94℃30 s,58℃30 s,72℃30 s,72℃5 min。人源引物序列:NLRP3 F:5'‐TGGCTGTAA-CATTCGGAGATTG‐3',R:5'‐GAAGTCACCGAGGGC-GTTGT‐3';Caspase‐1 F:5'‐GGAAACAAAAGTCG-GCAGAG‐3',R:5'‐ACGCTGTACCCCAGATTTTG‐3';ASC F:5'‐GGTCACAAACGTTGAGTGGC‐3',R:5'‐AGAGCTTCCGCATCTTGCTT‐3';GAPDH F:5'‐CCA-CATCGCTCAGACACCAT‐3',R:5'‐GCAACAATATAC-CACTTTACCA‐3',鼠 源 引 物 序 列:NLRP3 F:5'‐GAGTTCTTCGCTGCTATGT‐3',R:5'‐ACCTTCACGT‐CTCGGTTC‐3',Caspase‐1 F:5'‐TATCCAGGAGG‐GAATATGTG‐3';R:5'‐ACAACACCACTCCTTGTTTC‐3';ASC F:5'‐ACACTTTGTGGACCAGCACA‐3',R:5'‐CACGAACTGCCTGGTACTGT‐3';IL‐6 F:5'‐ACATT-GTGGACCAGCACA‐3',R:5'‐CACGAACTGCCGTAC‐TGT‐3';TNF‐α F:5'‐GGCAGGTCTCTTTGGAGTCTG‐3',R:5'‐ACATTCGAGGCTCCAGTCATCG‐3';β‐actin F:5'‐TCTGGTCGTACCACAGGCAT‐3',R:5'‐CGCTC-GTTGCCAATAGTGAT‐3'。
1.2.6 Western blot检测蛋白表达裂解细胞和结肠组织,提取相关蛋白,BCA试剂盒测定蛋白质含量,蛋白质在8%~15%SDS‐PAGE凝胶上分离后,转移至PVDF膜,将印迹与一抗孵育24 h,洗涤印迹,加入标记有HRP的山羊抗兔或抗鼠IgG孵育1 h,再次洗涤,加入ECL发光液进行显影并成像。
1.3 统计学分析使用Graph Pad Prism 7进行统计学分析。所有数据均以±s表示,使用t检验进行组间比较,P<0.05表示差异具有统计学意义。
2 结果
2.1 ⅠOP可抑制SW620细胞增殖如表2所示,IOP可有效抑制SW620细胞增殖(P<0.05),且表现出剂量依赖性。因此,选择0、50、100、150 µg/ml 4个剂量进行后续实验。
2.2 ⅠOP诱导SW620细胞凋亡如图1所示,IOP可显著增加Bax和Cleaved Caspase‐3表达,降低Bcl‐2表达,差异有统计学意义(P<0.05或P<0.01)。以上结果提示,IOP可诱导SW620细胞凋亡。
2.3 ⅠOP增加SW620细胞中NF‐κBp65磷酸化及NLRP3炎症小体的水平如图2所示,IOP可上调NLRP3炎症小体达,增强肿瘤细胞中p‐p65表达。以上结果提示,IOP可通过激活NF‐κB和NLRP3炎症小体表现出较强的抗肿瘤能力。
2.4 ⅠOP改善AOM/DSS诱导的小鼠CAC与模型组相比,IOP组小鼠体型明显增大,背部毛发较光泽,竖毛现象明显减少,且IOP组的小鼠体重明显上调(表3)。此外,在整个建立模型的过程中,模型组小鼠生存率为41.67%,IOP组为66.67%,正常组无死亡情况。HE染色结果表明,与模型组比,IOP组小鼠出现较少的肿瘤性腺体及炎症细胞浸润,部分隐窝结构丢失,存在部分杯状细胞(图3)。以上结果提示,IOP可明显缓解AOM/DSS诱导的小鼠CAC。
2.5 ⅠOP可缓解小鼠的结肠长度和结肠内肿瘤情况IOP治疗后观察各组小鼠结肠及肿瘤变化。与正常组相比,模型组小鼠结肠长度明显降低;与模型组相比,IOP组呈增加趋势(表4,P<0.05)。此外,如表5所示,IOP可明显下调结肠内肿瘤情况(肿瘤数量、肿瘤大小、肿瘤负荷)。以上结果提示,IOP可抑制CAC小鼠肿瘤的发生。
表2 SW620细胞增殖能力的比较(±s)Tab.2 Comparison of SW620 cell proliferation ability(±s)
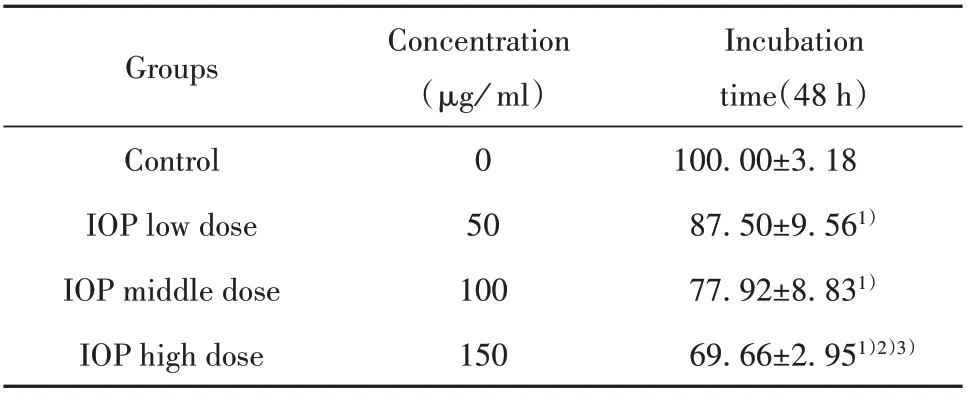
表2 SW620细胞增殖能力的比较(±s)Tab.2 Comparison of SW620 cell proliferation ability(±s)
Note:Compared with control group,1)P<0.05;compared with IOP low dose group,2)P<0.05;compared with IOP middle dose group,3)P<0.05.
Incubation time(48 h)100.00±3.18 87.50±9.561)77.92±8.831)69.66±2.951)2)3)Groups Control IOP low dose IOP middle dose IOP high dose Concentration(µg/ml)0 50 100 150
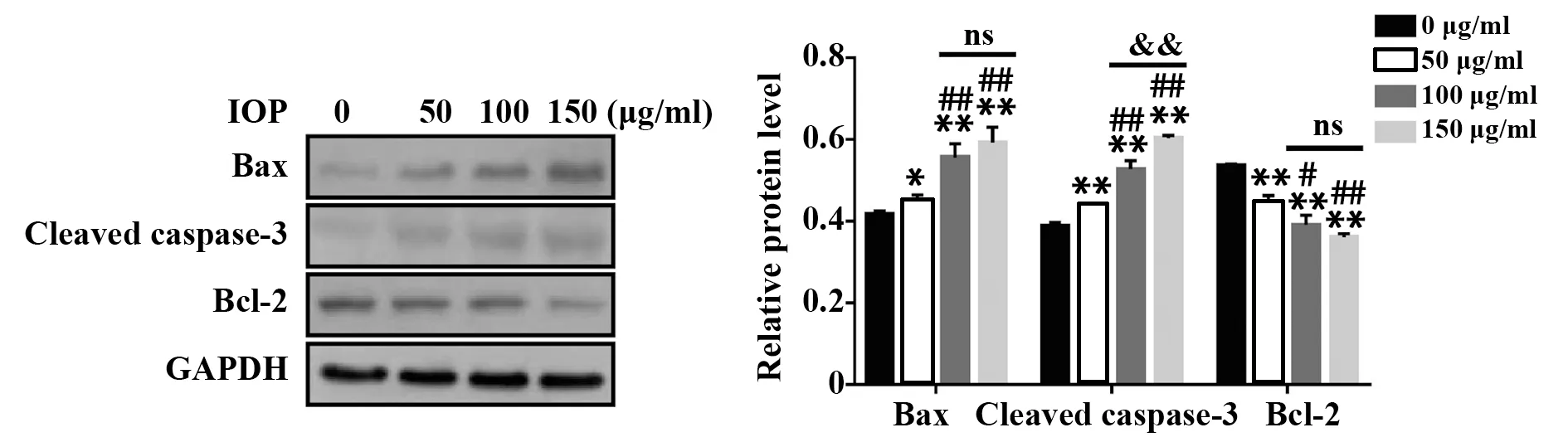
图1 IOP诱导SW620细胞凋亡Fig.1 IOP induced SW620 cell apoptosis

图2 IOP增加SW620细胞中NF‐κBp65磷酸化及NLRP3炎症小体水平Fig.2 IOP increased levels of NF‐κBp65 phosphorylation and NLRP3 inflammasome in SW620 cells
2.6 ⅠOP可下调结肠组织中ⅠL‐6和TNF‐α表达如图4所示,经IOP处理后,IL‐6和TNF‐α的基因和蛋白表达降低(P<0.05或P<0.01)。提示IOP可抑制CAC小鼠中炎症介质的产生。
2.7 ⅠOP可上调结肠组织中NF‐κBp65磷酸化及ASC、Caspase‐1及NLRP3表达与正常组相比,模型组中ASC、Caspase‐1、NLRP3的基因和蛋白水平均升高,经IOP处理后,三者表达被进一步升高。此外,IOP可明显增加p‐p65蛋白表达。以上结果提示,IOP可通过激活NF‐κB信号途径进一步激活NL-RP3炎症小体,从而预防CAC的发生发展(图5,P<0.05或P<0.01)。
表3 各组小鼠体重比较(±s)Tab.3 Comparison of body weight of mice in each group(±s)
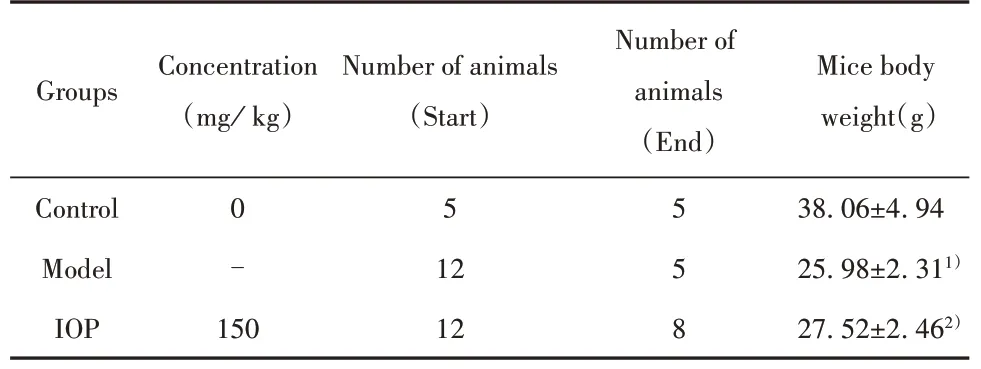
表3 各组小鼠体重比较(±s)Tab.3 Comparison of body weight of mice in each group(±s)
Note:Compared with control group,1)P<0.05;compared with model group,2)P<0.05.
Groups Concentration(mg/kg)Number of animals(Start)Number of animals(End)Mice body weight(g)38.06±4.94 25.98±2.311)27.52±2.462)Control Model IOP 0 -5 150 12 12 5 5 8
表4 各组小鼠结肠长度的比较(±s)Tab.4 Comparison of colon length of mice in each group(±s)

表4 各组小鼠结肠长度的比较(±s)Tab.4 Comparison of colon length of mice in each group(±s)
Note:Compared with control group,1)P<0.05;compared with model group,2)P<0.05.
Colon length(cm)9.867±0.57 7.600±0.351)8.400±0.352)Groups Concentration(mg/kg)Number of animals Control Model IOP 0 -150 5 5 8
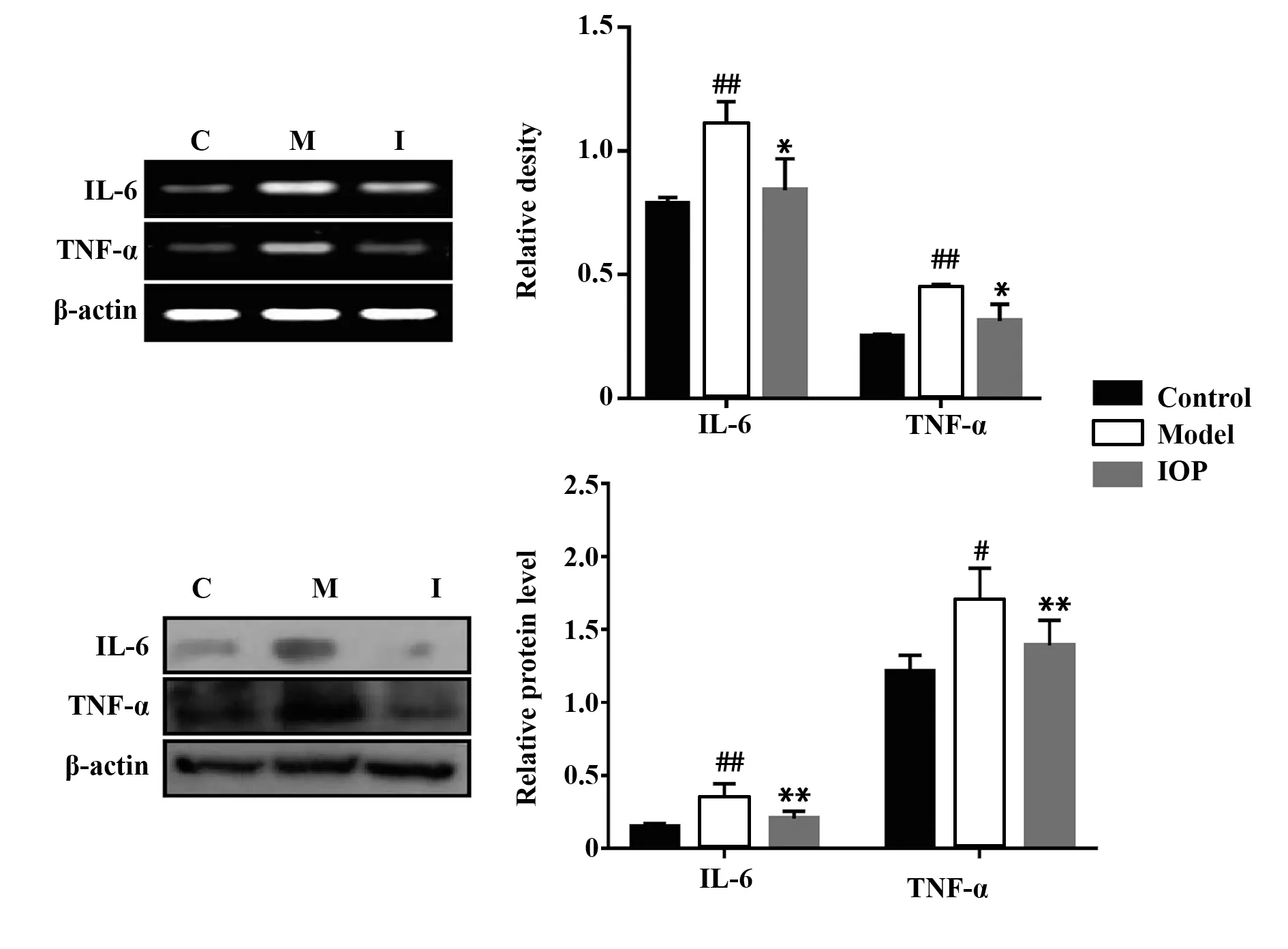
图4 IOP可下调结肠组织中IL‐6和TNF‐α表达Fig.4 IOP down‐regulated expression of IL‐6 and TNF‐α in colon tissues
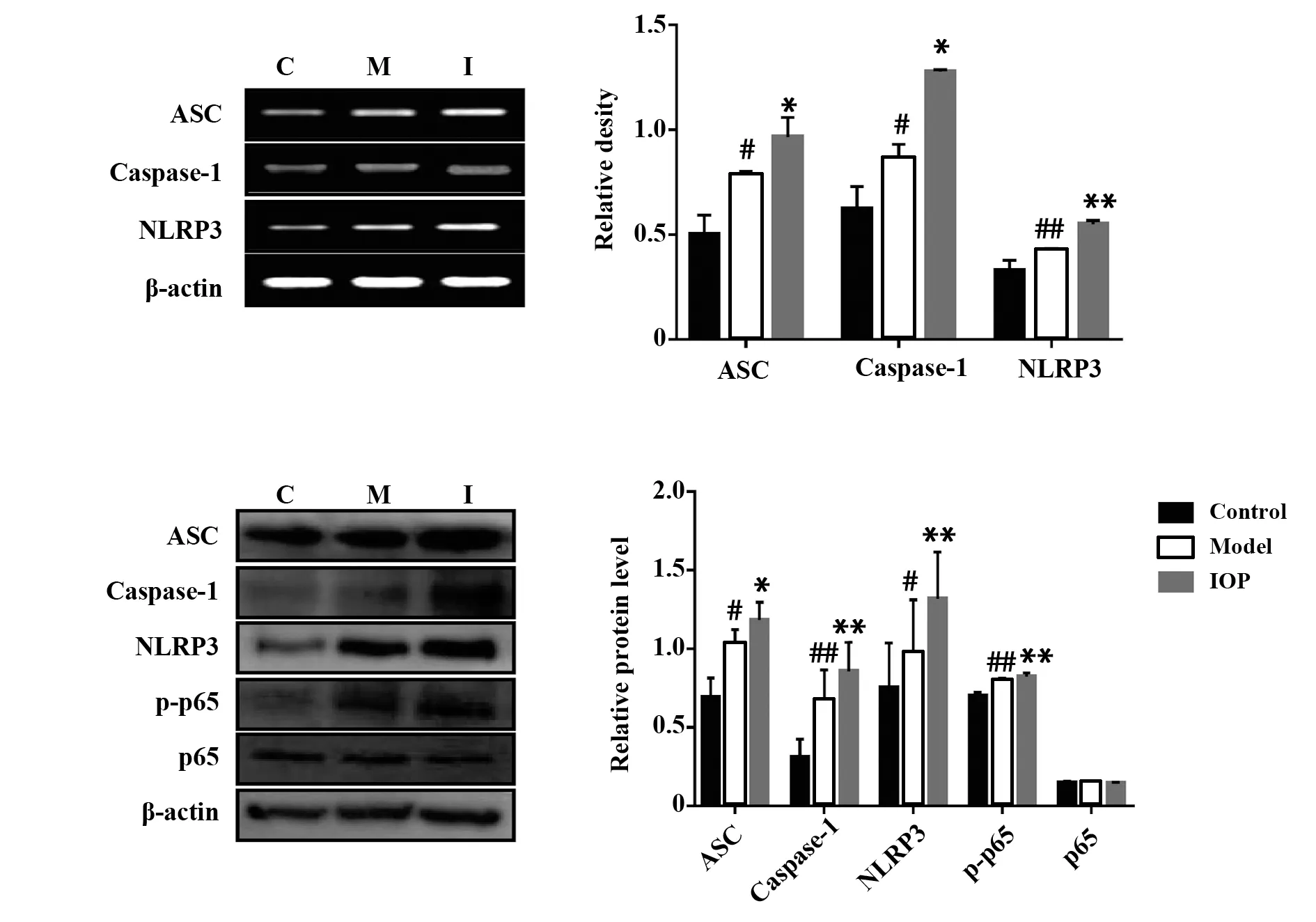
图5 IOP可上调结肠组织中NF‐κBp65磷酸化及ASC、Caspase‐1及NLRP3表达Fig.5 IOP up‐regulated phosphorylation of NF‐κBp65 and expression of ASC,Caspase‐1,NLRP3 in co-lon tissues
表5 各组小鼠结肠腺瘤的比较(±s)Tab.5 Comparison of mouse colonic adenomas in each group(±s)

表5 各组小鼠结肠腺瘤的比较(±s)Tab.5 Comparison of mouse colonic adenomas in each group(±s)
Note:Compared with model group,1)P<0.05.
Tumor volume(mm3)59.09±8.27 24.99±6.481)Groups Model IOP Concentration(mg/kg)-150 Number of animals 5 8 Tumor number 24.5±3.32 14.0±3.091)Tumor load(mm)3.48±0.68 1.50±0.461)
3 讨论
慢性炎症引发癌变的过程十分复杂。在伴有IBD的CAC病例中,疾病的严重程度、病程和炎症程度均与肿瘤的发展有关[12]。因此,IBD的有效治疗在预防CAC的发展中起关键作用。目前,IBD已广泛使用5‐氨基水杨酸、皮质类固醇、胍基嘌呤和TNF‐α阻滞剂治疗[13‐14]。但这些药物与CAC的发生发展之间的关系尚不明确。因此,迫切需要用于CAC的新型安全有效的药物。
细胞无限增殖是肿瘤细胞最显著的特点。大量文献表明,中药对恶性肿瘤细胞的增殖起到抑制作用。如姜黄素可抑制胃癌细胞的增殖和侵袭转移、人参皂苷CK可诱导肝癌细胞凋亡,进而抑制细胞生长[15‐16]。也有研究表明,IOP可抑制肺癌细胞的活力和集落形成能力[17]。本研究发现,IOP可有效抑制SW620细胞增殖,且随着浓度的增加,抑制作用明显提高。此外,IOP还可改善AOM/DSS诱导的CAC小鼠结肠肿瘤的损害。说明IOP可通过抑制细胞增殖和结肠肿瘤的生长减轻CAC发展。
Bcl‐2家族的蛋白质是启动细胞凋亡的关键调控基因,包括抗凋亡蛋白Bcl‐2和促凋亡蛋白Bax。Bcl‐2在多种肿瘤组织中表达,可通过增加线粒体膜电位并抑制线粒体钙离子释放启动肿瘤细胞凋亡。Bax是受Bcl‐2调节的促凋亡蛋白,可诱导线粒体通透性发生变化、激活凋亡相关蛋白并释放细胞色素[18]。本研究发现,SW620细胞经IOP处理后,凋亡蛋白Bcl‐2表达水平显著降低,而Bax、Cleaved Cas-pase‐3蛋白表达明显升高,说明IOP诱导SW620细胞发生凋亡。
NLRP3是炎症小体NLRP家族主要的成员之一,当受到胞外刺激时,可使PYD结构域与ASC相结合并募集pro‐Caspase‐1,NLRP3炎症小体形成后,加速pro‐Caspase‐1剪切为活化的Caspase‐1,进而将IL‐1β、IL‐18前 体 切 割 为IL‐1β、IL‐18释 放 到 体外[19]。NLRP3在炎症反应中起重要作用,NLRP3炎症小体的激活与炎症诱导的癌症有关。然而,NL-RP3炎症小体在IBD和CAC中的作用存在争议。CHEN等[20]研究证明炎症小体活性可通过调节肠道稳态和抗微生物免疫促进炎症性疾病和CAC发生。BAUER等[21]也指出NLRP3的激活显著提高IBD风险。然而,与之形成鲜明对比的是,其他研究表明NLRP3炎症小体对结肠炎具有保护作用[22]。AL-LEN等[23]指出,在AOM/DSS处理的NLRP3、Cas-pase‐1和ASC缺失小鼠中,结肠肿瘤的大小大于同样处理的野生型小鼠。ZAKI等[22]发现NLRP3的激活抑制AOM/DSS诱导的CAC,支持了NLRP3炎症小体在阻止CAC发生方面的作用。与这些发现一致,本团队发现IOP处理可明显增加SW620细胞裂解液和小鼠结肠组织中NLRP3炎症小体表达。说明IOP通过激活NLRP3炎症小体保护小鼠免受AOM/DSS诱导的CAC的侵害。
NF‐κB是细胞中关键的转录调节因子,参与炎症反应、免疫调节和细胞生存等多种生命过程[24]。NF‐κB复合物作为p50和p65亚基的二聚体存在于细胞质,p65亚基的磷酸化增强NF‐κB的转录活性,进而调控炎症细胞因子的表达[25]。NF‐κB是炎症细胞因子产生的主要调控因子,其对NLRP3炎症小体的激活也很重要。既往研究表明NLRP3炎症小体的激活受NF‐κB调控[26]。有研究表明,NLRP3表达增强可通过激活NF‐κB实现,表明NF‐κB与NLRP3炎症小体表达呈正相关[27]。本研究发现IOP可增加p‐p65表达,说明IOP可激活CAC中NF‐κB信号通路表达。
IL‐6是一种多向性炎症细胞因子,不仅在免疫和炎症反应中起重要作用,而且是恶性肿瘤的重要生长因子。TNF‐α是TNF/TNFR细胞因子超家族的成员,参与促进和发展实验性肿瘤和人类癌症高源。等[28]发现,IL‐6可促进肺癌细胞的侵袭转移,经汉黄芩素处理后可进一步抑制IL‐6诱导的细胞侵袭转移。本研究发现IOP可减少IL‐6和TNF‐α产生。也就是说,即在基因水平上p‐p65作为转录因子转录的IL‐6和TNF‐α表达降低,说明IOP可能对p‐p65引起的IL‐6转录具有抑制作用。以上研究结果仅是对IOP抑制细胞因子(IL‐6和TNF‐α)表达的初步研究,其具体作用机制还有待进一步探讨。
综上所述,IOP改善AOM/DSS诱导的小鼠CAC,其主要机制可能是通过激活NF‐κB和NLRP3信号通路和调控细胞因子的表达抑制CAC的发生。IOP发挥出较强的抗肿瘤作用,为中药在治疗肿瘤方面奠定理论基础。