黄芪甲苷通过mTORC1通路调控IgA肾病大鼠脾淋巴细胞分化①
2021-05-26彭胜男陶琰心洪婷杨海燕黄青江西中医药大学科技学院临床医学系南昌330004
彭胜男 陶琰心洪婷 杨海燕 黄青(江西中医药大学科技学院临床医学系,南昌 330004)
IgA肾病(IgA nephropathy,IgAN)又称Berger病,是最为常见的原发性肾小球疾病。文献报道,与健康志愿者相比,IgAN患者血清IL‐10水平较高,血清可溶性生长刺激表达基因2蛋白(growth stimulation expressed gene 2 protein,sST2)浓度与IL‐10水平、24 h尿蛋白和血清IgA水平呈正相关[1]。治疗后血清sST2水平显著降低,血清IL‐10水平显著升高。故推测sST2和IL‐10参与IgAN发病过程。研究发现,IgAN大鼠p70S6K磷酸化水平较对照组显著上调,雷帕霉素可有效抑制p70S6K磷酸化,低剂量mTOR抑制剂雷帕霉素可抑制IgA沉积,减少蛋白尿、系膜细胞激活及细胞外基质分泌,保护肾功能[2]。故推测Akt/mTOR/p70S6k通路在IgAN中被激活。
依据国际共识对IgAN的定义,IgAN的诊断标准是免疫荧光检查可见肾小球系膜区出现IgA或以IgA为主的免疫复合物沉积,以此证明造模成功[3]。亚洲地区IgAN发病率高达30%~40%,常会发展为终末期肾脏病[4]。目前IgAN的发病机制尚未明确,研究认为IgAN患者常伴有胃肠道感染或上呼吸道感染,外源性致病抗原穿过黏膜屏障作用于黏膜细胞或B细胞,导致IgA1分子绞链区O‐聚糖半乳糖缺失,导致其糖基化异常,异常糖基化的IgA1分子刺激机体产生大量IgG和IgA抗体,在血清中形成IgA1免疫复合物,最后沉积于肾小球系膜区导致肾脏损伤。因此,减少异常IgA1生成是IgAN治疗的关键靶点。脾脏是机体最大的免疫器官,含有大量B淋巴细胞和巨噬细胞,是机体细胞免疫和体液免疫的中心。mTOR与B细胞分化密切相关。结节性脑硬化复合物1(tuberous sclerosis complex‐1,TSC1)是mTOR上游的负性调控因子,敲除小鼠B细胞中的TSC1可导致B细胞成熟障碍。Akt激活时其边缘区B细胞明显减少,而mTOR抑制剂雷帕霉素可部分缓解边缘区B细胞减少,证明mTOR与B细胞增殖密切相关[5]。LPS可作为免疫佐剂,破坏肝脏的内皮网状系统,减少IgA清除。目前,IgAN的治疗方式主要有糖皮质激素、抗感染、抗凝、免疫抑制剂、扁桃体摘除术、血浆置换、血管紧张素转换酶抑制剂等,但效果较差[6]。IgAN患者扁桃体内含有异常糖基化的IgA1,因此临床常采取扁桃体摘除术治疗IgAN,减少异常IgA1产生,减轻免疫炎症反应,恢复机体免疫平衡。黄芪治疗IgAN已有报道,黄芪颗粒联合厄贝沙坦治疗IgAN可有效调节免疫力,减少感染,降低蛋白尿水平,提高临床疗效[7]。黄芪甲苷(astragalosideⅣ,AS)是黄芪的重要药理成分,具有免疫调节作用,可减少异常IgA生成,抑制免疫炎症因子产生,减轻炎症反应。本研究探讨AS对IgAN大鼠脾淋巴细胞分化的影响及机制。
1 材料与方法
1.1 材料
1.1.1 实验动物28只清洁级SD大鼠,体重(200±20)g,购自南昌大学医学实验动物科学部。
1.1.2 主要试剂AS购自南京泽朗医药科技有限公司;牛血清白蛋白(BSA)购自Roche公司;脂多糖(LPS)购自Sigma公司;四氯化碳(CCl4)、蓖麻油购自上海实验试剂有限公司;RAPA购自上海源叶生物科技公司;异硫氰酸荧光素(FITC)标记的IgA抗体和IL‐10抗体购自Abcam公司;CD4抗体和p‐p70S6k抗体购自Cell signaling公司;CD8抗体购自Biolegend公司;p‐mTOR抗体购自Thermo Fisher公司;IgG二抗、DAB显色试剂盒购自北京中杉金桥生物公司。
1.2 方法
1.2.1 分组及造模SD大鼠随机分为4组:对照组、IgAN模型组、RAPA组和AS组,每组7只。采用BSA+LPS+CCl4联合构建IgAN大鼠模型,第1~6周隔天灌胃给予BSA(400 mg/kg),第6周和第8周末尾静脉注射LPS(0.05 mg/只),第1~9周每周末皮下注射CCl4(CCl40.1 ml/只+蓖麻油0.5 ml/只)。RAPA组SD大鼠造模第7周灌胃给予RAPA 1 mg/(kg·d),1次/d,连续4周,其余同IgAN组。AS组大鼠建模过程中灌胃给予AS,前6周采用1%AS混悬液配制BSA,其他操作与IgAN组相同,第7周开始灌胃给予AS 50 mg/(kg·d),1次/d,连续4周,对照组除给予等量生理盐水,其他操作与IgAN组相同。所有大鼠标准喂食,第10周股动脉取血,快速取脾脏和肾脏,脾脏用4%多聚甲醛固定,用于免疫组化和病理观察。肾皮质在置于冰上,迅速制成冰冻切片,用于免疫荧光观察。
1.2.2 肾组织免疫荧光观察取肾皮质制成8µm冰冻切片,丙酮固定10 min,PBS洗3次,5 min/次,加入正常山羊血清,37℃孵育45 min,甩干,勿洗,滴加FITC标记的IgA抗体(1∶100),避光操作,4℃孵育过夜,PBS冲洗3次,5 min/次,晾干,封片,荧光显微镜下观察。
1.2.3 脾组织病理观察取脾脏用4%多聚甲醛固定,脱水,透明,石蜡包埋,切片(5µm),HE染色,光学显微镜观察各组大鼠脾脏病理学变化。
1.2.4 脾CD4+T细胞数和CD8+T细胞数检测各组切片脱蜡,水化,微波修复抗原,滴加去离子水,再分别滴加CD4和CD8一抗,4℃孵育过夜,PBS冲洗3次,5 min/次,加入二抗,37℃孵育30 min,PBS冲洗3次,5 min/次,DAB染色,苏木素复染,脱水,透明,封片。普通光学显微镜高倍镜观察,每张切片随机选取10个视野观察并拍照,方网测试系统计数,并计算CD4+T细胞和CD8+T细胞数密度。
1.2.5 脾脏ⅠL‐10、p‐mTOR和p‐p70S6k表达切片脱蜡,水化,抗原修复,分别滴加IL‐10、p‐mTOR和p‐p70S6k抗体,4℃孵育过夜,PBS清洗,加入二抗,37℃孵育30 min,PBS冲洗,DAB显色,复染,脱水,透明,封片。高倍镜观察并拍照。采用Image‐Pro Plus 6.0软件进行分析,计算各视野阳性染色的积分光密度(IOD)并计算平均值。
1.3 统计学处理采用SPSS17.0软件进行统计学分析,数据以±s表示,多组间比较采用单因素方差分析,两组间比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
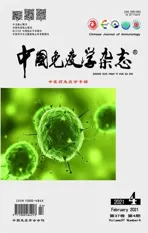
2.1 肾ⅠgA沉积对照组大鼠肾小球系膜区未见明显绿色荧光,IgAN组大鼠肾小球系膜区可见较强绿色荧光,提示造模成功。与IgAN组比,RAPA组和AS组大鼠肾小球系膜区绿色荧光强度减弱(图1),提示RAPA和AS可减轻IgAN大鼠炎症反应,减少肾小球系膜区IgA沉积,可能与中性粒细胞和单核细胞有关,此两类细胞均可高表达IgA可结晶片段受体(FcαR),前者可介导急性炎症,后者可介导慢性炎症。
2.2 大鼠脾脏病理学变化对照组大鼠脾组织结构清晰,白髓区内脾小体较小而少,主要为B淋巴细胞,一侧以中央动脉为中心,周围淋巴组织呈鞘状包绕,主要为T淋巴细胞。与对照组相比,IgAN组大鼠白髓区内脾小体体积增大。数量增多,生发中心更为明显,小结帽朝向边缘区,提示B淋巴细胞进一步增殖,一侧动脉周围淋巴鞘增厚,T淋巴细胞数增多,提示IgAN大鼠脾内体液免疫应答和细胞免疫应答均增强。与IgAN组相比,RAPA组和AS组大鼠脾小体增大增多和动脉周围淋巴鞘增厚情况减轻,提示RAPA和AS均可抑制IgAN大鼠脾内免疫应答,减轻免疫炎症反应(图2)。
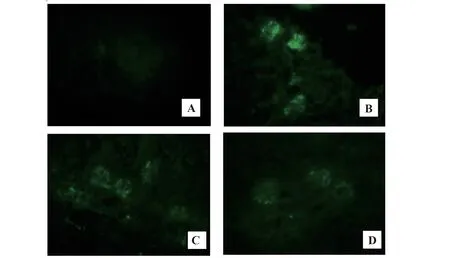
图1 大鼠肾脏IgA免疫荧光染色(×400)Fig.1 IgA immunofluorescence staining of kidneys of rats(×400)
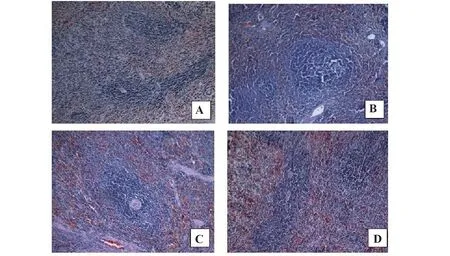
图2 大鼠脾脏病理学检查(×400)Fig.2 Pathological examination of spleen in rats
2.3 大鼠脾脏CD4+T细胞和CD8+T细胞免疫组化检测与对照组相比,IgAN组大鼠脾内CD4+T细胞数密度增加而CD8+T细胞数密度减少(P<0.01)。与IgAN组比,RAPA组 和AS组大 鼠 脾内CD4+T细胞数密度均减少而CD8+T细胞数密度增加(P<0.05)。提示IgAN大鼠脾内辅助性T细胞(Th)增多而抑制性T细胞(Ts)减少,免疫系统过度激活,AS和RAPA均可有效纠正免疫失衡,抑制免疫系统过度激活(表1、图3)。
表1 大鼠脾脏淋巴细胞数密度(±s,1×104个/μm3)Tab.1 Number density of lymphocytes in spleen of rats(±s,1×104 cell/μm3)
表1 大鼠脾脏淋巴细胞数密度(±s,1×104个/μm3)Tab.1 Number density of lymphocytes in spleen of rats(±s,1×104 cell/μm3)
Note:Compared with control group,1)P<0.01;compared with IgAN group,2)P<0.05.
CD8+T 1.01±0.12 0.64±0.131)0.92±0.111)2)0.96±0.251)2)Groups Control IgAN RAPA AS CD4+T 2.20±0.23 7.20±1.901)5.31±1.631)2)4.60±1.571)2)
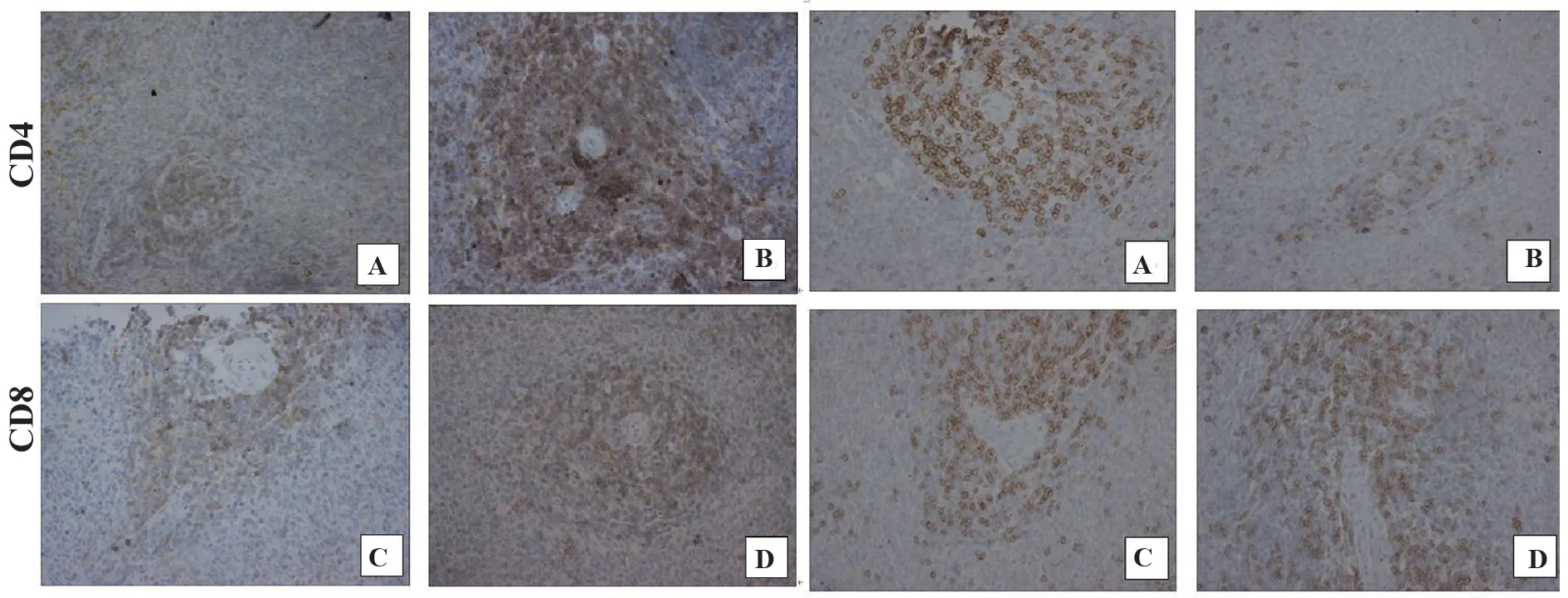
图3 大鼠脾脏CD4、CD8 T细胞免疫组化染色(×400)Fig.3 Immunohistochemical staining of CD4,CD8 T cells in spleens of rats(×400)

图4 大鼠脾脏IL‐10、p‐mTOR、p‐p70S6k免疫组化染色(×400)Fig.4 Immunohistochemical staining of IL‐10,p‐mTOR,p‐p70S6k in spleens of rats(×400)
表2 大鼠脾脏IL‐10、p‐mTOR和p‐p70S6k表达(±s)Tab.2 Expressions of IL‐10,p‐mTOR and p‐p70S6k in spleen of rats(±s)
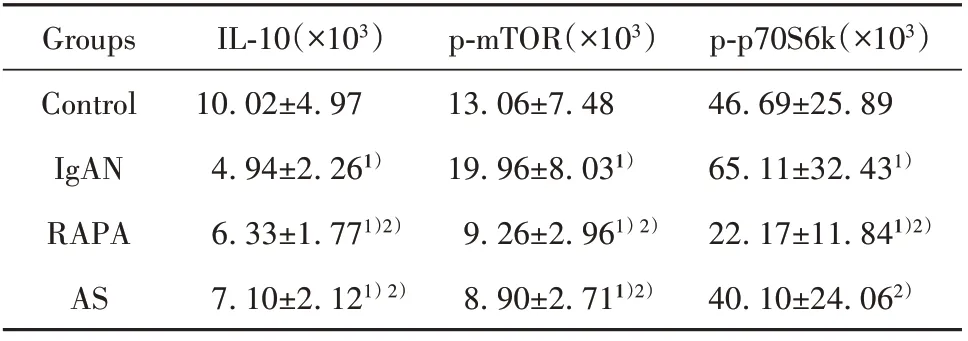
表2 大鼠脾脏IL‐10、p‐mTOR和p‐p70S6k表达(±s)Tab.2 Expressions of IL‐10,p‐mTOR and p‐p70S6k in spleen of rats(±s)
Note:Compared with control group,1)P<0.01;compared with IgAN group,2)P<0.01.
p‐p70S6k(×103)46.69±25.89 65.11±32.431)22.17±11.841)2)40.10±24.062)Groups Control IgAN RAPA AS IL‐10(×103)10.02±4.97 4.94±2.261)6.33±1.771)2)7.10±2.121)2)p‐mTOR(×103)13.06±7.48 19.96±8.031)9.26±2.961)2)8.90±2.711)2)
2.4 大鼠脾脏ⅠL‐10、p‐mTOR和p‐p70S6k免疫组化检测与对照组相比,IgAN组大鼠脾脏内IL‐10水平下降(P<0.01),而p‐mTOR和p‐p70S6k水平升高(P<0.01)。与IgAN组比,RAPA组和AS组大鼠脾脏内IL‐10水平升高(P<0.01),而p‐mTOR和p‐p70S6k水平下降(P<0.01)。提示IgAN大鼠脾脏内免疫抑制因子IL‐10分泌减少,p‐mTOR和p‐p70S6k表达上调,mTORC1信号通路被激活。RAPA组和AS组大鼠脾脏内IL‐10分泌增多,且p‐mTOR和p‐p70S6k表达降低,mTORC1信号通路被抑制(图4、表2)。
3 讨论
IgAN是世界最常见的一种原发性肾小球肾炎,主要以肾小球系膜区IgA免疫复合物沉积为病理学特点[8]。本实验选用BSA+LPS+CCL4三联法造模,实验中对照组大鼠肾脏系膜区未见明显IgA沉积,而IgAN组大鼠肾脏系膜区出现不连续的颗粒状IgA沉积,提示造模成功。与IgAN组相比,RAPA组和AS组大鼠肾小球系膜区绿色荧光不同程度减弱,提示RAPA和AS均可减轻肾小球系膜区IgA沉积。
IgAN是一种自身免疫性疾病,引起IgAN的自身抗原主要是异常糖基化的IgA1,其形成可能与扁桃体炎、上呼吸道和胃肠道感染等黏膜免疫反应有关,在患者血清和肾小球系膜区均可检测到较高浓度的异常IgA1[9]。IgAN的发生与多种因素相关,如机体免疫失调、黏膜免疫异常、IgA分子结构异常、IgA免疫复合物清除障碍、遗传因素等,但具体发病机制尚未明确。可以肯定的是,IgA免疫复合物的大量产生和在肾小球系膜区沉积是发病关键。抑制过度免疫应答、减少IgA产生和在肾小球系膜区沉积、维持机体免疫平衡是治疗IgAN的重要思路。本研究HE染色切片观察到,与对照组相比,IgAN组大鼠脾脏白髓中脾小体增大增多,生发中心明显,动脉周围淋巴鞘增厚,与IgAN组相比,RAPA组和AS组大鼠脾小体增大增多和动脉周围淋巴鞘增厚情况减轻,提示在IgAN发病中,大鼠脾脏内体液免疫应答和细胞免疫应答增强。血液中IgA主要由骨髓中的浆细胞产生,分泌型IgA主要是由胃肠道和呼吸道黏膜免疫系统产生。本研究考虑IgA主要由B细胞激活后分泌,而脾脏是B细胞的主要定居地及免疫应答的主要场所,结合病理观察实验结果,与对照组相比,IgAN组大鼠脾脏白髓中脾小体增大增多,生发中心明显(脾小体内主要为B细胞),推测IgAN中大量产生的IgA与脾脏B细胞增殖有关,RAPA和AS可抑制免疫激活,减轻免疫应答。
调节性B细胞(regulatory B cells,Breg)在2006年首次被发现,是B细胞的亚群,主要通过分泌IL‐10及TGF‐β等免疫抑制因子发挥免疫调节作用[10]。分泌IL‐10的Breg是目前研究热点,其可抑制小鼠过敏反应和部分自身免疫性疾病,如系统性红斑狼疮、炎症性肠病、接触性过敏反应、哮喘、自身免疫性脑脊髓炎等[11]。本研究显示,与对照组相比,IgAN组大鼠脾内IL‐10分泌减少,与IgAN组相比,RAPA组和AS组大鼠脾内IL‐10分泌增多,提示免疫抑制因子IL‐10分泌减少,免疫应答过度激活,可能是引起IgAN发病的重要原因,分泌IL‐10的调节性淋巴细胞是IgAN发病的关键。RAPA和AS可促进IL‐10分泌,抑制过度免疫应答,可能是导致其肾小球系膜区IgA沉积减少的原因之一。同时,本研究显示,与对照组相比,IgAN组大鼠脾内CD4+T细胞增加而CD8+T细胞减少,与IgAN组相比,RAPA组和AS组大鼠脾内CD4+T细胞减少而CD8+T细胞增加,提示在IgAN大鼠脾内Th增多而Ts减少,发生免疫系统过度激活,AS和RAPA均可有效纠正这种免疫失衡,抑制免疫系统过度激活,进一步说明调节性淋巴细胞对IgAN发病起重要作用。
文献报道,mTOR(雷帕霉素靶蛋白)在炎症性自身免疫性疾病中发挥重要作用,在IgAN中的作用前言中也有报道[12]。mTOR信号通路对调节Breg、T细胞、单核细胞、中性粒细胞和树突状细胞分化具有重要作用,mTOR分为mTOR复合物1(mTORC1)和mTOR复合物2(mTORC2)2种,mTORC1对RAPA及其衍生物敏感,雷帕霉素可抑制淋巴细胞增殖,mTOR与淋巴细胞分化成熟密切相关[13‐15]。ZHANG等[16]构建了含有mTOR亚等位基因的小鼠模型,下调mTORC1和mTORC2活性及mTOR蛋白表达,小鼠前体B细胞早期发育被部分阻断,外周B淋巴细胞数明显减少。在B细胞受体(BCR)介导的B细胞激活中,无论是RAPA还是磷脂酰肌醇‐3‐激酶(PI3K)抑制剂均可阻断B淋巴细胞增殖,提示PI3K及下游mTOR直接影响BCR通路[17]。mTORC1信号被激活后,作用于转录因子核糖体蛋白激酶(p70S6k)和4E‐结合蛋白1(4E‐BP1),其磷酸化程度是反映mTORC1活性的重要指标,在下游蛋白翻译过程中起关键作用。p70S6k被mTORC1激活后可促进mRNA翻译。本研究显示,IgAN大鼠脾内p‐mTOR和p‐p70S6k表达上升,与IgAN组相比,RAPA组和AS组大鼠脾内p‐mTOR和p‐p70S6k表达降低,提示在IgAN发病过程中,mTORC1信号通路被激活,而RAPA和AS可抑制mTORC1信号通路激活。基于对BCR增殖作用的影响,抑制mTORC1通路、调节淋巴细胞增殖和分化、抑制免疫炎症反应有望成为自身免疫性疾病治疗的有效方法。
AS是从中药黄芪中提取的中药单体,是黄芪的主要药理成分之一,可减少MCP‐1、TNF‐α和TGF‐β等炎症细胞因子分泌,减轻免疫炎症反应。利用免疫抑制剂治疗IgAN已取得一定疗效[18]。课题组前期研究发现,AS可有效地减少IgAN大鼠脾脏CD20+B细胞数,具体途径可能是AS通过抑制促炎症因子高迁移率族蛋白1(high mobility group pro-tein 1,HMFB1)抑制炎症反应,而HMFB1可通过调节性T细胞(regulatory T cells,Treg)影响B细胞分化和增殖,纠正免疫失衡。本研究显示,与IgAN组相比,AS组大鼠脾内p‐mTOR和p‐p70S6k表达降低,mTORC1信号通路被抑制。RAPA可抑制B淋巴细胞增殖,mTOR与B淋巴细胞的分化成熟密切相关,推测AS可能通过抑制mTORC1通路减少脾脏内效应性B细胞数,从而减少IgA产生,减轻免疫炎症反应。
综上所述,AS可减轻IgAN大鼠肾小球系膜区IgA沉积,可能与抑制mTORC1信号通路,调节脾脏内淋巴细胞分化和增殖有关,是否有其他信号通路参与有待进一步研究。