龙须菜(Gracilariopsis lemaneiformis)海藻糖-6-磷酸合成酶(TPS)对逆境胁迫的响应*
2021-05-26张莹莹宣雯燕张小倩徐年军
张莹莹 吕 燕 宣雯燕 张小倩 徐年军 孙 雪
龙须菜()海藻糖-6-磷酸合成酶(TPS)对逆境胁迫的响应*
张莹莹 吕 燕 宣雯燕 张小倩 徐年军 孙 雪①
(宁波大学海洋学院 浙江省海洋生物工程重点实验室 宁波 315211)
非还原性二糖海藻糖及其代谢物是调控植物生长发育和逆境响应的信号分子。本研究以大型海藻龙须菜()为对象, 从基因转录、蛋白和酶活性3个水平探讨了海藻糖合成酶——海藻糖-6-磷酸合成酶(TPS)对高温、高盐及渗透胁迫的响应。龙须菜中4条TPS序列均具有TPS家族保守结构域(Glyco-transf-20)和TPP家族保守结构域(Trehalose-PPase), 且属于Class I亚家族。在转录水平上, 高盐胁迫主要促进了1、2和4基因的表达, 而渗透胁迫则总体抑制了1、2和3基因的表达。在高盐胁迫48 h时, TPS1蛋白含量升高到对照组的2.03倍。在高温和高盐胁迫24 h时, TPS活性升高, 而在高盐胁迫48 h及渗透胁迫条件下酶活性降低。可见海藻糖-6-磷酸合成酶参与了龙须菜抗高温和高盐胁迫的应答, 但对渗透胁迫不敏感。该研究为提高龙须菜抗逆性及培育抗逆龙须菜品种提供了参考。
龙须菜; 海藻糖; 海藻糖-6-磷酸合成酶; 非生物胁迫
龙须菜()隶属红藻门(Rhodophyta)、江蓠目(Gracilariales), 是一种生长在潮间带的大型经济海藻。龙须菜不仅可用作琼胶提取原料、鲍的饵料及食材, 而且在去除氮磷、降低海水富营养化、维持海洋生态平衡方面也具有重要的环境效益(Chen, 2015)。野生型龙须菜主要分布在山东沿海, 其生长主要集中在春秋两季, 生长的适温范围为12—23°C (张学成等, 2009)。随着耐高温981品系等的成功培育, 大规模的龙须菜栽培逐渐从原来的北方低温海区扩展到了南方高温海区。但南方夏季海水温度高, 龙须菜无法成功度夏, 并且潮汐以及采收运输过程中藻体还可能会受到渗透胁迫的影响。因此, 研究龙须菜抗逆胁迫对其夏季栽培及运输等具有一定的参考价值。
海藻糖是一种非还原性二糖, 广泛存在于植物、细菌、真菌和无脊椎动物中。海藻糖不仅可用于生物体内碳的存储和运输, 还可作为压力保护剂使生物更好地抵抗不利环境胁迫(Schluepmann, 2004; O’Hara, 2013; Tang, 2016)。高含量海藻糖对于许多沙漠植物如折扇叶()、卷柏()等的生存是必需的(Goddijn, 1999; Paul, 2008)。在热激条件下, 酿酒酵母()中海藻糖积累量可达到细胞干重的30% (Bell, 1998)。拟南芥()中海藻糖含量的增加会提高其对盐胁迫的耐受性(Krasensky, 2014)。可见生物体内海藻糖的积累与逆境胁迫存在着密切关系。此外, 海藻糖及其代谢物海藻糖-6-磷酸(Trehalose-6- phosphate, T6P)还参与一些信号调控, 它们可能作为中央代谢调节器, 协调植物中多种代谢通路。
自然界中有5条海藻糖合成途径, 其中OtsA-OtsB途径在生物中分布最广泛, 也是植物中发现的唯一的海藻糖合成途径(Paul, 2008)。在植物中, 海藻糖合成由两步反应组成, 首先海藻糖-6-磷酸合成酶(Trehalose-6-phosphate synthase, TPS)催化尿苷二磷酸-葡萄糖与葡萄糖-6-磷酸合成T6P, 然后T6P在海藻糖磷酸磷酸酶(Trehalose-6-phosphate phosphatase, TPP)催化下脱磷酸形成海藻糖。海藻糖-6-磷酸合成酶在调控碳水化合物代谢、生长发育及胁迫应答响应中起着重要作用。如即使在合适的开花条件下, 缺失1的拟南芥开花也会推迟到很晚(Wahl, 2013)。与非转基因水稻()相比, 过表达基因的转基因水稻在高盐、干旱和低温条件下能够更好地维持生长和抗光氧化损伤(Li, 2011)。在高温下,1基因敲除的酵母菌不生长, 而1过表达的菌株则生长良好(Jiang, 2016)。
目前许多生物中基因序列信息已经阐明。尽管高等植物中不会大量积累海藻糖, 但是基因组测序结果显示植物中存在着基因家族。如水稻、小麦()和大豆()中分别有11条、12条和13条基因, 木豆()中则有28条序列(Zang, 2011; Singh, 2012; Xie, 2015)。但是在藻类中关于基因信息及抗逆性的工作较少。在本研究中, 我们分析了从龙须菜基因组中筛选到的4条基因序列, 并在转录、蛋白及酶活性3个水平探究了TPS对高温、高盐及渗透胁迫的响应。该研究丰富了海藻糖在藻类抗逆胁迫中的工作, 为提高龙须菜抗逆性提供了资料。
1 材料与方法
1.1 材料与培养条件
龙须菜耐高温981品系采自福建霞浦县长春镇养殖场(119°59′E, 26°43′N)。首先用毛刷清洗去除藻体表面附着物, 然后挑取生长状态良好的龙须菜, 用镊子截取5—10 cm长的藻体尖部, 置于光照培养箱中进行培养。培养条件为: 温度23 °C, 光强约40 μmol/(m2×s), 光周期12L : 12D, 培养基使用盐度30的无菌海水。
1.2 材料处理
实验共设置4个组: 对照组(CK: 23 °C, 盐度30)、高温组(HS: 30 °C, 盐度30)、高盐组(SS: 23 °C, 盐度45)和渗透胁迫组(OS: 23 °C, 盐度30, 5% PEG6000), 其他培养条件与1.1相同, 每组3个重复。分别在培养0、3、6、12 h取约100 mg样品用于实时荧光定量PCR(RT-qPCR)分析; 分别在0、12、24、48 h取约200 mg样品用于蛋白免疫印迹(Western blot)分析或酶活性测定。
1.3 TPS序列的生物信息学分析
结合龙须菜基因组测序和cDNA末端快速扩增(RACE)技术, 我们得到4条龙须菜TPS基因序列, 分别记为1—4。利用ProtParam tool (https: //web. expasy.org/protparam/)进行TPS蛋白基本理化性质预测。利用SMART (http: //smart.embl-heidelberg.de/)分析TPS蛋白结构和功能域。使用TMHMM (http://www. cbs.dtu.dk/services/TMHMM/)对TPS蛋白中跨膜结构进行预测。分别利用SignalP (http://www.cbs.dtu.dk/ services/SignalP/)和Plant-mPLoc (http://www.csbio. sjtu.edu.cn/bioinf/plant-multi/)对TPS蛋白进行信号肽和亚细胞定位分析。用MEGA 7.0软件的邻接法构建TPS系统进化树(饶莉萍等, 2020), bootstrap值设置为1000。
1.4 TPS基因转录分析
参考林丽春等(2019)的方法, 将1.2中的样品进行总RNA提取和cDNA的合成。以n和为内参基因, 利用Primer Premier 5.0软件设计和内参基因序列的RT-qPCR引物(表1), 引物序列交由华大基因有限公司合成。所有基因片段均经过T-A克隆和测序验证为正确的序列。在Eppendorf荧光定量PCR仪(Mastercycler ep realplex, Germany)中进行RT-qPCR扩增, 所用试剂和反应程序等参照孙鹏等(2019)的方法进行。采用2−ΔΔCT法分析目的基因的相对表达水平(Livak, 2001)。
1.5 抗体制备与Western blot分析
根据抗体制备原则及TPS氨基酸序列设计多肽序列, 交由杭州华安生物技术有限公司完成抗体制备。经过特异性验证和检测, 只有TPS1蛋白制得了合格抗体, 其多肽序列为NDDPNRIRTTPRSIHC。
根据吕燕等(2019)的方法进行蛋白提取和浓度测定。总蛋白经过SDS-PAGE电泳后, 将胶转移到聚偏二氟乙烯(PVDF)膜上, 用5%牛血清白蛋白于室温封闭2 h, 然后用封闭液稀释(1:200)的一抗溶液于4 °C孵育过夜, 洗膜3次, 加入1:8000稀释的HRP标记的羊抗兔IgG二抗(康为世纪, 货号CW0103)溶液孵育1.5 h, 洗膜, 最后加入Western Bright ECL化学发光液(Advansta)反应后, 在Tanon 5200全自动化学发光图像分析系统中检测、成像, 用Image J软件分析目的蛋白条带的灰度值。
表1 RT-qPCR的引物

Tab.1 Primers used for RT-qPCR
1.6 酶的提取及TPS活性分析
酶提取方法参考Pramanik等(2005)并进行了一些修改。将200 mg龙须菜在液氮中研磨成粉末, 然后加入50 mmol/L的Tris-HCl缓冲液(含100 mmol/L的NaCl, DTT和PMSF, pH 7.5)提取。最后将提取物以13000×(4 °C)离心5 min, 上清液即为酶粗提液。
TPS活性测定方法参考Hottiger等(1987)。该方法检测了在葡萄糖-6-磷酸存在下UDP-葡萄糖中UDP的释放, 以340 nm吸光度的降低来计算UDP的释放量。将每g样品每min形成1 nmol UDP定义为一个酶活性单位(U), 酶活性表示为U/g藻体鲜重(FW)。
1.7 数据分析
采用Excel 2013进行数据处理和作图, 实验数据均以平均值±标准偏差(mean±SD)表示。用SPSS 13.0中的One-way ANOVA和Tukey多重比较进行统计学分析, 以<0.05设为差异显著。对于RT-qPCR的数据, 把每个组在0 h时的基因表达量记为1, 将基因表达倍数上调2倍或下调0.5倍设为差异显著(Chang, 2014)。
2 结果与分析
2.1 TPS序列和结构特征
龙须菜4条基因编码的蛋白特征如表2所示, 其在GenBank中的序列号分别为MT919220—MT919223。其中3基因序列最长, 其次是1, 两者分别编码1140和1007个氨基酸, 而2和4开放阅读框较短, 其编码蛋白分子量分别为84.9 ku和100.6 ku。4条序列中, TPS1、TPS2和TPS4为酸性蛋白(pI为5.60—6.14), 而TPS3则偏弱碱性(pI为7.94)。4条TPS蛋白的不稳定指数在43.75—52.98之间, 以≤40为稳定性蛋白的标准, 龙须菜TPS蛋白均为不稳定性蛋白; 平均亲水系数在–0.382和–0.229之间, 均为亲水性蛋白。
对龙须菜TPS蛋白序列进行结构域分析(图1), 发现4条TPS的N端都有TPS家族保守结构域(Glyco-transf-20), C端都包含TPP家族保守结构域(Trehalose-PPase)。除了以上两个结构域之外, TPS1蛋白的N端还包含一个CBM-2保守结构域(carbohydrate-binding module), 而TPS3蛋白的C端764—882 aa和933—1121 aa各有1个TPP家族保守结构域。跨膜区和信号肽分析发现TPS1—TPS4蛋白均无跨膜区, 也无信号肽序列。亚细胞定位分析结果表明TPS1、TPS2可能位于细胞质或液泡中, TPS3、TPS4则可能位于叶绿体或液泡中。
表2 龙须菜TPS蛋白序列的基本特征

Tab.2 Characteristics of TPSsequences in G. lemaneiformis
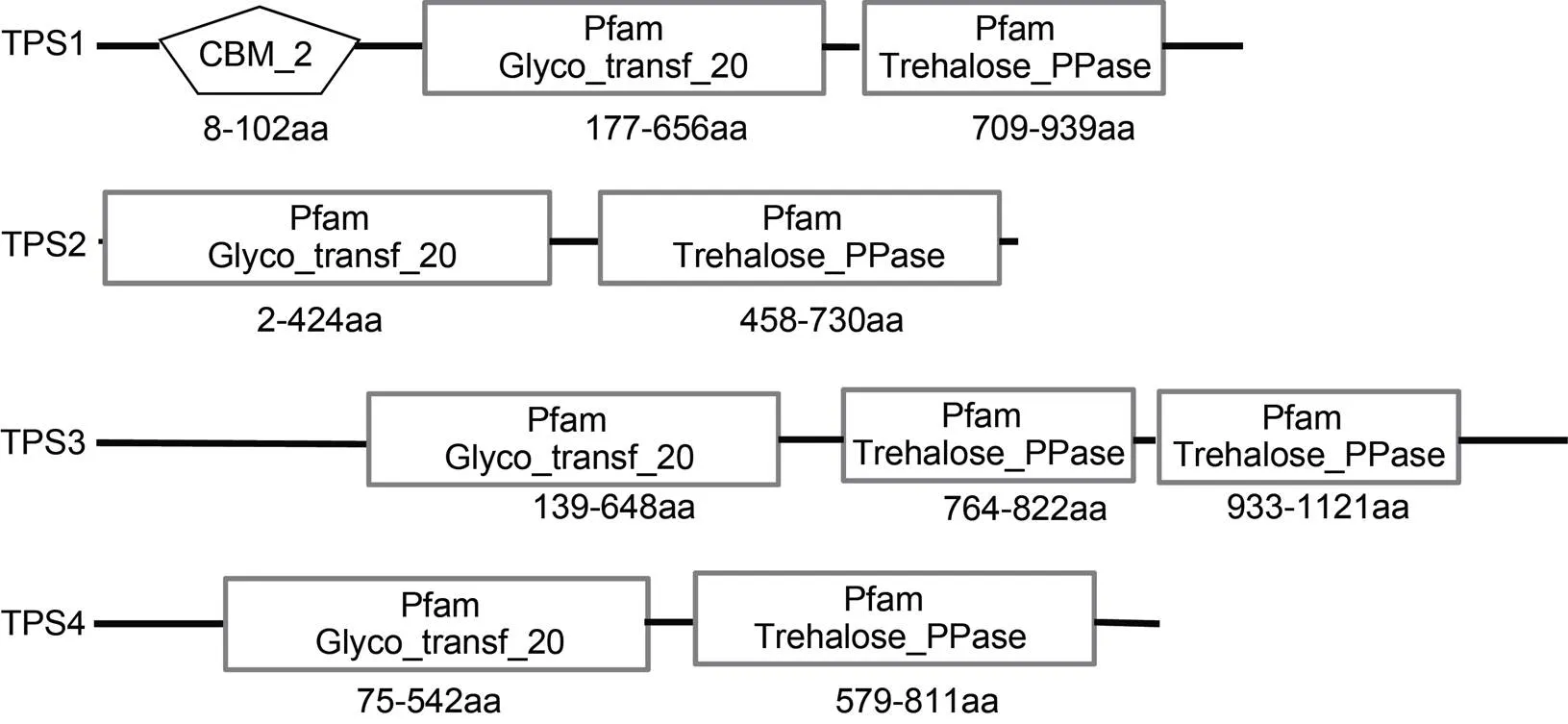
图1 龙须菜TPS蛋白的结构域组成
2.2 龙须菜TPS蛋白序列系统进化分析
在GenBank数据库中选了24条藻类TPS蛋白序列, 将这些TPS与4条龙须菜TPS序列一起构建系统进化树(图2a)。在进化树中, 28条TPS分列在4个簇中, 各个簇中分别包含1条龙须菜TPS序列。在每一个簇中, 龙须菜TPS与绳状龙须菜()TPS距离最近, 相似性均在99%以上, 与皱波角叉菜()TPS相似性为51%—77%, 3者的4条TPS分别一一对应。其次较为相似的为坛紫菜()、温泉红藻()等红藻。
为了进一步分析龙须菜TPS所属亚家族, 我们又将龙须菜中4条TPS与酿酒酵母()TPS序列一起构建了进化树(图2b)。结果显示龙须菜的4条TPS与TPS1聚在一个簇中,TPS2、TPS3和TSL1分布在外围, 说明龙须菜中4条TPS蛋白均与TPS1的关系较近。再结合Leyman等(2001)对拟南芥中11条TPS的分析结果, 即TPS1—TPS4与TPS1相似度最大, 属于Class I亚家族, 而TPS5-TPS11与TPS2相似度最大, 属于Class II亚家族, 我们推测龙须菜中4条TPS序列属于Class I亚家族。
2.3 龙须菜TPS基因对3种胁迫条件的响应
龙须菜中4条基因对不同胁迫条件的响应不同(图3)。高盐胁迫显著促进了1、2和4的转录表达, 而渗透胁迫则多抑制1、2和3的表达。各基因的表达如下:
1基因的表达模式: 在对照组中,1基因的转录水平基本稳定(>0.05)。在高温胁迫组中,1表达量呈先上升后下降的趋势, 在6 h和12 h 时1基因表达量分别为0 h的1.90倍(>0.05)和0.48倍(<0.05), 但与对照组中相应时间点之间差异不显著。在高盐胁迫组中,1表达量在3 h和6 h时分别是0 h的2.39倍和2.74倍(<0.05), 且与对照组中差异显著。在渗透胁迫组中,1基因表达变化幅度较小, 并且在6 h时低于对照组。
2基因的表达模式: 在对照组中,2基因的表达量随时间的增加而逐渐上升。在高温条件下,2基因表达量在6 h时最高, 但与对照组无显著差异。高盐促进了2基因的表达, 在3、6和12 h时其表达量分别为0 h的7.45、7.19和11.21倍, 但仅在3 h时高于对照组(<0.05)。与1类似, 渗透胁迫条件对2基因表达量影响较小, 仅在12 h时低于对照组(<0.05)。
3基因的表达模式: 对照组中3基因表达变化稳定。高温处理后3基因表达量在6 h时达到最高, 但与对照组差异不显著。除渗透胁迫12 h时3表达量稍有下降之外, 在其余时间点高盐和渗透胁迫处理对3基因表达量均无显著影响。
4基因的表达模式: 在高温及渗透胁迫条件下, 与前面3条基因表达变化不同,4基因在3 h后表达量均下调。且与对照组各时间点无显著差异。而高盐胁迫时,4基因在3 h和6 h时表达量高于对照组。

图2 基于TPS蛋白序列构建的系统进化树
注: a. 藻类TPS; b. 龙须菜和酿酒酵母TPS
2.4 龙须菜TPS1蛋白对3种胁迫条件的响应
龙须菜TPS1蛋白水平变化与1转录变化类似(图4)。在对照组、高温和渗透胁迫组中, TPS1蛋白表达量在48 h内比较稳定, 与对照组之间也无显著差异。而在高盐胁迫组中, TPS1蛋白表达水平缓慢上升, 在48 h时其表达量达到对照组的2.03倍(<0.05)。可见高盐处理可促进龙须菜TPS1转录和蛋白水平的升高。
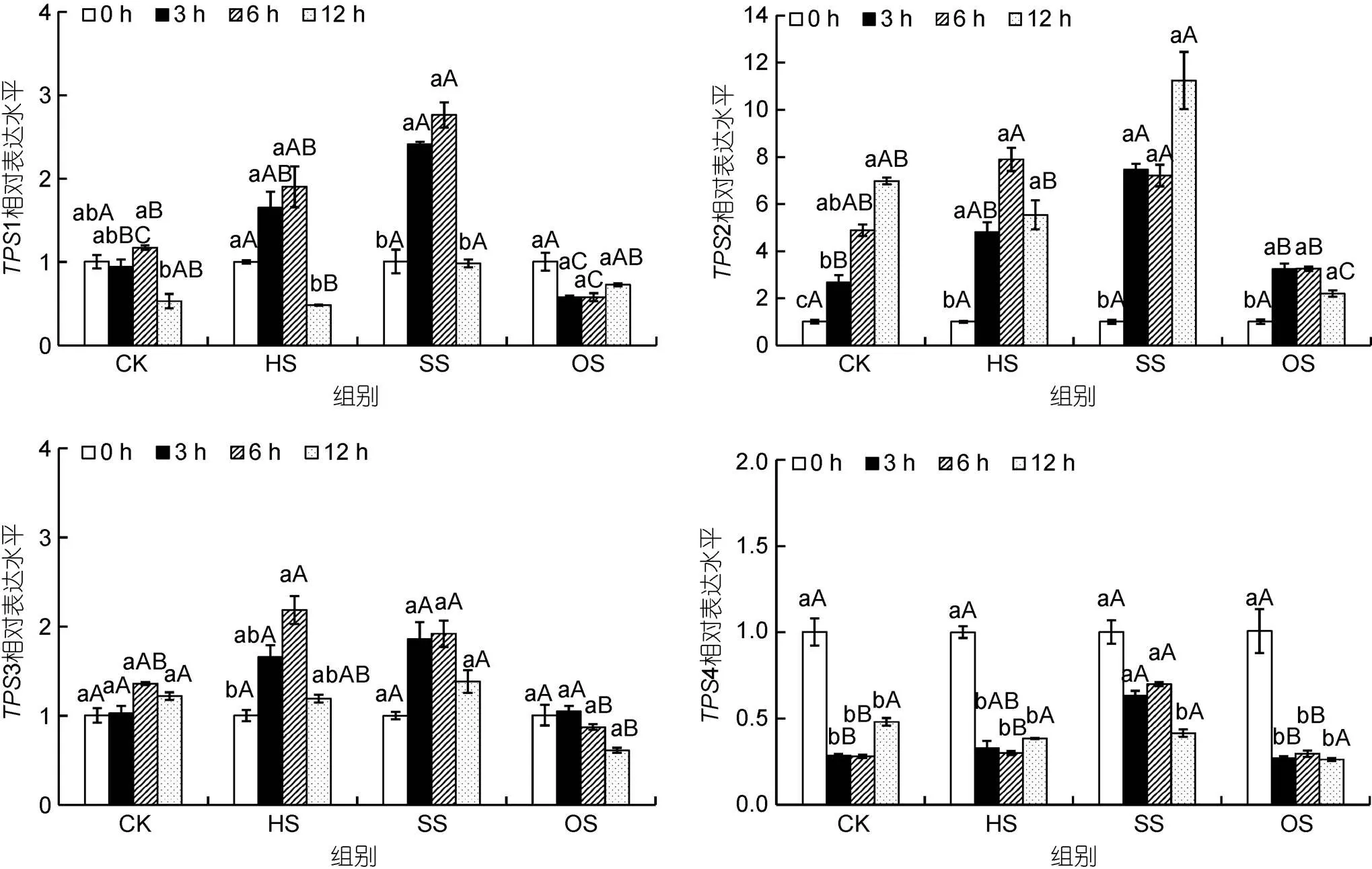
图3 不同胁迫条件对龙须菜TPS基因表达的影响
注: CK. 对照组, HS. 高温组, SS. 高盐组, OS. 渗透胁迫组; 不同小写字母表示同组中不同时间点差异显著(<0.05), 不同大写字母表示同一时间点不同组差异显著(<0.05)。下同
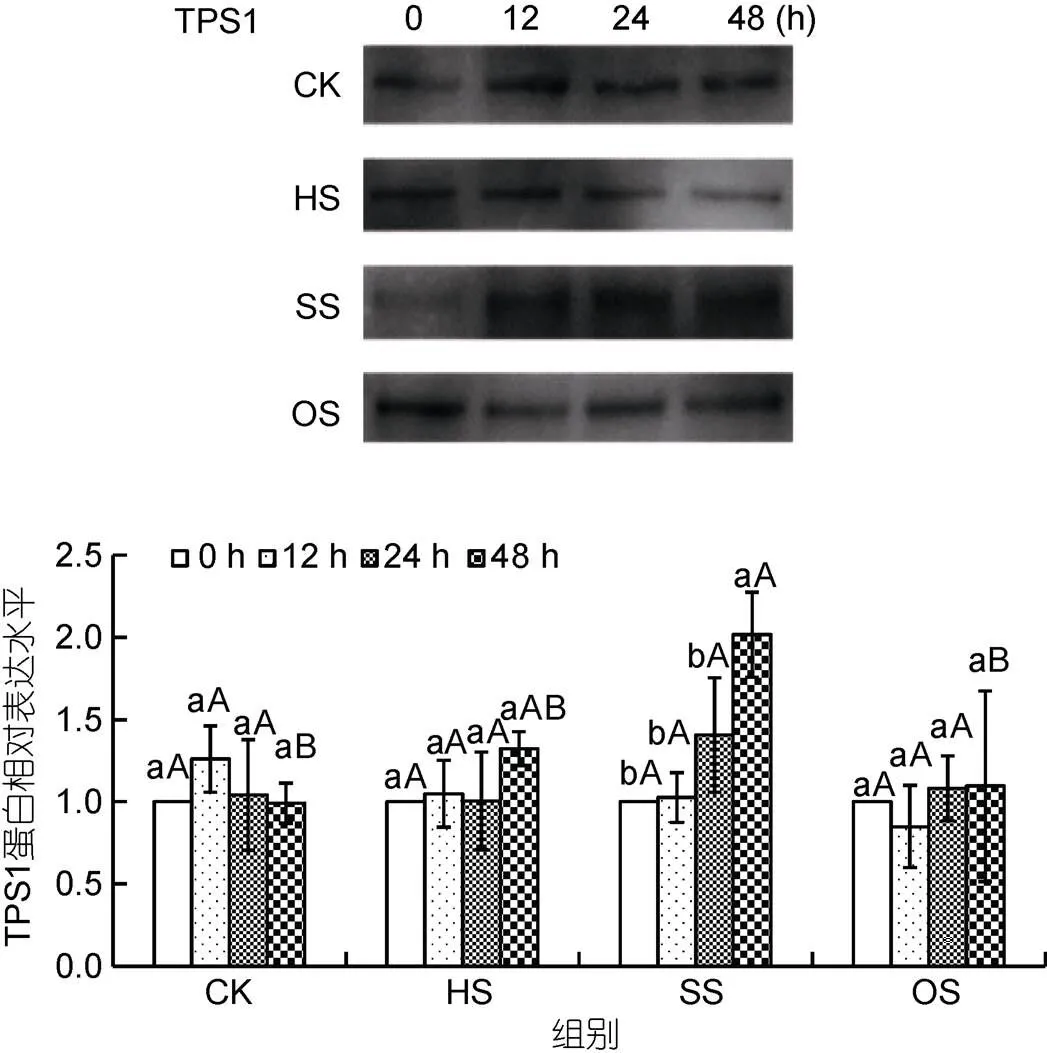
图4 不同胁迫条件对龙须菜TPS1蛋白表达的影响
2.5 龙须菜TPS酶对3种胁迫条件的响应
3种胁迫处理显著影响了龙须菜TPS活性(图5)。在对照组中, 龙须菜TPS活性比较稳定。在高温组中, TPS活性在24 h达到最高(1.28倍,<0.05), 并且高于对照组。在高盐组中, 龙须菜TPS活性在24 h时升高为对照组(24 h)的1.11倍(<0.05), 在48 h时其活性降低至对照组(48 h)的66.34% (<0.05)。在渗透胁迫组中, TPS活性逐渐下降, 且在12—48 h与对照组差异显著。可见, 高温胁迫可以短时促进TPS活性, 高盐胁迫则先促进、后抑制TPS活性, 而渗透胁迫则会显著抑制TPS活性。
3 讨论
海藻糖具有高度的化学稳定性, 是天然双糖中最稳定的, 素有“生命之糖”之称。海藻糖对生物膜、蛋白质和核酸等生物大分子具有非特异的保护作用(Richards, 2002), 其代谢及信号途径在植物生长和抗逆等方面发挥了重要作用。
目前越来越多的全基因组测序工作已完成, 人们在已测序高等植物基因组中发现了庞大的基因家族(Yang, 2012)。根据与酵母1或2的相似性,基因可以被归为Class I和Class Ⅱ两个亚家族(Leyman, 2001)。近年来, 藻类基因序列也相继被报道。Wang等(2010)克隆了包括海带()、条斑紫菜()、坛紫菜等在内的10种大型海藻的基因序列, 并且发现它们在核苷酸和氨基酸组成上具有高度保守性。大型红藻绳状龙须菜和皱波角叉菜基因组中各有4条基因(Collén, 2013; Lee, 2018), 本课题组在龙须菜基因组中也发现了4条基因(Sun, 2018), 且4条基因均属于Class I亚家族。TPS氨基酸序列高度保守, 如龙须菜与绳状龙须菜TPS相似性达99%以上, 而基因序列决定功能, 推测基因在进化过程中功能也高度保守。

图5 不同胁迫条件对龙须菜TPS活性的影响
大量基因家族在高等植物中担负着不同功能, 随着组织和环境的不同而具有不同的表达模式。如毛白杨()中只有10条基因在所有组织及氯化钠、干旱等条件下能够表达; 拟南芥中2和3不表达,4只在根和花中表达, 其余8条基因在根、茎、叶等组织中均能表达(Yang, 2012)。相比于高等植物, 藻类中基因家族成员较少, 但这些基因在藻类的抗逆胁迫中也发挥了重要作用。如失水条件下海带基因表达量在3 h最高, 可达到0 h的300倍(Deng, 2014); 坛紫菜中3条基因对29 °C高温胁迫无应答, 而在高度失水胁迫中发挥了应激调节作用(史健志等, 2015)。本文中1—3 3条龙须菜基因在渗透胁迫下多被抑制, 与海带、坛紫菜不同, 推测其原因可能与海带、坛紫菜本身具有较强的脱水性有关。而对于高温胁迫,1-3表达量虽上升但与对照组差异不显著, 即对高温无显著应答, 该结果与史健志等(2015)的研究结果类似, 可能是由于本文设置的30 °C高温较低的原因。而且, 本文中TPS1蛋白与1基因在应对高温和高盐胁迫时的响应趋势较为类似, 即对高温无明显响应, 而受高盐胁迫的诱导。
在生物体内海藻糖及其代谢物的含量变化与TPS等代谢酶的活性变化密切相关。如受热激处理时金针菇()中TPS和TPP活性升高, 海藻糖酶活性下降, 海藻糖快速积累(Liu, 2016)。在干旱处理14 d的Desf中TPS和TPP活性上升, 同时海藻糖酶活性降低, 海藻糖含量增加(Ilhan, 2015)。与以上结果一致, 本文中TPS活性在高温胁迫24 h时升高, 而海藻糖酶活性降低, 24 h时海藻糖含量开始显著增加(Lv, 2019)。但在高盐和渗透胁迫处理下, TPS活性与海藻糖含量无正相关性, 可能是因为海藻糖合成还受TPP的调控。
4 结论
海藻糖不仅是生物体内碳储存物质, 还可作为保护剂来抵抗不利环境胁迫。相比于大多数高等植物和紫菜, 龙须菜中海藻糖含量十分丰富, 因此海藻糖在龙须菜中可能具有重要的作用。龙须菜中4条基因序列高度保守, 推测为Class I亚家族。在基因转录、蛋白和酶活性水平上, TPS主要对高盐和高温胁迫响应较大, 而对渗透胁迫不敏感或受其抑制, 该结果有助于更深入地了解海藻糖及其代谢酶在藻类抵御非生物胁迫中的作用, 为提高藻类抗逆性提供了理论资料。
史健志, 徐 燕, 纪德华等, 2015. 坛紫菜6-磷酸海藻糖合成酶(TPS)家族基因的克隆及表达特征分析. 水产学报, 39(4): 485—495
吕 燕, 汪芳俊, 林丽春等, 2019. 龙须菜中rbcL和hsp70对高温和植物激素的响应. 水产学报, 43(4): 886—894
孙 鹏, 杜 宇, 吕 燕等, 2019. 龙须菜卤代烷烃脱卤酶基因的转录及原核表达. 水产学报, 43(12): 2468—2475
张学成, 费修绠, 王广策等, 2009. 江蓠属海藻龙须菜的基础研究与大规模栽培. 中国海洋大学学报, 39(5): 947—954
林丽春, 吕 燕, 孙 鹏等, 2019. 龙须菜()中两种分支酸代谢酶对温度和水杨酸的响应及其原核表达研究. 海洋与湖沼, 50(1): 220—227
饶莉萍, 苏文瑾, 刘 意等, 2020. 甘薯苯丙氨酸解氨酶基因IbPAL的克隆与表达分析. 植物科学学报, 38(3): 360—368
Bell W, Sun W N, Hohmann S, 1998. Composition and functional analysis of thetrehalose synthase complex. The Journal of Biological Chemistry, 273(50): 33311—33319
Chang L P, Sui Z H, Fu F, 2014. Relationship between gene expression of UDP-glucose pyrophosphorylase and agar yield in(Rhodophyta). Journal of Applied Phycology, 26(6): 2435—2441
Chen B B, Zou D H, Jiang H, 2015. Elevated CO2exacerbates competition for growth and photosynthesis betweenand. Aquaculture, 443: 49—55
Collén J, Porcel B, Carré W, 2013. Genome structure and metabolic features in the red seaweedshed light on evolution of the Archaeplastida. Proceedings of the National Academy of Sciences of the United States of America, 110(13): 5247—5252
Deng Y Y, Wang X L, Guo H, 2014. A trehalose-6-phosphate synthase gene from(Laminariales, Phaeophyceae). Molecular Biology Reports, 41(1): 529—536
Goddijn O J M, van Dun K, 1999. Trehalose metabolism in plants. Trends in Plant Science, 4(8): 315—319
Hottiger T, Schmutz P, Wiemken A, 1987. Heat-induced accumulation and futile cycling of trehalose in. Journal of bacteriology, 169(12): 5518—5522
Ilhan S, Ozdemir F, Bor M, 2015. Contribution of trehalose biosynthetic pathway to drought stress tolerance ofDesf. Plant Biology, 17(2): 402—407
Jiang H, Liu N N, Liu G L, 2016. Melanin production by a yeast strain XJ5-1 ofisolated from the Taklimakan desert and its role in the yeast survival in stress environments. Extremophiles, 20(4): 567—577
Krasensky J, Broyart C, Rabanal F A, 2014. The redox-sensitive chloroplast trehalose-6-phosphate phosphatase AtTPPD regulates salt stress tolerance. Antioxidants & Redox Signaling, 21(9): 1289—1304
Lee J M, Yang E C, Graf L, 2018. Analysis of the draft genome of the red seaweedprovides insights into genome size evolution in Rhodophyta. Molecular Biology and Evolution, 35(8): 1869—1886
Leyman B, Van Dijck P, Thevelein J M, 2001. An unexpected plethora of trehalose biosynthesis genes in. Trends in Plant Science, 6(11): 510—513
Li H W, Zang B S, Deng X W, 2011.Overexpression of the trehalose-6-phosphate synthase gene1 enhances abiotic stress tolerance in rice. Planta, 234(5): 1007—1018
Liu J H, Shang X D, Liu J Y, 2016. Changes in trehalose content, enzyme activity and gene expression related to trehalose metabolism inunder heat shock. Microbiology, 162(8): 1274—1285
Livak K J, Schmittgen T D, 2001. Analysis of relative gene expression data using real-time quantitative PCR and the 2−ΔΔCTmethod. Methods, 25(4): 402—408
Lv Y, Sun P, Zhang Y Y, 2019. Response of trehalose, its degrading enzyme, sucrose, and floridoside/isofloridoside under abiotic stresses in(Rhodophyta). Journal of Applied Phycology, 31(6): 3861—3869
O’Hara L E, Paul M J, Wingler A, 2013. How do sugars regulate plant growth and development? New insight into the role of trehalose-6-phosphate. Molecular Plant, 6(2): 261—274
Paul M J, Primavesi L F, Jhurreea D, 2008. Trehalose metabolism and signaling. Annual Review of Plant Biology, 59: 417—441
Pramanik M H R, Imai R, 2005. Functional identification of a trehalose 6-phosphate phosphatase gene that is involved in transient induction of trehalose biosynthesis during chilling stress in rice. Plant Molecular Biology, 58(6): 751—762
Richards A B, Krakowka S, Dexter L B, 2002. Trehalose: a review of properties, history of use and human tolerance, and results of multiple safety studies. Food and Chemical Toxicology, 40(7): 871—898
Schluepmann H, Van Dijken A, Aghdasi M, 2004. Trehalose mediated growth inhibition ofseedlings is due to trehalose-6-phosphate accumulation. Plant Physiology, 135(2): 879—890
Singh N K, Gupta D K, Jayaswal P K, 2012. The first draft of the pigeonpea genome sequence. Journal of Plant Biochemistry and Biotechnology, 21(1): 98—112
Sun X, Wu J, Wang G C, 2018. Genomic analyses of unique carbohydrate and phytohormone metabolism in the macroalga(Rhodophyta). BMC Plant Biology, 18(1): 94
Tang B, Wei P, Zhao L N, 2016. Knockdown of five trehalase genes using RNA interference regulates the gene expression of the chitin biosynthesis pathway in. BMC Biotechnology, 16(1): 67
Wahl V, Ponnu J, Schlereth A, 2013. Regulation of flowering by trehalose-6-phosphate signaling in. Science, 339(6120): 704—707
Wang G L, Zhao G, Feng Y B, 2010. Cloning and comparative studies of seaweed trehalose-6-phosphate synthase genes. Marine Drugs, 8(7): 2065—2079
Xie D W, Wang X N, Fu L S, 2015. Identification of the trehalose-6-phosphate synthase gene family in winter wheat and expression analysis under conditions of freezing stress. Journal of Genetics, 94(1): 55—65
Yang H L, Liu Y J, Wang C L, 2012. Molecular evolution of trehalose-6-phosphate synthase (TPS) gene family in,and rice. PLoS One, 7(8): e42438
Zang B S, Li H W, Li W J, 2011. Analysis of trehalose-6-phosphate synthase (TPS) gene family suggests the formation of TPS complexes in rice. Plant Molecular Biology, 76(6): 507—522
RESPONSE OF TREHALOSE-6-PHOSPHATE SYNTHASE (TPS) TO ABIOTIC STRESS IN
ZHANG Ying-Ying, LYU Yan, XUAN Wen-Yan, ZHANG Xiao-Qian, XU Nian-Jun, SUN Xue
(School of Marine Sciences, Ningbo University, Key Laboratory of Marine Biotechnology of Zhejiang Province, Ningbo 315211, China)
The non-reducing disaccharide trehalose and its metabolites are signaling molecules that regulate the growth, development, and stress response. In this paper, the responses of trehalose synthase (TPS) to high-temperature, high-salinity, and osmotic stresses were investigated at three levels of gene transcription, protein, and enzyme activity of seaweed. Four TPS sequences ofcontained both TPS-family conserved domains (Glyco-Transf-20) and TPP-family conserved domains (Trehalose-PPase), and belong to the Class I subfamily of TPS. At the transcriptional level, high-salinity stress mainly promoted the expression of1,2,and4, while1,2,and3 were almost suppressed under osmotic stress. At the protein level, TPS1 was promoted a 2.03-fold increment at 48 h under high-salinity compared with the control. TPS activity was increased at 24 h under high-temperature and high-salinity stresses, and was inhibited at 48 h under high-salinity stress and at 24—48 h under osmotic stress. In summary, the above results indicate that TPS was involved in the response of.to high-temperature and high-salinity stresses, but was not sensitive to osmotic stress. This study will provide a reference for improving the anti-adversity or breeding the stress-resistant varieties of.
; trehalose; trehalose-6-phosphate synthase; abiotic stress
* 国家重点研发计划项目, 2018YFD0901502号; 国家自然科学基金项目, 31672674号; 浙江省自然科学基金项目, LY19C190003号, LQ20C190002号; 宁波市科技局项目, 2019B10009号。张莹莹, 硕士研究生, E-mail: 1113973798@qq.com
孙 雪, 博士, 研究员, E-mail: sunxue@nbu.edu.cn
2020-07-31,
2020-09-25
S968.43
10.11693/hyhz20200700225
