基于高通量测序技术解析鲣鱼(Katsuwonus pelamis)鱼油和鱼白调控肠道菌群结构作用*
2021-05-26李菁菁张旨轩王子言霍春恒石秋月韩姣姣苏秀榕
李菁菁 张旨轩 王子言 刘 岩 霍春恒 石秋月 陈 菊 韩姣姣 苏秀榕
基于高通量测序技术解析鲣鱼()鱼油和鱼白调控肠道菌群结构作用*
李菁菁1, 2张旨轩1, 3王子言1, 3刘 岩1, 3霍春恒1, 3石秋月1, 2陈 菊1, 2韩姣姣1, 3苏秀榕1, 3①
(1. 农产品质量安全危害因子与风险防控国家重点实验室 宁波 315211; 2. 宁波大学食品与药学学院 宁波 315832; 3. 宁波大学海洋学院 宁波 315832)
本研究利用高通量测序技术分析小鼠喂食鲣鱼()鱼油和鱼白酶解液后肠道微生物的多样性、群落组成以及结构的变化, 探讨高蛋白、高脂肪饮食对人类健康的影响。研究结果显示: 喂食鱼油组小鼠的肠道微生物丰富且多样。在门水平上, 对照组和鱼油组的优势菌门为拟杆菌门(Bacteroidetes); 鱼白组的优势菌门为厚壁菌门(Firmicutes)。在科水平上, 对照组和鱼油组中的优势菌科为Muribaculaceae; 鱼白组中的优势菌科为毛螺菌科(Lachnospiraceae)。在属水平上, 对照组和鱼油组中的优势菌属为; 鱼白组中的优势菌为; 对照组、鱼油组和鱼白组小鼠的肠道微生物群落中瘤胃球菌属()和拟杆菌属()等丰度较高。在种水平上, 对照组和鱼油组中的优势菌为; 鱼白组中的优势菌为解糖梭菌()。研究结果证明鲣鱼鱼油和鱼白可以调节菌群结构和组成, 增加肠道有益菌, 减少病原菌的丰度等。
鲣鱼()鱼油; 鱼白酶解液; 高通量测序; 肠道菌群; 益生菌
鲣鱼()属于辐鳍鱼纲(Actinopterygii)、鲈形总目(Percomorpha)、鲭亚目(Scombroidei)、鲭科(Scombridae)、鲣属(), 是金枪鱼的一种。其鱼油是鱼体内肝油、体油和脑油在内的所有油脂类物质的总称(张云竹等, 2012), 可作为一种功能食品, 富含二十二碳六烯酸(DHA), 具有提高人体免疫力、调节血脂、预防老年痴呆、减肥和预防脂肪肝等功能(杨洋等, 2010; 李启艳等, 2016; 谢珍等, 2017)。Cui等(2017)证实了鲣鱼鱼油改善高脂小鼠肠道菌群结构, 可有效预防肥胖。鱼白是鱼的精巢, 富含蛋白质, 其中鱼精蛋白较为丰富, 它是自然界中最简单的一种碱性蛋白质, 不仅具有广谱抑菌活性(傅红霞等, 2003), 还具有止血、促消化、降血压和抑制肿瘤生长等生理功能(杜荣茂等, 2003)。研究表明, 鱼精蛋白中含有丰富的脱氧核糖核酸(DNA), 是提取DNA较好的材料(王建, 2003)。鱼精蛋白水解时能产生85%左右的精氨酸(谢安等, 2016)。在医学方面, 精氨酸具有增强免疫力、改善肝功能、提高精力等作用, 而且是治疗男性疾病较好的保健食品(雷晓青等, 2009)。不饱和脂肪和功能蛋白质均是维持人类生命不可缺少的物质, 除了能够通过代谢物调控各类细胞因子提高免疫力外, 还可能对肠道微生物的结构产生影响, 对人体健康也起到一定作用。肠道是人体重要的消化器官, 也是人体最大的排毒器官, 也是微生物生长发育的基质, 具有维持身体正常免疫功能和防御作用(翟齐啸等, 2013)。鉴于此, 本文基于高通量测序技术, 研究了鲣鱼鱼油和鱼白对小鼠肠道菌群的作用, 为预防疾病、增强体质、合理规划饮食提供理论依据。
1 材料与方法
1.1 材料
鲣鱼鱼油和鱼白取自宁波今日食品有限公司。ICR雄性小鼠和常规饲料购自浙江省实验动物中心[SCXK(浙江)2014-0001(编号: 1605200003)]。碱性蛋白酶(20万U/g)、动物蛋白水解酶(20万U/g)、胰蛋白酶(4000 U/g)、风味酶(20万U/g)、中性蛋白酶(20万U/g), 均购自广西南宁庞博生物工程有限公司。E.Z.N.A.® Soil试剂盒, 购自Omega生物公司。基质辅助激光解离飞行时间质谱仪(MALDI-TOF/TOF 5800, 美国AB SCIEX公司)。实验用化学试剂购自国药集团; 气质联用仪购自美国Agilent公司和北京普析通用仪器有限责任公司。鱼白酶解液为实验室自制。
1.2 方法
1.2.1 酶解鱼白 经过多次实验确定, 鱼白酶解以温度55 °C, 酶解时间5 h, 料液比1︰4, 加酶量2% (碱性蛋白酶:风味蛋白酶 = 2︰1)的条件进行酶解。酶解完成后, 在100 °C灭活10 min, 再将溶液以4000 r/min的条件离心10 min。然后除去沉淀物, 超滤截留分子量小于2 kDa的上清。利用冷冻干燥机将上清冻干24 h制备多肽粉。
1.2.2 多肽组成分析 将40 μL的上清液, 稀释20倍, 取出1 μL样品, 点在5800靶板上, 待干燥后再将1 μL CHCA基质添加到样品点上进行结晶干燥, 用MALDI TOF/TOF 5800质谱仪分析结晶的样品以获取质谱。离子源加速电压为20 kV, N2激光器, 337 nm的激光波长, 能量为5800, 离子延迟提取时间为390 ns, 质谱信号单次扫描累加2000次, 使用多肽校准品(Peptide II standard kit)离子峰校正(500—3000 m/z), 质量扫描范围500—3000 u。MALDI-TOF MS/MS串联质谱结果用本地MASCOT软件查询NCBI nr数据库进行检索。
1.2.3 鱼白基本营养成分
(1) 水分含量测定采用直接干燥法: 称取适量剪碎样品, 置于100 °C下烘干, 直至重量不再变化即可。
(2)灰分含量测定采用550 °C灰化法: 称取适量剪碎样品, 置于550 °C下灰化, 直至重量不再变化即可。
(3) 蛋白质含量测定采用凯氏定氮仪: 即先用浓硫酸消化适量的样品, 再通过凯式定氮仪标定含氮量, 计算蛋白质含量。
(4) 脂肪含量测定采用索氏抽提法: 利用石油醚萃取样品中的脂肪, 计算脂肪含量。
1.2.4 鱼油中脂肪酸测定
(1) 脂肪酸甲酯化: 取鱼油2 mL, 加入1 mL 2 mol/L NaOH-CH3OH溶液进行皂化, 漩涡振荡10 min后50 °C水浴5 min, 冷却至室温, 加入2 mL 2 mol/L HCl-CH3OH溶液, 充分振荡10 min, 于50 °C水浴5 min, 进行甲酯化。取上清, 加入2 mL蒸馏水洗净并去除水层, 用滴管吸出正己烷层, 加入无水硫酸钠脱水, 待气相色谱-质谱联用(GC-MS)分析。
(2) 气相色谱条件: 色谱柱采用DB-WAX聚乙二醇气相毛细柱(60.0 m×250 μm×0.25 μm); 载气为高纯氦(纯度99.99%), 流速1 mL/min; 进样口温度250 °C; 升温程序: 50 °C保持1 min后, 以25 °C/min升至200 °C, 以3 °C/min升至230 °C保持15 min, 再以3 °C/min升至250 °C; 采用不分流模式; 进样量为1 μL。
(3) 质谱条件: 离子源: 电子轰击源(EI); 电子能量: 70 eV; 离子源温度230 °C, 接口温度250 °C。监测方式为低速全扫描, 质量扫描范围为45—500 u, 溶剂延迟5 min。
1.2.5 动物实验 适应两周后, 36只10周龄的ICR雄性小鼠(22±1.0 g), 随机分为3组, 每组12只: (1) 对照组: 每天灌胃等量生理盐水; (2) 鱼油组: 每天按照600 mg/(kg·d)的剂量灌胃鱼油; (3) 鱼白组: 每天按照400 mg/(kg·d)的剂量灌胃鱼白酶解液; 所有的动物实验均在宁波大学实验动物中心[SYXK(ZHE 2008-0110)]完成。动物实验及护理程序都严格遵循宁波大学实验动物中心(隶属于浙江实验动物服务平台)制定的指导方针。控制室内温度(23±1) °C和湿度(55%±10%), 循环12 h光照/黑暗(灯光)。每天观察和记录动物的行为活动。40 d后, 将所有小鼠转移到新的无菌笼中(每笼4只小鼠), 2 h后收集粪便, 保存于–80 °C以备后续实验。
1.2.6 肠道微生物的检测
(1) 总DNA提取: 按照E.Z.N.A.® Soil试剂盒说明书从小鼠粪便样品中提取出基因组DNA, 其浓度经NanoDrop 2000测定(Lu, 2018)。
(2) 16S rRNA基因V3—V4区PCR扩增及高通量测序: 基因组样品由DNA Qubit 2.0进行精确定量后, 使用细菌16S rRNA基因的V3—V4区设计引物(正向引物为5′-ACTCCTACGGGAGGCAGCAG-3′, 反向引物为5′-GGACTCGTGGGTCTCTAAT-3′)进行扩增。扩增结束后, 利用1%琼脂糖凝胶电泳将得到的PCR产物进行检测并切胶回收, 精确定量后由Illumina MiSeq进行测序。
(3) 数据分析: 将测序的数据进行拼接、过滤和剔除嵌合体, 低质量的序列被舍弃以得到优质序列进行精准分析, 优化数据在相似度为97%的水平下用于操作分类单元(Operational Taxonomic Unit, OTU)进行生物信息分析、多样性分析以及物种组成分析。根据OTU聚类分析结果利用GraphPad Prism7软件和联川生物云平台软件绘制各组小鼠肠道微生物的Alpha多样性图、群落结构图、UpSet图以及PCoA图。
2 结果
2.1 鱼白优势多肽
利用MALDI-TOF/TOF, 在鱼白酶解液中共检测出735个峰, 其中母离子m/z 580.3509的信号强度最高, m/z 568.0779的信号强度次之, 其余母离子信号强度相对偏低。因此可以认为酶解液中分子质量为580.35和568.08多肽的含量占主导地位。将较强的质谱峰进行二级质谱分析, 对得到的结果进行谱库比对, 得到5个优势多肽(表1)。
表1 优势多肽的鉴定
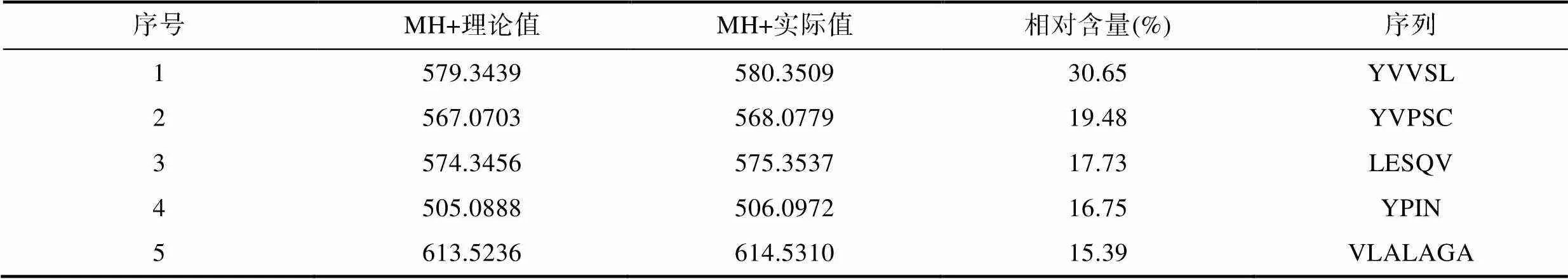
Tab.1 Identification of superior peptides
2.2 鱼白营养成分
鱼白中水分含量较高, 为73.28%±0.73%, 蛋白含量较为丰富, 以湿重计为15.37%±0.05%, 除去水分后蛋白含量高达77.90%±0.35%。
2.3 鱼油脂肪酸组成
通过气相色谱-质谱联用(GC-MS)检测鱼油脂肪酸组成。鱼油的不饱和脂肪酸为72.04%, 其中DHA含量为25.48%, EPA含量为5.36%(表2)。
表2 鱼油的脂肪酸构成

Tab.2 Fatty acid composition of tuna oil
2.4 肠道菌群多样性
通过16S rRNA基因的V3—V4区测序发现, 与对照组相比, 鱼油组中鉴定出的肠道微生物种类较多, 鱼白组种类较少。采用UpSet图研究了鱼油和鱼白对小鼠肠道菌群组成的调节, 比较各组间独有和共有的OTU数目。对照组中共检测出1881个OTUs, 特有401个; 鱼油组中共检测出2358个OTUs, 特有892个; 鱼白组中共检测出1231个OTUs, 特有279个。对照组、鱼油组和鱼白组共同拥有的OTUs为562个, 占三组总OTUs数的17.35%(图1)。

图1 各组肠道菌群检测出的OTU数量
注: *.<0.05; **.<0.01
2.5 肠道菌群的结构特点
与对照组相比, 鱼油组中的Chao 1指数(2634.92±87.64,<0.01)和Shannon指数(8.45±0.61,>0.05)升高, 说明鱼油能增加肠道菌群的丰富度; 鱼白组中的Chao 1值(1758.14±115.09,<0.01)和Shannon值(6.02±0.21,<0.01)显著降低, 说明鱼精蛋白显著降低了肠道菌群中物种的丰富度以及多样性(图2a)。
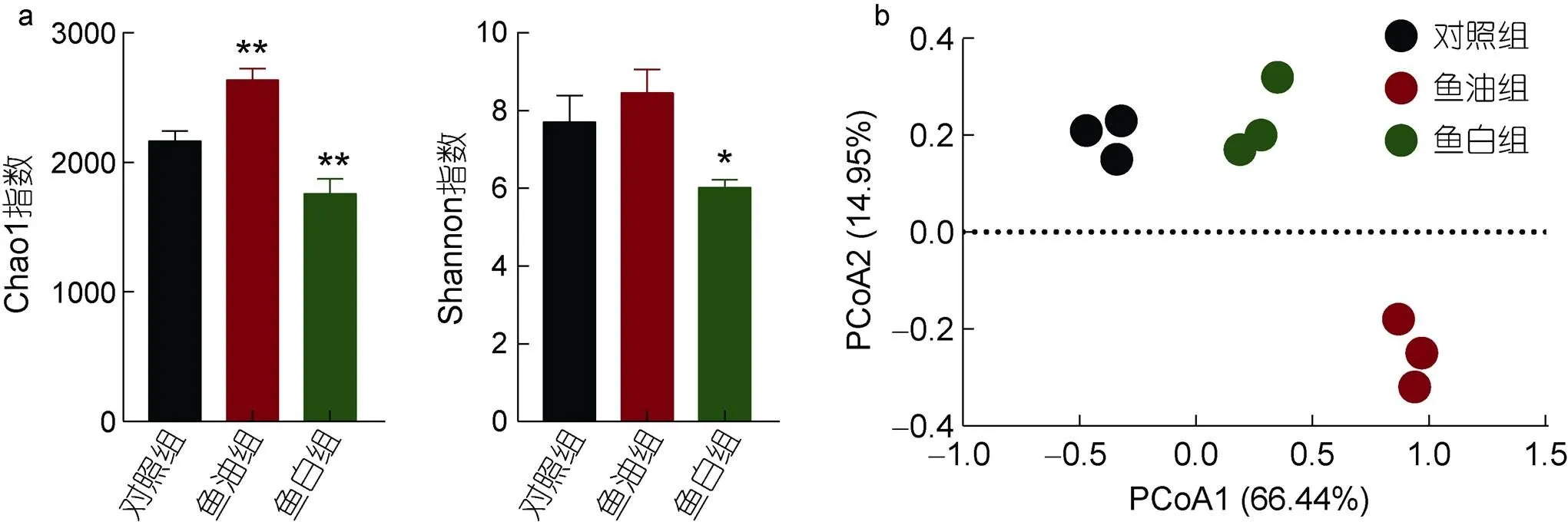
图2 小鼠肠道菌群Alpha多样性和PCoA分析
Fig 2 The gut microbiota alpha diversity and PCoA analysis
注: a. α多样性; b. PCoA分析; *.<0.05; **.<0.01
通过加权主坐标分析(Weighted UniFrac PCoA)展示各组间微生物群落结构的差异, 鱼油组和鱼白组均偏离对照组, 表明饮食鱼油和鱼白都会使小鼠肠道菌群的结构发生一定程度的改变(图2b)。
2.6 肠道菌群的组成特点
与对照组相比, 在门水平上鱼油组小鼠的厚壁菌门(Firmicutes)和变形菌门(Proteobacteria)的丰度分别从19.57%±1.86%和0.39%±0.34%增加到30.05%±2.01%和1.59%±0.17% (<0.01), 拟杆菌门(Bacteroidetes)的丰度从62.95%±2.36%下降至49.92%±1.45% (<0.01); 鱼白组的厚壁菌门和变形菌门的丰度分别从19.57%±1.86%和0.39%±0.34%增加到74.37%±2.25%和3.56%±0.56% (<0.01), 拟杆菌门的丰度从62.95%±2.36%下降至13.57%±3.27% (<0.01)(图3)。
与对照组相比, 鱼油组和鱼白组中的理研菌科(Rikenellaceae)、毛螺菌科(Lachnospiraceae)、瘤胃菌科(Ruminococcaceae)和螺旋杆菌科(Helicobacteraceae)的丰度相对增加, 而Muribaculaceae和乳杆菌科(Lactobacillaceae)的丰度则降低。对照组和鱼油组中的Muribaculaceae丰度最高, 分别为58.22%±1.85%和41.62%±1.98%, 鱼精蛋白组小鼠中丰度最大的菌科是毛螺菌科, 为67.62%±2.17%(图3)。
对照组的优势菌属为(59.04%±1.45%)、乳杆菌属(, 8.34%±0.55%)、(4.01%±1.01%)和拟杆菌属(, 2.70%±0.71%)等。与对照组相比, 鱼油组降低了(41.09%±1.06%,<0.01)和乳杆菌属(4.41%±0.85%,<0.01)的丰度, 增加了拟杆菌属(5.07%±0.83%,<0.05)和(5.65%±0.67%,<0.01)的丰度。鱼白组中(10.34%±1.12%,<0.01)和乳杆菌属(, 0.64%±0.14%,<0.01)丰度显著降低,(50.84%±0.47%,<0.01)、(7.25%±0.31%,<0.01)、瘤胃球菌属(, 1.87%±0.13%,<0.01)和(5.52%±0.34%,<0.01)丰度显著增加(图4)。
在种水平上, 对照组的优势菌为(59.15%±1.62%)和动物乳杆菌(, 3.51%±1.40%); 鱼油组中(41.06%±1.92%)和(5.34%±0.49%)为优势菌,(41.06%±1.92%,<0.01)与对照组相比丰度显著降低; 鱼白组中的优势菌为(10.85%±0.97%)(8.21%±1.33%)(9.41%±1.41%)和解糖梭菌(, 38.94%±1.60%), 与对照组相比,丰度显著降低,和解糖梭菌显著增加(图5)。
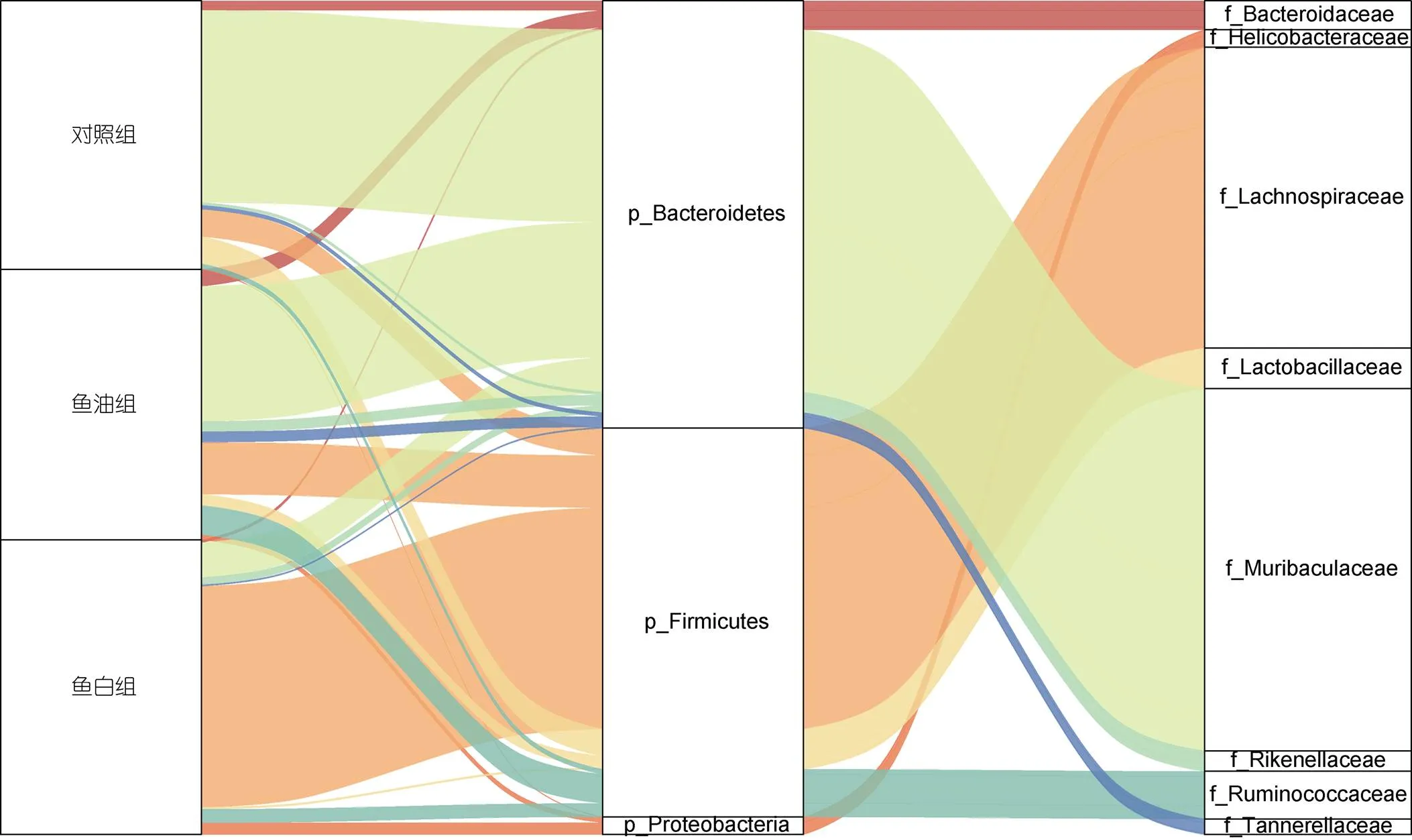
图3 小鼠肠道菌群门水平和科水平变化趋势
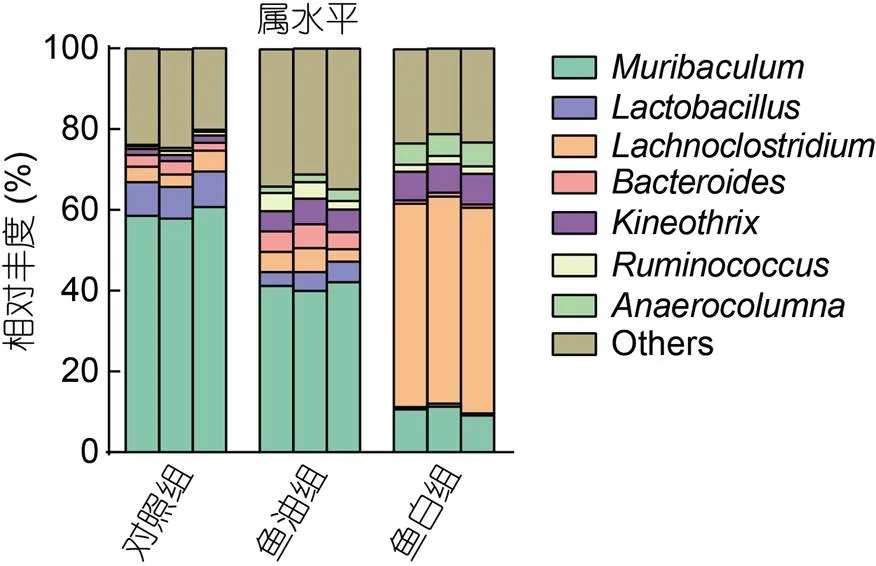
图4 小鼠肠道菌群属水平变化趋势
3 讨论
Alpha多样性是指一个群落内物种的个数以及物种的分布, 常用的度量标准包括Chao 1、Shannon、ACE、Simpson、Coverage, 其中Chao 1指数和Shannon指数用来评价肠道微生物群落的物种丰富度和多样性, Chao 1指数与微生物群落丰富度成正相关, Shannon指数与群落多样性成正相关(Grice, 2009)。本实验中鱼油组的OTU数量、Chao 1指数和Shannon指数增加, 表明饮食鱼油增加了肠道菌群的多样性和丰富度; 主坐标分析(PCoA)是一种研究数据相似性或差异性的可视化方法, 可通过多变量统计学方法PCoA分析, 直观显示不同环境样品中微生物进化上的相似性及差异性。PCoA分析显示饮食鱼油和鱼白会引起小鼠肠道微生物的结构发生变化。
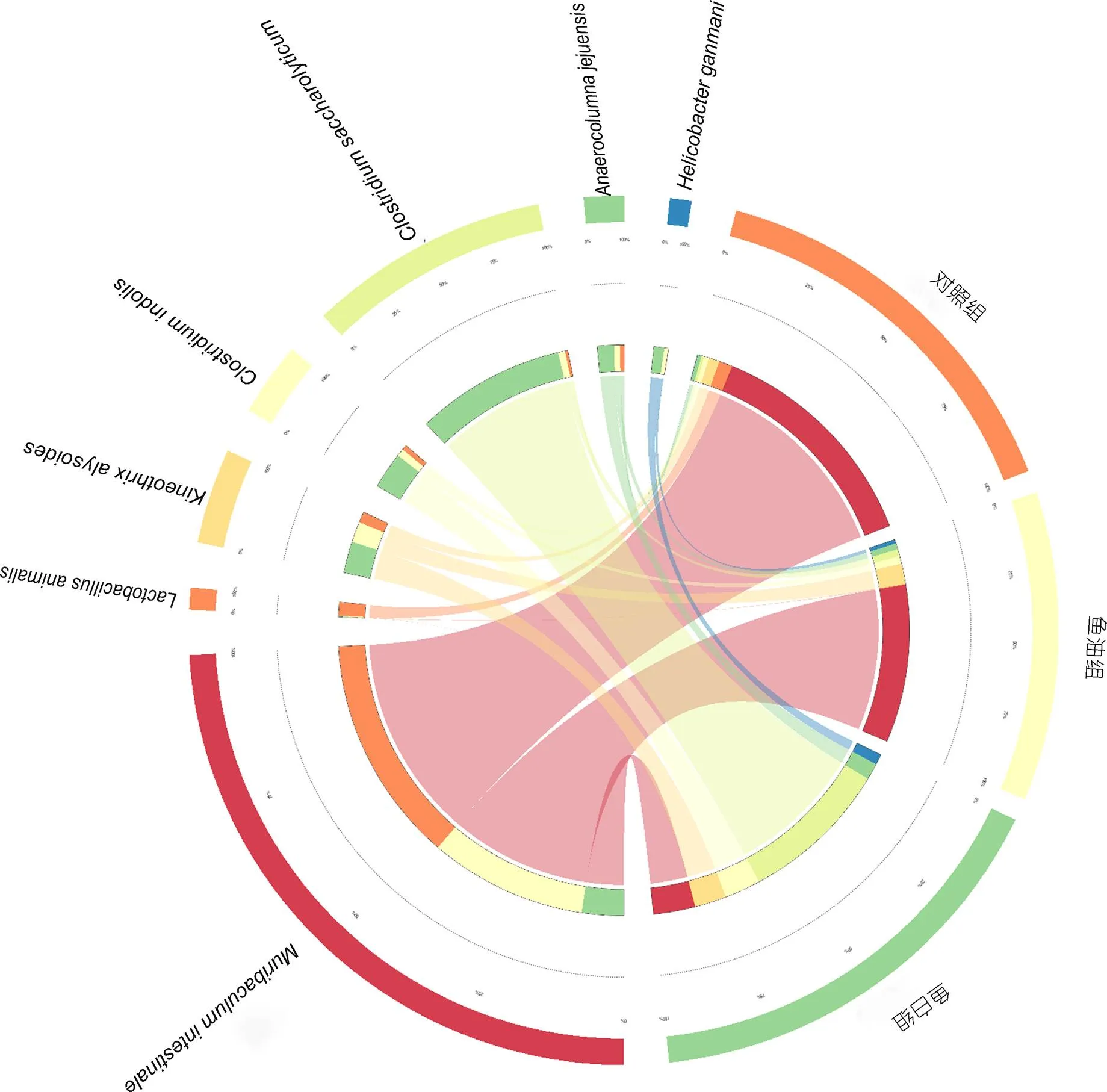
图5 小鼠肠道菌群种水平分布
实验结果显示, 鱼油增加了小鼠肠道的厚壁菌门、瘤胃菌科、拟杆菌属和解糖梭菌的丰度。有研究证明厚壁菌门可以通过调节T细胞调控的IL-10来改善肠道黏膜炎症, 还具有分解纤维素、产生挥发性脂肪酸等功能来提高宿主的营养利用率, 维持肠道微生物的生态平衡(Hooper, 2004; Sears, 2005; Mcdermott, 2013)。瘤胃菌、拟杆菌和梭菌是肠道短链脂肪酸(short chain fatty acids, SCFAs)的生产者。有研究表明, SCFAs通过降低肝脏中诱导型一氧化氮合酶的表达, 促进褪黑激素的合成, 表达抗氧化活性(Jin, 2015)。研究表明, 肠道微生物群通过产生SCFAs对人体产生有益作用, SCFAs的缺乏与肥胖等疾病有关(Greetham, 2004; Zhao, 2018)。SCFAs会被吸收到血液中进入肝脏, 并在肝脏的能量代谢中发挥作用(Zhong, 2015)。这些数据表明, 产生SCFAs的肠道菌群可通过减轻炎症、保护黏膜免受病原体的损伤而使宿主受益, 并且可以通过减少肠内毒素的分泌而缓解因此导致的肥胖、胰岛素抵抗和炎症(Maslowski, 2009; De Filippo, 2010)。因此, 饮食鱼油具有预防肥胖、减少肠内毒素的分泌、减轻炎症反应和抗氧化等作用而对人体健康产生益处。
鱼白质地柔软细腻, 含有大量的鱼精蛋白, 有益于身体健康(郝海燕等, 2009)。与对照组相比, 鱼白组中的毛螺菌科丰度显著升高, 在种水平上,显著降低,和解糖梭菌显著增加。有研究表明毛螺菌科可以将复杂的多糖分解为乙酸、丁酸和丙酸, 这些SCFAs调节细胞因子的产生, 在炎症反应和调节免疫系统中发挥作用(李梦寒等, 2020)。研究表明,属于革兰氏阴性无芽孢厌氧菌的紫单胞菌属, 在一些胃肠道疾病如大肠肿瘤和胃癌等检出增加(张博芬等, 1998; 朱晓敏等, 2005)。属于家族, 是人类肠道微生物群中最丰富的家族之一, 它含有许多已知的植物降解物和大多数丁酸产生菌(Haas, 2017)。丁酸属于肠道短链脂肪酸, 与免疫稳态、预防代谢性疾病以及减少抑郁有关(Sanna, 2019; Valles-Colomer, 2019)。研究表明,调节肠道菌群, 可能对小鼠产生抗焦虑作用(Zhou, 2016)。解糖梭菌在ATP和Mg2+的反应中, 催化O-5处核糖的磷酸化, 可以将生成的D-核糖-5-磷酸酯用于核苷酸、组氨酸和色氨酸的合成, 或用作戊糖磷酸途径的组成部分。因此, 饮食鱼白可以调节肠道微生物群的变化而有益于人体健康。
4 结论
通过研究鱼油和鱼白对小鼠肠道微生物的多样性以及群落组成的作用, 发现鲣鱼鱼油和鱼白含有的多不饱和脂肪酸(尤其是DHA)、多肽(YVVSL和YVPSC等)具有明显增加肠道益生菌的作用, 可以调节肠道菌群结构和组成, 增加肠道、、和数量, 改变肠道微生物多样性以及群落组成结构, 减少病原菌丰度, 从而有益于人体健康。
王 建, 2003. 从海鱼鱼白中提取核酸. 无锡轻工大学学报, 22(2): 71—74
李启艳, 谢强胜, 刁飞燕等, 2016. 鱼油的化学成分及其药理活性研究进展. 药物分析杂志, 36(7): 1157—1161
张博芬, 刘文新, 朱晓敏等, 1998. 胃癌患者胃粘膜微生物群改变的初步研究. 中国微生态学杂志, 10(6): 339—341
郝海燕, 沙爱龙, 2009. 鱼精的研究进展. 生命科学仪器, 8(2): 11—14
谢 安, 魏 蔚, 2016. 鱼精蛋白的应用现状及存在的问题. 中国胸心血管外科临床杂志, 23(1): 78—82
谢 珍, 康 桦, 何立成等, 2017. 深海鱼油对高脂血症模型大鼠血脂的影响及机制探讨. 中国临床药理学与治疗学, 22(8): 870—874
雷晓青, 吴伟宗, 方洛云等, 2009. 精氨酸营养生理功能研究新进展. 中国畜牧杂志, 45(3): 46—49
翟齐啸, 田丰伟, 王 刚等, 2013. 肠道微生物与人体健康的研究进展. 食品科学, 34(15): 337—341
Cui C, Li Y, Gao H, 2017. Modulation of the gut microbiota by the mixture of fish oil and krill oil in high-fat diet-induced obesity mice. PLoS One, 12(10): e0186216
De Filippo C, Cavalieri D, Paola M D, 2010. Impact of diet in shaping gut microbiota revealed by a comparative study in children from Europe and rural Africa. Proceedings of the National Academy of Sciences of the United States of America, 107(33): 14691—14696
Greetham H L, Gibson G R, Giffard C, 2004.gen. nov., sp. nov., isolated from canine feces. Anaerobe, 10(5): 301—307
Grice E A, Kong H H, Conlan S, 2009. Topographical and temporal diversity of the human skin microbiome. Science, 324(5931): 1190—1192
Haas K N, Blanchard J L, 2017., gen. nov., sp. nov., a saccharolytic butyrate-producer within the family. International Journal of Systematic and Evolutionary Microbiology, 67(2): 402—410
Hooper L V, 2004. Bacterial contributions to mammalian gut development. Trends in Microbiology, 12(3): 129—134
Jin C J, Sellmann C, Engstler A J, 2015. Supplementation of sodium butyrate protects mice from the development of non-alcoholic steatohepatitis (NASH). British Journal of Nutrition, 114(11): 1745—1755
Lu C Y, Sun T T, Li Y Y, 2018. Microbial diversity and composition in different gut locations of hyperlipidemic mice receiving krill oil. Applied Microbiology and Biotechnology, 102(1): 355—366
Maslowski K M, Vieira A T, Ng A, 2009. Regulation of inflammatory responses by gut microbiota and chemoattractant receptor GPR43. Nature, 461(7268): 1282—1286
Mcdermott A J, Huffnagle G B, 2013. The microbiome and regulation of mucosal immunity. Immunology, 142(1): 24—31
Sanna S, van Zuydam N R, Mahajan A, 2019. Causal relationships among the gut microbiome, short-chain fatty acids and metabolic diseases. Nature Genetics, 51(4): 600—605
Sears C L, 2005. A dynamic partnership: celebrating our gut flora. Anaerobe, 11(5): 247—251
Valles-Colomer M, Falony G, Darzi Y, 2019. The neuroactive potential of the human gut microbiota in quality of life and depression. Nature Microbiology, 4(4): 623—632
Zhao L P, Zhang F, Ding X Y, 2018. Gut bacteria selectively promoted by dietary fibers alleviate type 2 diabetes. Science, 359(6380): 1151—1156
Zhong Y D, Nyman M, Fåk F, 2015. Modulation of gut microbiota in rats fed high-fat diets by processing whole-grain barley to barley malt. Molecular Nutrition Food Research, 59(10): 2066—2076
Zhou D R, Zhang H L, Bai Z M, 2016. Exposure to soil, house dust and decaying plants increases gut microbial diversity and decreases serum immunoglobulin E levels in BALB/c mice. Environmental Microbiology, 18(5): 1326—1337
REGULATION EFFECT OF TUNA () FISH OIL AND FISH SPERM ON GUT MICROBIOTA STRUCTURE
LI Jing-Jing1, 2, ZHANG Zhi-Xuan1, 3, WANG Zi-Yan1, 3, LIU Yan1, 3, HUO Chun-Heng1, 3, SHI Qiu-Yue1, 2, CHEN Ju1, 2, HAN Jiao-Jiao1, 3, SU Xiu-Rong1, 3
(1. State Key Laboratory for Managing Biotic and Chemical Threats to the Quality and Safety of Agro-products, Ningbo University,Ningbo 315211, China; 2. College of Food and Pharmaceutical Sciences, Ningbo University, Ningbo 315832, China; 3. School of Marine Science, Ningbo University, Ningbo 315832, China)
High-throughput sequencing technology was used to analyze the diversity, community composition, and structure of gut microbes in mice fed with tuna fish oil and fish sperm enzymatic hydrolysis solution. Based on the changes of the gut microbes, the impact of high-protein and high-fat diets on human health was discussed. The results show that the gut microbes of the mice fed with the fish oil group were rich and diverse. At the phylum level, the predominant phylum of the control group and fish oil group was Bacteroidetes; the predominant phylum of the fish sperm group was Firmicutes. At the family level, the dominant family in the control group and fish oil group was Muribaculaceae; the dominant family in the fish sperm group was Lachnospiraceae. At the genus level, the predominant genus in the control group and fish oil group was; the predominant genus in the fish sperm group was; the intestinal microbial community of mice in the control group, fish oil group, and fish sperm group also includedand. At the species level, the dominant bacteria in the control group and fish oil group was; the dominant bacteria in the fish sperm group was. It was determined that tuna fish oil and fish sperm can regulate the structure and composition of the gut microbes, increase the gut beneficial bacteria, and reduce the abundance of pathogenic bacteria, etc.
tuna fish oil; fish sperm enzymatic hydrolysis solution; high-throughput sequencing; gut microbiota; probiotics
* 国家海洋经济创新发展区域示范项目, 20161140号。李菁菁, 硕士研究生, E-mail: 927869621@qq.com
苏秀榕, 博士生导师, 教授, E-mail: suxiurong@nbu.edu.cn
2020-09-30,
2020-12-22
Q93
10.11693/hyhz20200900271
