原子荧光光谱(AFS)和石墨炉原子吸收光谱(GFAAS)法测定富硒粮食中硒含量
2021-05-25蒋越华秦玉燕甘志勇
李 鸿 蒋越华 秦玉燕 甘志勇*
(1.广西壮族自治区亚热带作物研究所,南宁 530002;2.农业农村部农产品质量安全风险评估实验室(南宁),南宁 530002;3.农业农村部亚热带果品蔬菜质量监督检验测试中心,南宁 530002)
前言
硒是人体必需微量元素。20世纪50 年代,由于我国先后发生因人体严重缺硒而导致的克山病、大骨节病及牲畜所患的白肌病,也发生人体长期过量摄入硒而产生的恩施地区硒中毒的脱发脱甲病,均是典型的地方性疾病。硒具有抗氧化、延缓衰老、抗肿瘤、预防心脑血管疾病与胃肠道疾病、提高机体免疫力等多种生物活性被报道,其具有生物效应两面性,因此应关注人体硒需要量和安全摄入量。
目前,我国提高硒营养状态的措施是推行硒制剂、硒食品营养强化剂和富硒产品。在富硒环境中种植、养殖,或者通过施硒肥、硒培养基或提取工艺等措施得到含有不同硒化物的各种富硒食品或产品[1]。硒制剂、硒食品营养强化剂、硒盐(添加亚硒酸钠)均可以按人体需要进行定量、精确补硒,有国家强制性标准等措施监管,在对确诊为缺硒的人群补硒工作中起了巨大作用,已证明是安全、有效的,但其主要是向确诊为缺硒的人群补硒,不宜向无病症的轻微缺硒人群推广补硒。从补硒安全性、便捷性和易推广、以及生产数量优势等方面考虑,富硒粮食适合大多数普通人群补硒。
实际生产中,富硒粮食中硒含量较难保持稳定,会随季节年份、生产方式而变化,有时可能达不到富硒技术要求,需要对产品进行质量控制;而准确、快速、低成本的硒检测方法是生产中质量控制的有效工具。硒的检测方法有电感耦合等离子体质谱(ICP-MS)法[2]、电感耦合等离子体原子发射光谱(ICP-AES)法[3]、AFS[4-5]、GFAAS、紫外分光光度(UV)法、分子荧光光谱(MFS)法等;其中AFS是测定食品中硒的国家标准方法的第一法[6],GFAAS法也有较多文献报道[7],有快速、低成本的优点,适合生产监管的检测工作,但也面临方法选择和优化的问题。本实验测试富硒粮食中硒含量,优化实验方法,比较AFS和GFAAS方法的测试结果、特点及适用条件,为生产管理监控富硒粮食中硒含量提供检测技术支持。
分别采用优化的AFS、GFAAS方法,测定国家标准物质GBW10045大米中硒,测定结果均准确;以及测定实际粮食样品中硒,方法间测定结果一致性较好。AFS、GFAAS方法均适用于富硒粮食的硒含量测定工作。
1 实验部分
1.1 仪器与试剂
美国瓦里安AA 240Z型石墨炉原子吸收光谱仪,塞曼扣背景,附带自动进样器;北京吉天933型原子荧光光谱仪;北京莱伯泰科EHD36石墨消解仪;美国CEM公司 MARS 6微波消解仪,能进行温度控制。
硒标准储备溶液(100 mg/L):中国计量科学研究院标准物质GBW(E)080215,逐级稀释至所需的标准工作溶液。稀释介质为HNO3(1%)。
胶体钯(ColpdTM)。
配制涂层盐溶液母液,其中金属元素浓度分别为:钽40 g/L、钯4 g/L、镍40 g/L、铜1 g/L等。
试剂均为优级纯,实验用水为一级水(电阻率≥18.25 MΩ·cm)。
所使用的玻璃仪器均用洗涤剂于超声波清洗仪洗净,水冲洗干净晾干,再浸泡于HNO3(1+2)洗液中24 h以上,水冲洗数遍,晾干,备用。
1.2 样品制备
将粮食样品置于80 ℃电热干燥箱中烘干,用粉碎机将样品粉碎,并过孔径180 μm网筛,备用。
1.3 样品消解
微波消解方法。称取0.5 g(精确至0.000 1 g)样品,置于变性特氟隆消解罐内,加4 mL HNO3和2.0 mL H2O2,密闭,进行微波消解。程序升温:25 min 阶梯升温至190 ℃,保持5 min,使样品完全消解。待消解罐温度降至近室温,取出消解罐,转移溶液至25 mL容量瓶中,用水定容,消解溶液澄清、透明,备用。样品取5个平行,空白实验同时进行。
石墨消解方法。称取0.5 g(精确至0.000 1 g)样品,置于消解管内,加8 mL HNO3,加盖回流(不拧紧),采用石墨消解仪消解,于120 ℃保持60 min,升至150 ℃保持60 min,使样品完全消解;降温至120 ℃开盖进行赶酸,至剩余溶液约0.5 mL,转移溶液至10 mL容量瓶中,用水定容,消解溶液澄清、透明,备用。样品取5个平行,空白实验同时进行。
原子荧光光谱法的消解溶液酸度控制和还原处理:上述得到的样品消解液,在120 ℃进行消解溶液的赶酸,至剩余溶液约0.5 mL,加入5 mL HCl(6 mol/L)并保持沸腾20 min进行硒的还原,取下,冷却,用水定容至10 mL,备用。
1.4 实验方法
1.4.1 石墨管自制涂层
配备4种涂层制备溶液:A.钽溶液(40 g/L);B.钽(26 g/L)+钯(1.3 g/L)混合溶液;C.钽(20 g/L)+钯(1 g/L)+镍(10 g/L)混合溶液;D.钽(26 g/L)+镍(13 g/L)混合溶液。分别取4种涂层制备溶液进行石墨管涂层的涂布,在同一批次的热解涂层石墨管上制备出钽涂层、钽钯涂层、钽钯镍涂层、钽镍涂层等新涂层。
石墨管涂层制备方法:利用石墨炉原子吸收光谱仪的热进样和程序升温等功能,运行程序自动对石墨管涂布涂层[8]。
1.4.2 仪器工作条件
石墨炉原子吸收光谱仪,塞曼扣除背景,氩气为保护气。稀释液为HNO3(1%),仪器工作条件,灯电流9.0 mA,光谱带宽1.0 nm,分析线196.0 nm,样品溶液进样量10 μL,化学基体改进剂进样量5 μL(与样品溶液共进样),信号采集方式为峰面积,石墨炉升温程序见表1。
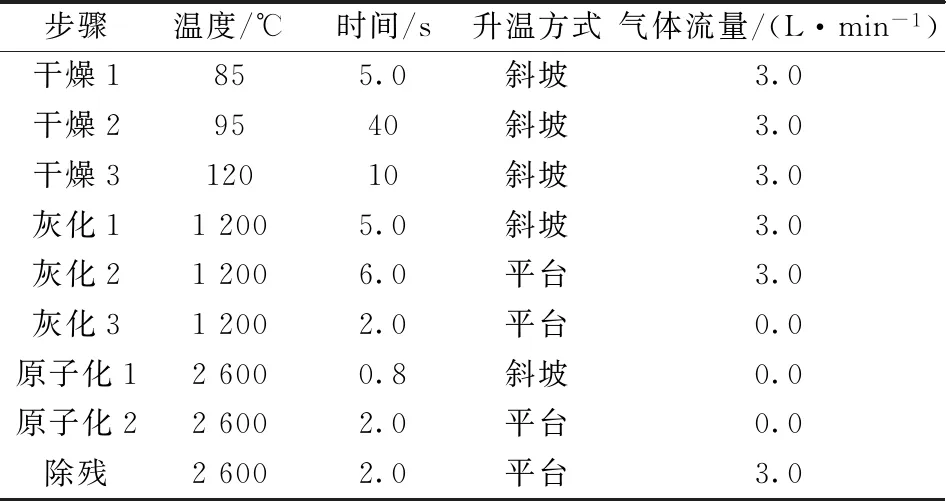
表1 石墨炉升温程序Table 1 Program of graphite furnace
原子荧光光谱仪,负高压270 V,灯电流80 mA,炉高10 mm,载气流速400 mL/min,屏蔽气流速800 mL/min,原子化器温度200 ℃,进样体积1 mL,读数方式峰面积,延迟时间0.8 s,读数时间8 s。
1.4.3 实验步骤
石墨炉原子吸收光谱法采用标准曲线法测定。由50 μg/L硒标准溶液经自动进样器自动稀释进样,按0、5、10、20、40 μg/L的浓度绘制出标准工作曲线;工作曲线A=0.016 5ρ-0.001 97,标准曲线相关系数为0.999 5;再进行样品测定。
原子荧光光谱法采用标准曲线法测定。分别吸取一定量的硒标准溶液于消解管,加5 mL HCl(6 mol/L),并在电热保持沸腾20 min进行硒的还原,取下,冷却,用水定容至10 mL,按0、1、2、4、8、10 μg/L的浓度制备上机的标准溶液,上机制出标准工作曲线;工作曲线I=72.859 3ρ+1.734 3,标准曲线相关系数为0.999 9;进行样品测定。
2 结果与讨论
2.1 化学基体改进剂优化
石墨炉原子吸收光谱法测定粮食中硒,原子化时背景值较高,主要是存在基质干扰,为了降低或消除干扰,采用添加化学基体改进剂的方法,可提高灰化温度、挥发基质,尽量在原子化前去除干扰物质。参考相关文献报道[9],分别选用了硫酸铜(铜1 g/L)、硝酸镍(镍10 g/L)、硝酸钯(钯0.5 g/L)、胶体钯(母液)等作为化学基体改进剂,进行样品测试、样品加标测试和标准物质测试的实验。胶体钯的实验效果最好,样品测试结果基本达到定量检测的要求,即硒加标回收率80%~120%、标准物质硒含量在证书值范围,但是仅限于原装进口热解涂层石墨管上使用,其使用成本较高;在使用某国产热解涂层石墨管时,则无法准确测定样品中硒含量(加标回收率<60%)。使用其余的化学基体改进剂时,无法准确测定样品中较低含量的硒(加标回收率<50%)。
为了能使用成本较低的国产石墨管(价格仅为原装进口石墨管的1/3),采用混合盐溶液作为化学基体改进剂进行实验,发现使用混合溶液基改剂钼(40 mg/L)+胶体钯的效果比单独使用胶体钯更好,且在原装进口和国产的石墨管上使用的效果相当(加标回收率80%~120%)。
2.2 石墨管涂层实验
为了降低原子化时背景,对石墨管增加了涂层。采用自动涂布钽钯合金层在石墨管内壁的方法[8],在同一批次的热解涂层石墨管上分别涂布了钽涂层A、钽钯涂层B、钽钯镍涂层C、钽镍涂层D等4种涂层,随后进行样品测定、样品加标测定和标准物质测定(并以硝酸钯溶液为基体改进剂),均能绘制出相关系数大于0.995的标准工作曲线;但是样品测定结果有差异,仅钽镍涂层D石墨管的样品测定结果达到定量检测的要求(加标回收率80%~120%),其余3种涂层的石墨管未能准确测定样品中硒的含量;推测不同涂层对消除上机测定时干扰因子的能力不同。
2.3 优化结果归纳
在实验仪器条件下,使用原装进口热解涂层石墨管、国产热解涂层石墨管、及4种自制涂层石墨管分别考察多种化学基体改进剂,只有原装进口热解涂层石墨管配合胶体钯、原装进口热解涂层石墨管配合混合溶液基体改进剂[钼(40 mg/L)+胶体钯]、国产热解涂层石墨管混合溶液基体改进剂[钼(40 mg/L)+胶体钯]、自制钽镍涂层石墨管配合硝酸钯,4种配比组合样品测定结果基本达到定量检测的要求。因为,原装进口热解涂层石墨管、国产热解涂层石墨管有共同适合混合溶液基体改进剂[钼(40 mg/L)+胶体钯],原装进口热解涂层石墨管还适合胶体钯,自制钽镍涂层石墨管只有单一适用硝酸钯,其关键点在于涂层的不同,推测GFAAS法测硒时石墨管涂层的性质不同,适合使用的化学基体改进剂也不同。
2.4 原子荧光光谱方法优化
参考国家标准方法[6],对样品消解方法、样品消解液还原条件、上机测定条件3个方面进行优化。样品消解方法的优化,根据粮食成分组成特性,减少酸的用量和种类(仅用硝酸),程序控温(精确控制温度和时间);样品消解液还原条件,精确控制还原条件,对样品消解液赶酸至约0.5 mL时加入5 mL HCl(6 mol/L)在120 ℃保持沸腾20 min进行硒的还原(时间留有盈余);上机测定条件根据仪器的最佳性能进行优化。
2.5 检出限
用11个样品空白溶液进行测定,取响应值的3倍标准偏差除以标准曲线斜率的方法计算检出限。石墨炉原子吸收光谱法的方法检出限为0.6 μg/L;原子荧光光谱法的方法检出限为0.2 μg/L。
2.6 样品分析结果及精密度
采用以上优化的方法对国家标准物质GBW10045大米中硒进行测定,分析结果和精密度见表2,结果与标准值基本一致,方法准确,精密度良好。

表2 标准样品分析Table 2 Analytical results of standard samples(n=5)
采用以上优化的方法对实际样品进行检测,分析结果和精密度见表3。
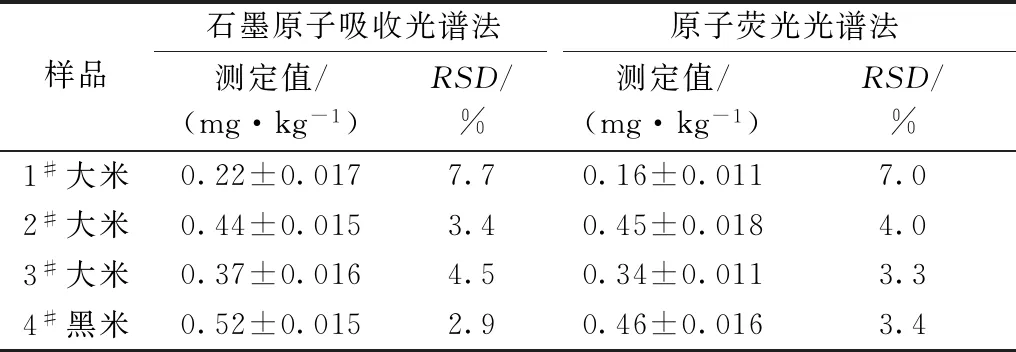
表3 样品分析Table 3 Analytical results of samples(n=5)
3 结论
1)分别用了AFS、GFAAS法测定富硒粮食中硒含量,比较了2种方法的测定结果,结果基本一致,均能满足富硒粮食中硒测定的要求,但是每种方法均有其优缺点,在样品测定时可根据实验室实际条件选择适合的方法。AFS法优点是检出限相对较低,能检出较低含量的硒;缺点是需要对消解液进行赶酸和还原其中硒,是准确测定硒的前提条件,其增加了时间和实验操作难度。GFAAS法优点是实验时间相对较短,操作简便、易控制条件;缺点是检出限相对较高,但是针对富硒粮食中硒含量范围能满足测定的要求。
2)实验方法应注意的关键点:AFS法需要严格控制样品待测液的酸度和硒价态,因为同浓度的四价硒与六价硒的响应值差异较大,加热赶酸、添加HCl还原时精确控制温度和时间,可以固定实验条件,提高实验结果的重现性。GFAAS法需要根据石墨管涂层的性质,反复实验、并找到与之适合的化学基体改进剂,可以确保测定结果的准确性。
