芒柄花黄素对人肾癌细胞786-O 的抑制作用及机制研究
2021-05-25李海虹欧伟宁
陈 庆 李海虹 欧伟宁 张 幸
1.广西壮族自治区玉林市第二人民医院肾内科,广西玉林 537000;2.广西壮族自治区玉林市第一人民医院质控科,广西玉林 537000;3.桂林医学院广西肿瘤免疫与微环境调控重点实验室,广西桂林 541100
肾癌恶性程度较高,化疗、放疗效果不好,且近几年国内外发病率呈上升趋势[1-2]。芒柄花黄素是一种异黄酮类植物雌激素,其能调节分子信号通路对肿瘤产生抑制作用[3-5],但对人肾癌细胞786-O 的作用及机制却未见报道。本实验研究芒柄花黄素对786-O 细胞的抑制作用及机制,为肾癌的治疗寻找新的药物及思路。
1 材料与方法
1.1 主要试剂与仪器
人肾癌细胞株786-O 购于中国科学院上海生命科学研究院;芒柄花黄素(货号:47752-25MG-F)购于美国Sigma 公司;RPMI-1640 培养基、胎牛血清购于美国Hyclone 公司;CCK8 试剂盒(货号:C0038)、Hoechst33258(货号:C1018)、V-FITC 凋亡检测试剂盒(货号:C1062M)购于上海碧云天研究所;PI3K 抗体(货号:PA5-86628)、P-PI3K 抗体(货号:PA5-38905)购于美国Thermo Scientific 公司;AKT(货号:sc-5298)、P-AKT抗体(货号:sc-377556)购于美国Santa Cruz 公司;CFX96 荧光定量PCR 仪、Universal HoodⅡ凝胶成像系统购于美国Bio-Rad 公司;FACSAria Ⅲ流式细胞仪购于美国Becton Dickson 公司。
1.2 方法
1.2.1 细胞培养 786-O 细胞于37℃、5%CO2的培养箱中,用含10%胎牛血清和1%双抗的RPMI-1640 培养基培养。
1.2.2 细胞分组 根据加入到786-O 细胞中的芒柄花黄素剂量(0、20、40、80 μmol/L)分为对照组(A 组)、芒柄花黄素低剂量组(B 组)、芒柄花黄素中剂量组(C 组)、芒柄花黄素高剂量组(D 组)。
1.2.3 CCK8 法检测细胞增殖情况 取对数生长期的786-O 细胞接种于96 孔板,浓度为5×103个/孔,加药分组,每组设3 个复孔。分别培养24、48、72 h 后,加10 μL CCK8 溶液避光孵育2 h,用酶标仪测吸光度(OD)值。细胞增殖抑制率=(1-药物组平均OD 值/对照组平均OD 值)×100%。实验重复3 次。
1.2.4 流式细胞术检测细胞凋亡情况 取对数生长期的786-O 细胞接种于6 孔板,孵育12 h,待细胞贴壁,去上清液,分别加入0、20、40、80 μmol/L 浓度的药液,继续孵育48 h,胰酶消化成单细胞悬液,PBS 清洗3 次,2000 r/min 离心5 min,离心半径12 cm,弃上清液,加500 μL 结合缓冲液重悬细胞,加5 μL Annexin V-FITC及5 μL Propidium Iodide 混匀,在室温避光反应15 min,用流式细胞仪检测细胞凋亡率。实验重复3 次。
1.2.5 Hoechst 染色观察细胞凋亡情况 取对数生长期的786-O 细胞接种于6 孔板,孵育12 h,待细胞贴壁,去上清液,分别加入0、20、40、80 μmol/L 浓度的药液,继续培养48 h 后弃培养基,加入0.5 mL 的固定液,作用10 min 后弃固定液,PBS 清洗2 次,加Hoechst33258染色液观察细胞凋亡情况。
1.2.6 RT-PCR 检测miR-155 的表达情况 Trizol 提取总RNA,按照试剂盒说明书逆转录总RNA 为cDNA,以cDNA 为模板用RT-PCR 检测miR-155 表达情况。miR-155 上游引物:5’-TGCCTCCAACTGACTCCTAC-3’,下游引物:5’-GCGAGCACAGAATAATACGAC-3’。U6 上游引物:5’-CTCGCTTCGGCAGCACA-3’,下游引物:5’-AACGCTTCACGAATTTGCGT-3’。反应条件为:预变性95℃5 min;循环以下条件40 次:95℃30 s,60℃25 s,72℃15 s。以U6 RNA 为内参,计算miR-155 的相对表达量。
1.2.7 Western blot 检测P-PI3K 及P-AKT 蛋白表达情况 收集上述几种浓度的药液孵育48 h 后的786-O 细胞,BCA 法进行蛋白定量。每孔20 μL 上样,电泳4 h,PVDF 膜半干转1.5 h,用5%脱脂奶粉的PBS液室温封闭60 min,之后分别加入稀释度1∶1000 的PI3K、P-PI3K、AKT、P-AKT 抗体4℃过夜,次日TBS洗膜,HRP 标记的二抗室温反应60 min,置暗室曝光条带。凝胶成像分析系统分析蛋白条带的光密度值。
1.3 统计学方法
采用SPSS 22.0 统计学软件进行数据分析,计量资料用均数±标准差()表示,多组间比较用单因素方差分析,不同时间点比较采用重复测量方差分析,两两比较用LSD-t 检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 四组细胞不同时间的增殖抑制率比较
整体分析发现:四组时间、组间比较,差异有统计学意义(P <0.05);交互作用比较,差异无统计学意义(P>0.05)。提示药物对786-O 细胞具有抑制作用。组内比较发现:培养72 h,B、C、D 组细胞增殖抑制率高于培养24、48 h;培养48 h,B、C、D 组细胞增殖抑制率高于培养24 h,差异均有统计学意义(均P<0.05)。组间比较发现:培养24、48、72 h,B、C、D 组细胞增殖抑制率高于A 组,C、D 组细胞增殖抑制率高于B 组,D 组细胞增殖抑制率高于C 组,差异均有统计学意义(均P <0.05)。见表1。
表1 四组细胞不同时间的增殖抑制率比较(%,,n=3)
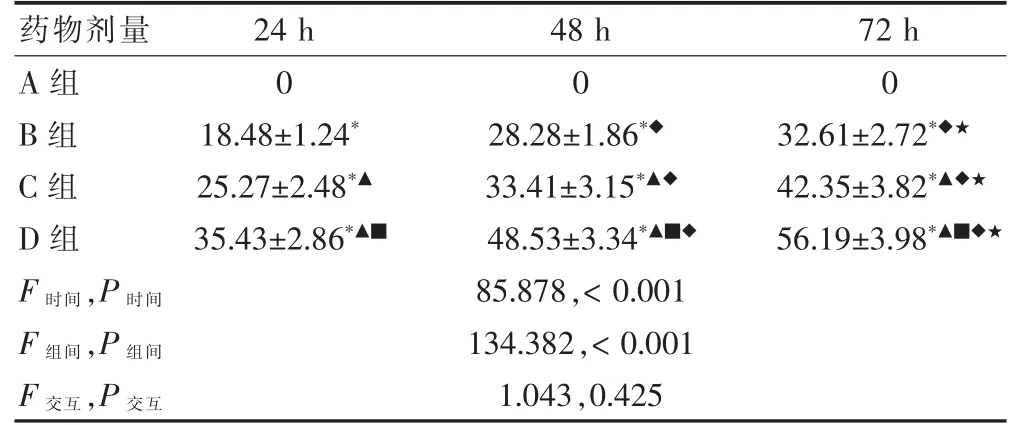
表1 四组细胞不同时间的增殖抑制率比较(%,,n=3)
注:与A 组同期比较,*P<0.05;与B 组同期比较,▲P<0.05;与C 组同期比较,■P<0.05;与本组24 h 比较,◆P<0.05;与本组48 h 比较,★P<0.05
2.2 四组细胞凋亡率比较
四组细胞凋亡率比较,差异有统计学意义(P <0.05);B、C、D 组细胞凋亡率高于A 组,C、D 组细胞凋亡率高于B 组,D 组细胞凋亡率高于C 组,差异均有统计学意义(均P <0.05)。见表2。Hoechst 染色结果显示,B、C、D 组可见细胞皱缩,细胞核致密浓染,且药物剂量越高,细胞凋亡越明显;A 组细胞核完整,形态饱满。见图1。
表2 四组细胞凋亡率比较(%,,n=3)

表2 四组细胞凋亡率比较(%,,n=3)
注:与A 组比较,*P<0.05;与B 组比较,▲P<0.05;与C 组比较,■P<0.05
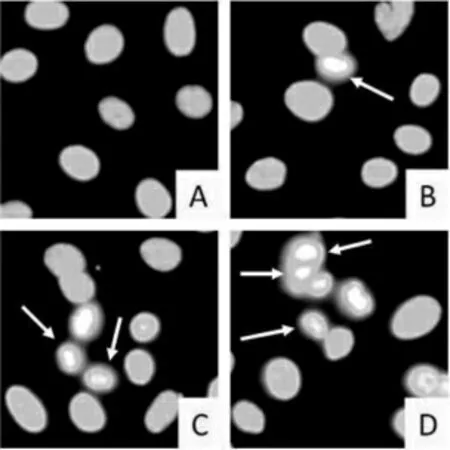
图1 各组细胞荧光显微照片(400×)
2.3 四组细胞miR-155 表达水平比较
B、C、D 组细胞miR-155 表达水平低于A 组,C、D 组细胞miR-155 表达水平低于B 组,D 组细胞miR-155 表达水平低于C 组,差异均有统计学意义(均P <0.05)。见图2。
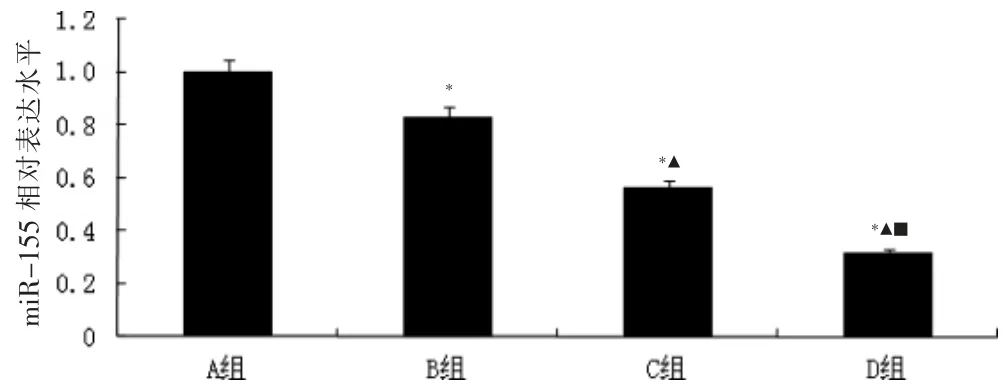
图2 四组细胞miR-155 表达水平比较(n=3)
2.4 四组细胞P-PI3K、P-AKT 蛋白表达水平比较
B、C、D 组细胞P-PI3K、P-AKT 蛋白表达水平低于A 组,C、D 组P-PI3K、P-AKT 蛋白表达水平低于B 组,D 组细胞P-PI3K、P-AKT 蛋白表达水平低于C 组,差异均有统计学意义(均P <0.05)。见图3。
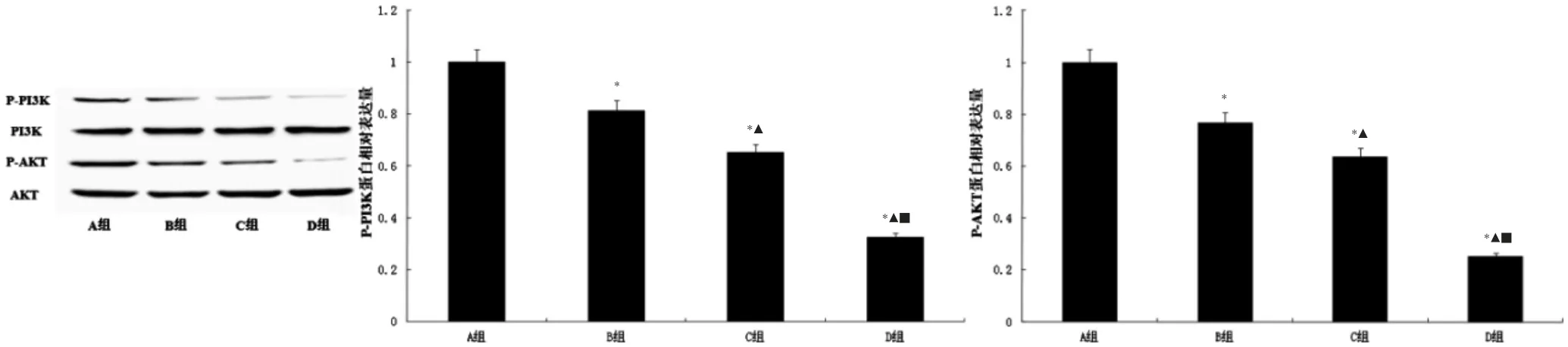
图3 四组细胞P-PI3K、P-AKT 蛋白表达水平比较(n=3)
3 讨论
化疗及靶向治疗肾癌近年来逐渐发挥重要作用[6],而传统化疗药物易产生毒副作用,破坏人体免疫系统,反而使癌细胞更易扩散[7-8]。有研究显示[9-11],芒柄花黄素能多靶点抑制肿瘤细胞增殖。本研究结果显示,芒柄花黄素抑制786-O 细胞增殖;流式细胞术和Hoechst 染色均显示药物剂量越高,786-O 细胞凋亡率越高,与CCK8 实验结果相符。提示药物可能通过诱导细胞凋亡从而抑制786-O 细胞增殖。
miRNA 是一类通过诱导靶基因降解或阻断其翻译过程沉默该基因的表达进而对细胞分化、增殖、凋亡以及侵袭转移起重要作用的小分子非编码RNA[12-14]。随着对microRNA 研究的深入,microRNA 被发现与肿瘤的发生、发展存在重大联系[15-18]。miR-155 在大多数肿瘤例如结肠癌、膀胱癌、非小细胞肺癌、乳腺癌、肾癌中表达较高[19-23],提示miR-155 作为癌基因过表达可促进细胞异常增殖。PI3K 是一种原癌基因,经活化后产生的PIP3 可使AKT 被激活产生磷酸化,从而参与肿瘤细胞的增殖、凋亡等进程[24],因此PI3K/AKT 信号通路异常激活能促进细胞增殖并抑制细胞的凋亡[25]。研究显示[26],miR-155 能通过PI3K/AKT 通路促进肿瘤细胞的增殖,而下调miR-155 能抑制PI3K/AKT 通路的激活,明显抑制细胞增殖。本研究结果显示,芒柄花黄素能使miR-155 表达水平降低,P-PI3K/PI3K、P-AKT/AKT 比值降低,即PI3K/AKt 通路激活被抑制。提示芒柄花黄素抑制786-O 细胞增殖、诱导其凋亡的机制可能与其下调miR-155 表达,抑制PI3K/AKT 信号通路激活有关,本研究为肾癌的治疗提供了新的思路和方法,具有重要研究价值。
