UAER、Scr、CysC对高血压脑梗死患者病情发生发展的影响研究
2021-05-25乔艳丽
乔艳丽
(安阳市中医院 急诊科,河南 安阳455000)
脑梗塞是由脑动脉粥样硬化引起的神经功能障碍,当血管内膜受到损伤时会引起脑动脉管腔狭窄,诱发局部血栓的形成导致动脉狭窄加剧甚至完全闭塞,最终导致脑组织缺血缺氧坏死的发生,引起常见脑血管病[1]。胱抑素C(CysC)是评估早期肾损伤的新指标,血清CysC水平与心房纤颤和中风的发生直接相关,尤其是脑梗塞的发生[2]。尿白蛋白排泄率(UAER)是指通过放射免疫测定或酶免疫测定检测尿白蛋白排泄率。如果尿白蛋白排泄率小于阈值,则表示尿白蛋白为阴性,即正常;如果它大于阈值,则表示尿白蛋白定性阳性,即白蛋白尿[3]。本次研究选取2017年2月-2018年8月接受治疗的高血压脑梗死患者为研究对象,观察高血压脑梗死患者UAER、血肌酐(Scr)、CysC水平,并分析其临床意义,报道如下。
1 资料与方法
1.1 一般资料
选取2017年2月-2018年8月在安阳市中医院接受治疗的高血压脑梗死患者为研究对象。纳入标准:(1)年龄大于或等于50周岁;(2)经相关检查确诊为高血压合并脑梗死者;(3)无其他系统严重基础疾病者。排除标准:(1)不愿参与本项研究者;(2)合并原发性肾脏疾病者。根据标准共纳入病例数60例,男35例,女25例,年龄52-74岁,平均65.23±4.15岁。高血压无脑梗死患者纳入标准:符合高血压诊断标准,经CT检查无脑梗死征象者。根据标准共纳入60例,男38例,女22例,年龄51-76岁,平均65.25±4.24岁。健康体检者纳入标准:(1)年龄大于等于50周岁;(2)无基础疾病者。排除标准:(1)不愿参与本项研究者;(2)合并心血管系统疾病者。根据标准共纳入60例,男30例,女30例,年龄54-76岁,平均65.24±4.08岁。本项研究经医院伦理委员会评审通过,且患者均知情同意。
1.2 研究方法
抽取5 ml患者的空腹静脉血,取血前禁食8 h以上。使用德国Deer BNII特异性蛋白质分析仪,通过粒子增强散射浊度法测定CysC;Scr是在日本Olympus自动生化分析仪上测定的。
UEAR标本收集和治疗:符合入选标准的患者在入院第2天早晨排空膀胱,收集24 h尿液。将甲酸10 ml加入收集容器中,做防腐处理,次日7点钟,患者再次排空膀胱(无论是否有意),准确记录24 h排尿量,搅匀送入相关部门检测。
1.3 评价指标
观察高血压合并脑梗死患者、高血压无脑梗死患者和健康体检者UAER、Scr、CysC水平、血清炎症因子水平的差异。分析高血压脑梗死患者UAER、Scr、CysC水平与炎症因子水平的相关性。
1.4 统计学处理
数据采用Excel录入后,采用SPSS 11.5软件分析。计数和计量资料分别采用例和均数±标准差表示。采用t检验、Pearson相关分析法进行统计学处理。P<0.05为差异有统计学意义。
2 结果
2.1 高血压脑梗死患者、高血压无脑梗死患者和健康体检者UAER、Scr、CysC的比较
表1显示,3组患者的UAER、Scr、CysC水平由高到低分别为高血压合并脑梗死组、高血压无脑梗死组和对照组,差异有统计学意义。

表1 高血压脑梗死患者、高血压无脑梗死患者和健康体检者UAER、Scr、CysC的比较
2.2 高血压脑梗死患者、高血压无脑梗死患者和健康体检者炎症因子水平的比较
表2显示,3组患者的CRP、TNF-α水平由高到低分别为高血压合并脑梗死组、高血压无脑梗死组和对照组,差异有统计学意义。

表2 高血压脑梗死患者、高血压无脑梗死患者和健康体检者炎症因子水平的比较
2.3 不同高血压合并脑梗死患者UAER、Scr、CysC水平的比较
表3显示,高血压脑梗死B组的Scr、CysC、UAER水平分别为83.46±4.12 μmmol/L、2.03±0.67 mg/L、0.61±0.14,高于高血压脑梗死A组。
2.4 不同高血压合并脑梗死患者炎症因子水平的比较
表4显示,高血压脑梗死B组患者的CRP、TNF-α水平分别为20.28±3.46 mg/L、45.72±5.12 ng/L,明显高于高血压脑梗死A组,差异有统计学意义。

表3 不同高血压合并脑梗死患者UAER、Scr、CysC水平的比较
2.5 高血压脑梗死患者UAER、Scr、CysC水平与炎症因子水平的相关性
表5显示,高血压脑梗死患者UAER、Scr、CysC水平与CRP、TNF-α水平正相关。

表4 不同高血压合并脑梗死患者炎症因子水平的比较
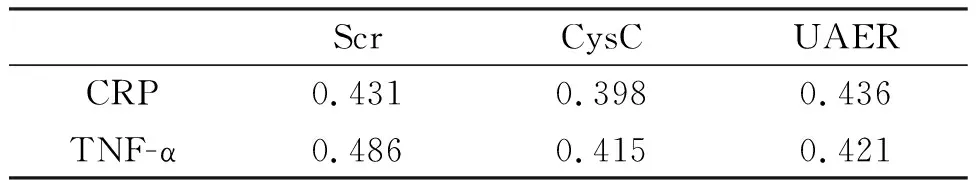
表5 高血压脑梗死患者UAER、Scr、CysC水平与炎症因子水平的相关性
3 讨论
老年高血压合并脑梗塞已成为危害老年人健康的重要疾病。最近的研究证实,局部或全身炎症在动脉粥样硬化及其并发症的发生和发展中起着重要作用[4]。血清CRP可以参与动脉粥样硬化过程,在斑块破裂和最终脑梗塞的形成中发挥着重要作用[5]。CRP是一种急性期反应蛋白,在体内受损或发炎时急剧升高,是一种参与局部或全身炎症的非特异性炎症标志物[6]。正常情况下,正常人血清中CRP含量较低,当组织受到损伤和感染时,活性单核细胞释放白细胞介素-1,刺激肝细胞更快地合成CRP,血清CRP显著增加。
有研究[7]认为CRP通过激活单核细胞和内皮细胞的作用,促进动脉粥样硬化的发生。因此CRP可以作为动脉粥样硬化的炎症标志物。有人[8]发现CRP通过内皮素和白细胞介素-6介导促进动脉粥样硬化和炎症表型,受体拮抗剂或白细胞介素-6抑制剂的使用可以抑制CRP的作用。研究结果发现,患有心肌梗死和缺血性脑卒中的患者,血浆CRP浓度显著高于未发生血管疾病的患者,可以认为血浆CRP浓度可以作为早期预测心肌梗死和缺血性卒中的指标[9]。本次研究中,高血压脑梗死患者、高血压无脑梗死患者和健康体检者炎症因子水平的比较,高血压脑梗死患者的CRP、TNF-α水平显著高于高血压无脑梗死组和对照组;高血压脑梗死中重型神经功能缺损组的CRP、TNF-α水平高于高血压脑梗死轻型神经功能缺损组。这表明血清CRP和TNF-α可能参与了高血压合并脑梗塞的发病机制,可作为高血压脑梗死患者诊断的重要指标。
CysC是评估早期肾功能损害的新指标,一些研究表明它与心脑血管疾病密切相关。高水平的CysC与卒中风险直接相关,尤其是脑梗塞,发现CysC与5年随访时的中风,心血管事件和全因死亡呈正相关[10]。CysC与Scr的关系比与亚临床脑梗死的发生更为密切[11]。横向分析[12]发现血清CysC水平与心房颤动的发生率成正比,是发生房室颤动的独立标志物。CysC是患者体内GFR变化的标志,可以穿过肾小球不受阻碍,在近曲小管中被完全重吸收并且不被肾小管上皮细胞分泌。最近的研究表明,血清CysC浓度受年龄、体重指数、性别、吸烟和过敏性CRP等多种因素的影响,研究发现CysC与GFR和Scr有统计学相关性,说明CysC水平是提示患者出现肾功能不全的良好指标[13]。
Scr的血清浓度可用于评估肾小球滤过率,但Scr血清浓度受饮食活动、蛋白质代谢、胃肠道出血、患者体质和肌肉水平等多种因素的影响。因此,血液中的Scr浓度代表肾脏损伤的特异性不高[14]。高血压脑梗死的发病率逐渐增加,在早期阶段,消除Scr过程不受补偿效应的影响。因此,Scr的血清浓度未显示异常并且仍在正常参考范围内。当Scr血清浓度显著异常时,肾脏的GFR通常降至50%或更低[15]。这表明补偿的肾单位较少,肾脏的功能较弱,肾脏损害已达到非常严重的程度。本次研究中高血压脑梗死患者、高血压无脑梗死患者和健康体检者UAER、Scr、CysC的比较没有统计学差异;高血压脑梗死中重型神经功能缺损组的Scr、CysC、UAER水平高于高血压脑梗死轻型神经功能缺损组。高血压脑梗死患者UAER、Scr、CysC水平与CRP、TNF-α水平正相关。
综上所述,高血压脑梗死患者UAER、Scr、CysC水平较高,且与患者神经功能缺损程度密切相关。
