奇异变形杆菌临床株对碳青霉烯类耐药的分子机制和同源性
2021-05-25刘入华李笃军李宜雷刘艳飞董丹丹朱元祺
刘入华,李笃军,李宜雷,刘艳飞,董丹丹,朱元祺*
(1.青岛大学附属医院,山东 青岛266003;2.山东省烟台业达医院,山东 烟台264006;3.山东省日照市人民医院,山东 日照276826;4.青岛大学医学院,山东 青岛266071)
奇异变形杆菌常常分布于人和动物的肠道内,是临床上重要的条件致病菌,可引起人的泌尿道、血流、伤口和呼吸道感染[1-2]。近十几年来,由于抗菌药物的不合理使用,奇异变形杆菌呈现多重耐药增加的趋势,甚至分离出对碳青霉烯类抗菌药物耐药的临床株[3-4]。另外,由于奇异变形杆菌对替加环素和多粘菌素天然耐药,一旦分离株对碳青霉烯类耐药,对奇异变形杆菌引起的感染将面临无药可用的局面。目前为止,对于奇异变形杆菌耐药机制的有关报道以产超广谱β-内酰胺酶和头孢菌素酶(质粒或染色体介导的AmpC酶)多见,而对碳青霉烯酶的报道不多。因此,本研究对2019年8月-2019年9月分离自ICU患者的5株耐碳青霉烯类奇异变形杆菌的耐药机制和同源性进行研究,现报道如下。
1 材料与方法
1.1 临床和质控菌株5株耐碳青霉烯类奇异变形杆菌(HFK665-669)临床株于2019年8月-2019年9月分离自ICU患者的尿液或痰液标本。药敏质控菌株大肠埃希菌ATCC25922、铜绿假单胞菌ATCC27853和脉冲场电泳分子量标记沙门菌H9812都为本实验室保存。
1.2 主要设备与试剂法国生物梅里埃VITEK-2 Compact进行菌株的鉴定和药敏,药物敏感性的判定依据CLSI-2019标准[5]。扩增仪、脉冲场电泳仪和凝胶成像系统为美国BIO-RAD 公司产品。DL2000分子量标准、琼脂糖和PCR扩增试剂为大连宝生生物生产。
1.3 编码碳青霉烯酶耐药基因的扩增和测序扩增编码碳青霉烯酶耐药基因(blaKPC、blaNDM、blaIMP、blaOXA-48和blaVIM)依据参考文献进行[6]。耐药基因的PCR引物合成和扩增产物的测序由生工(上海)生物工程有限公司完成。
1.4 菌株的Xba I脉冲场凝胶电泳(PFGE)和S1核酸脉冲场凝胶电泳(S1-PFGE)具体操作参照文献改良[2]。电泳条件:转换时间6.8 s-35.4 s,转角120,电泳时间18.5 h。
1.5 菌株的全基因组测序基于Illumina Miseq和Nanopore MinION测序平台对奇异变形杆菌(HFK665-669)临床株进行测序。然后,利用ResFinder、Tn Number Registry和INTEGRAL等软件分析菌株的生物信息,并使用Inkscape0.48.1软件绘图。
2 结果
2.1 菌株的的药敏和β-内酰胺酶耐药基因
5株奇异变形杆菌(HFK665-669)临床株耐药表型一致,显示对氨苄西林、氨苄西林/舒巴坦、哌拉西林/他唑巴坦、头孢唑啉、头孢曲松、头孢他啶、头孢吡肟、头孢替坦、厄他培南、亚胺培南、美罗培南、阿米卡星、庆大霉素、妥布霉素、环丙沙星、左氧氟沙星、磺胺甲恶唑/甲氧苄啶哌耐药或中介,但对氨曲南敏感。PCR扩增显示这5株临床菌blaNDM基因阳性,经测序比对确认为blaNDM-1型。另外,高通量测序也显示,这5株菌除了携带blaNDM-1外,还携带blaTEM-1、blaCMY-2和blaOXA-1型β-内酰胺酶基因。结果见表1、表2和图1。
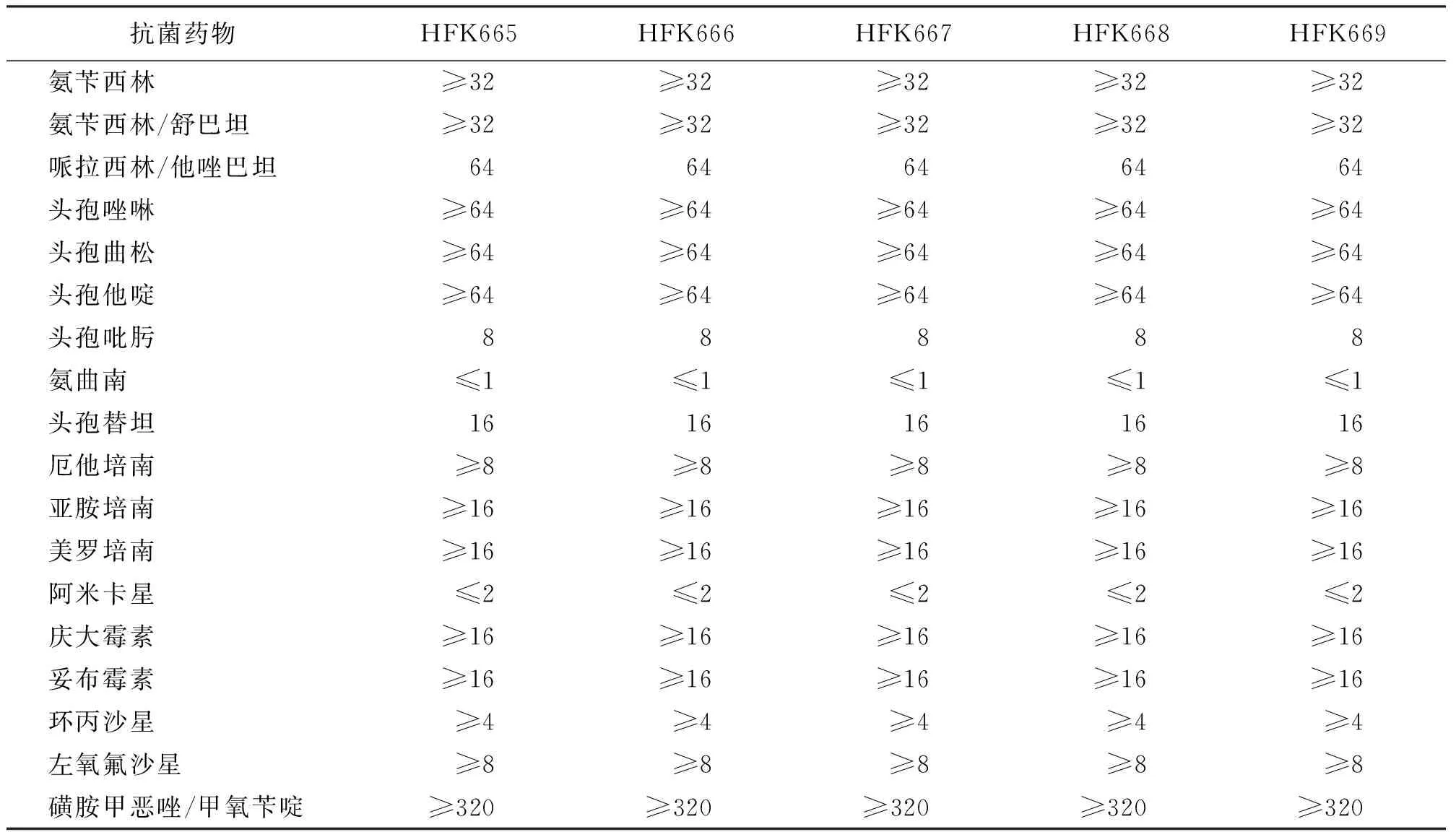
表1 奇异变形杆菌临床株的药敏结果(μg/mL)
2.2 菌株的Xba I脉冲场凝胶电泳和S1核酸脉冲场凝胶电泳
Xba I脉冲场凝胶电泳结果显示这5株奇异变形杆菌在条带数目、位置分布上基本相同,条带相差在3条以内,依据Tenover规则[7]和菌株分离的时间及科室,可以判定这5株耐碳青霉烯类奇异变形杆菌(HFK665-669)之间有同源性,而且表明在ICU患者间存在克隆的流行播散。另外,S1核酸脉冲场凝胶电泳未显示质粒条带,进一步验证耐药基因在染色体上。脉冲场凝胶电泳结果见图2。
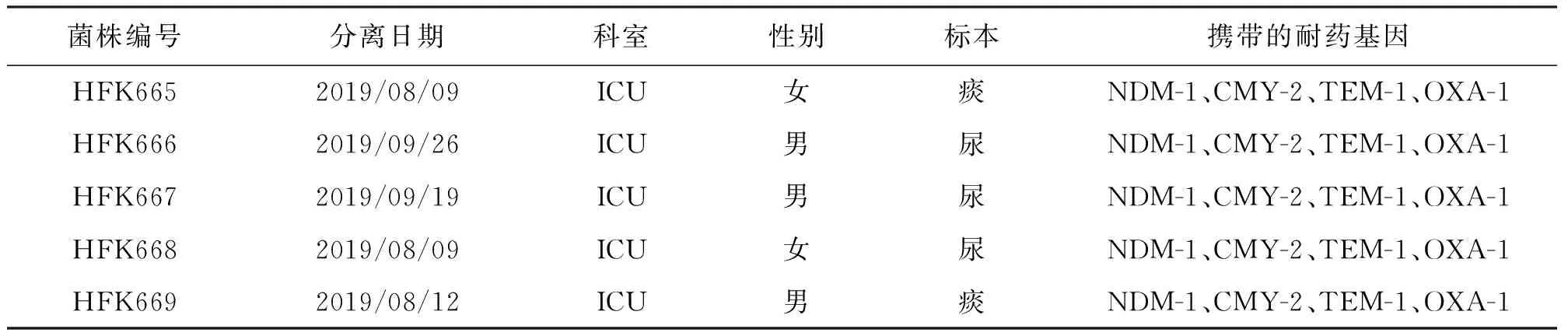
表2 奇异变形杆菌临床株携带的β-内酰胺酶基因
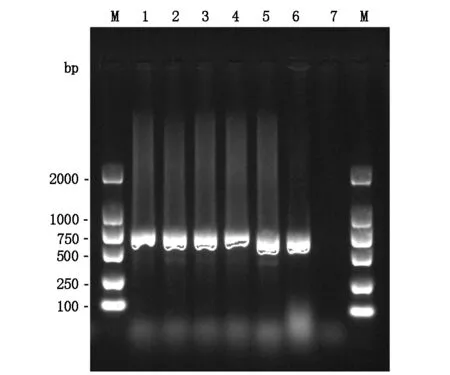
图1 PCR扩增blaNDM-1基因的产物电泳图
2.3 菌株的全基因组测序结果
经软件分析奇异变形杆菌高通量测序数据,生物信息结果显示染色体上NDM相关区域携带耐药基因的移动元件包括:转座子ΔTn2、转座子ΔTn125和整合子 In27。ΔTn2由ΔtnpA-res-tnpR-blaTEM-1-IRR片段构成;ΔTn125由ΔISAba125、ΔblaNDM-1、bleMBL和ΔtrpF组成;整合子In27属于反方向的复合型Ⅰ型整合子,结构为 IRi、5’保守片段、可变区 1(dfrA12-gcuF-aadA2)、3’保守片段的第1个拷贝、ISCR1、可变区 2(ΔcatB3-arr3)、3’保守片段的第2个拷贝(qacED1-Δsul1)。NDM相关区域与参考移动元件的比较结果见图3。
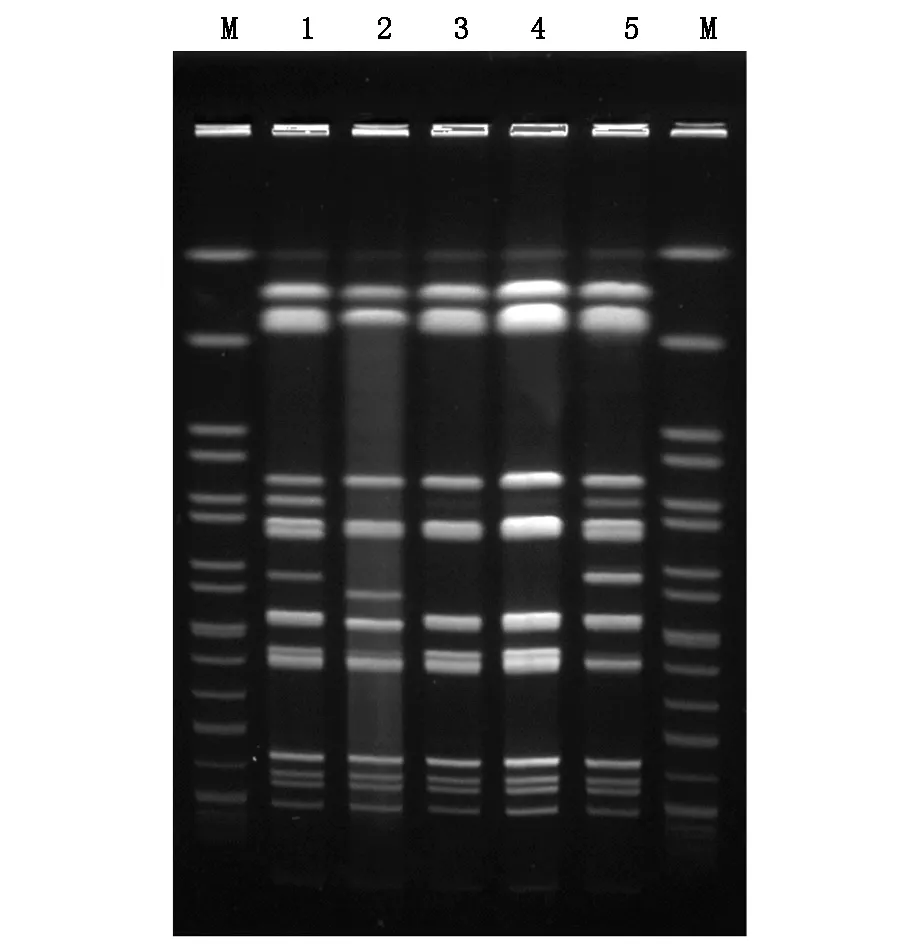
图2 Xba I酶切奇异变形杆菌基因组脉冲场凝胶电泳

图3 变形杆菌(HFK665-669)的blaNDM-1基因区域与参考移动元件的比较
3 讨论
随着抗菌药物的不合理使用,奇异变形杆菌对β-内酰胺抗生素的耐药性逐年升高,其耐药机制主要与产β-内酰胺酶有关,包括超广谱β-内酰胺酶、AmpC酶和碳青霉烯酶等[3]。
自2008 年美国Tibbetts等研究人员[4]首次报道携带blaKPC-2基因的奇异变形杆菌临床株后,不同国家和地区又陆续报道了产不同型碳青霉烯酶的奇异变形杆菌。如巴西、意大利、奥地利和法国又陆续报道了产KPC-2、IMP-1、NDM-1、NDM-5和OXA-23型碳青霉烯酶的奇异变形杆菌[8-12]。这些编码碳青霉烯酶耐药基因既可位于质粒上,也可以整合到菌株的染色体上[13-14]。本研究显示:这5株奇异变形杆菌(HFK665-669)临床株耐药表型一致,除了对氨曲南敏感外,对测试的抗菌药物都耐药或中介。PCR扩增产物经测序和高通量测序都证明这五株菌携带blaNDM-1基因,而且该基因位于染色体上。
另外,对本研究的奇异变形杆菌HFK665的生物信息进行分析,结果显示染色体上NDM相关区域携带耐药基因的移动元件包含转座子ΔTn2、转座子ΔTn125和整合子 In27。Tn2属于 Tn3家族的转座子,结构为 IRL(左向反向重复序列)、tnpA(转座酶)、res(解离位点)、tnpR(解离酶)、blaTEM-1(β-内酰胺酶耐药基因)和IRR(右向反向重复序列),并且以5 bp的直接重复序列(DRs:转座复制信号)为界。但是,在HFK556的染色体上NDM相关区域,ΔTn2由ΔtnpA-res-tnpR-blaTEM-1-IRR片段构成。Tn125最初在不动杆菌属菌株的质粒pNDM-BJ01中发现,包括以下结构:ISAba125、blaNDM-1、bleMBL、trpF、dsbD、cutA、groES、groEL和ISCR21,并且被3 bp的DRs 所包围[15]。Tn125经常可以通过转座方式移动并且在复杂重组过程中以各种截短的形式存在。相比于完整的Tn125,在HFK556的染色体上NDM相关区域的ΔTn125由ΔISAba125、ΔblaNDM-1、bleMBL和ΔtrpF组成。并且它位于整合子In27的ISCR1的上游,这可能与ISCR1介导的转移有关。复合型I型整合子包括IRi、5’保守片段(IntI1-attI1:整合酶-整合位点)、可变区 1(variable region 1:VR1)、3’保守片段的第1个拷贝(3’-CS1:qacED1-sul1))、ISCR1、可变区 2(variable region 2 :VR2)、 3’保守片段的第2个拷贝(3’-CS2:qacED1-sul1-orf5-orf6)、Tn402的tni模块和 IRt结构,并被5bp 的 DRs 所包围。整合子In27属于反方向的复合型 1 型整合子,结构为 IRi、5’保守片段、可变区 1(dfrA12-gcuF-aadA2)、3’保守片段的第1个拷贝、ISCR1、可变区 2(ΔcatB3-arr3)、3’保守片段的第2个拷贝(qacED1-Δsul1)。
AmpC酶包括质粒和染色体介导两种形式,其中blaCMY属于染色体介导的耐药基因,主要水解青霉素等抗菌药物[3]。本研究还显示,除了携带blaNDM-1基因外,奇异变形杆菌HFK665还携带blaTEM-1、blaCMY-2和blaOXA-1型β-内酰胺酶基因,这与国内外关于奇异变形杆菌中的AmpC酶基因以blaCMY型为主的报道相一致[16]。
目前,耐碳青霉烯类奇异变形杆菌的克隆聚集流行案例报道以携带blaKPC-2基因为主,且该基因既可位于质粒上,也可位于染色体上[3,4,16]。本研究中的5株奇异变形杆菌分离于尿液和痰液,依据Tenover规则,Xba I脉冲场凝胶电泳结果表明这些菌(HFK665-669)之间存在有同源性,即在ICU患者间存在克隆的流行播散。经检索,染色体上携带blaNDM-1、blaTEM-1、blaCMY-2和blaOXA-1基因的奇异变形杆菌的克隆传播属于国内外首次报道。另外,有学者报道了从动物、家禽肉制品分离到多重耐药或耐碳青酶烯类奇异变形杆菌,这提示耐药株可能在人和动物之间传播[4,17]。因此,对于预防耐碳青霉烯类奇异变形杆菌的流行,涵盖了许多环节,尤其要重视医疗机构内部的医院感染控制,以预防其流行和暴发。
