木犀草素对Aβ25-35 损伤PC12 细胞氧化应激及Tau 蛋白磷酸化的影响
2021-05-21伊金月张智博邢怀玉李庆伟徐红丹孙慧峰
伊金月,张智博,姚 远,邢怀玉,李庆伟,张 宁,,徐红丹,*,孙慧峰*
(1.黑龙江中医药大学 药学院,黑龙江 哈尔滨 150040;2.黑龙江中医药大学 佳木斯学院,黑龙江 佳木斯 154007)
阿尔茨海默病(Alzheimer’s disease,AD)是最常见的神经退行性疾病,伴随着学习、记忆和认知功能的逐渐衰退[1]。AD 其病理特征是神经元凋亡,老年斑(SPs)沉积以及在大脑皮层和海马的局限区域形成神经纤维缠结。淀粉样蛋白β(Amyloid beta,Aβ)是SPs 的主要组成部分,Aβ 的聚集和沉积导致脑内大量神经元死亡。木犀草素是一种植物雌激素,主要存在于补肾中药骨碎补中,具有雌激素样作用。有研究表明,木犀草素能减轻淀粉样β 蛋白诱导的神经毒性[2],并诱导PC12 细胞突起生长,增强细胞抗氧化防御能力[3]。木犀草素具有神经保护作用,但其促神经发生作用的详细分子机制仍然有限。PI3K/Akt 细胞信号通路在调节细胞分化、增殖、存活和抗氧化方面起着至关重要的作用。当PI3K/Akt 通路被激活时,Akt 磷酸化激活下游转录因子,起到抗氧化作用,这被认为是细胞氧化损伤的保护机制之一。本实验应用PI3K 阻断剂LY294002 进行干预,观察木犀草素处理后PC12 细胞的氧化损伤以及PI3K/Akt途径关键分子及蛋白的变化,探讨木犀草素的保护功能是否和PI3K/Akt 途径相关,进一步阐明木犀草素抗Aβ 损伤PC12 细胞的作用机制,从而为AD 的临床治疗提供新的见解。
1 材料与方法
1.1 材料
PC12 细胞购自中国科学院细胞库;木犀草素(成都曼思特生物科技有限公司);Aβ25-35(北京Bioss 生物技术有限公司);胎牛血清(FBS)、高糖培养液(DMEM)、双抗、胰蛋白酶(Hyclone 公司);四甲基噻唑蓝(MTT )、DMSO(Sigma 公司);SOD 测试盒、MDA 测试盒(南京建成生物工程研究所);ROS 试剂盒(碧云天生物技术研究所);IX-71-21PH 型Olympus 倒置显微镜(日本Olympus 株式会社);MK3 型酶标仪(上海热电仪器有限公司)。
1.2 方法
1.2.1 PC12 细胞复苏、培养、传代及冻存 液氮中取出细胞置于37℃水浴锅中迅速摇晃,1 min内溶化,溶化后移至15 mL 离心管中,加3 ~ 5 mL DMEM 完全培养基混匀,1 000 r/min、5 min 离心,加3 ~ 7 mL DMEM 完全培养基重悬,吸取1 mL 重悬液置于25 cm2培养瓶中,加入3 ~ 6 mL 的DMEM 完全培养基,于37℃、5%CO2的培养箱中,每隔24 h换液一次,待细胞长至80%以上,采用0.25%胰酶消化细胞按照1 ∶4 或者更大的比例进行传代。还可以在良好条件下将细胞消化至80%,将细胞重悬于8%DMSO,10%胎牛血清和82%DMEM 完全培养基中,并将悬浮液转移至冷冻管,每管1 mL。将其置于程序冷却箱中并逐渐冷却,在-80 ℃下过夜,最后在液氮罐(-196 ℃)中长时间储存。
1.2.2 MTT 法检测细胞活力 实验分为空白组、模型组(Aβ25-35组)、木犀草素+Aβ25-35组。其中空白组给予不含药物的DMEM 完全培养液200 μL;模型组与木犀草素+Aβ25-35组同步加入20 μmol/L Aβ25-35;木犀草素+Aβ25-35组分别加入含10、1、10-1、10-2、10-3、10-4、10-5、10-6μmol/L 各 浓 度 的木犀草素的完全培养液,继续培养24 h,MTT 法检测细胞活力。
1.2.3 实验分组及给药 根据筛选的浓度、细胞增值率的结果,后续实验分为4 组:(1)空白组:DMEM 培养液培养24 h 后更换一次DMEM 培养液,继续培养24 h;(2)模型组(Aβ25-35组):DMEM培养液培养24 h,更换DMEM 培养液培养2 h 后给予Aβ25-35溶液,使其终浓度为20 μmol/L,继续培养24 h;(3)木 犀 草 素+Aβ25-35组:DMEM 培 养液培养24 h,更换成终浓度为10-4μmol/L 的木犀草素溶液培养2 h,给予Aβ25-35溶液,使其终浓度为20 μmol/L,继续培养24 h;(4)木犀草素+Aβ25-35+LY294002 组:DMEM 培养液培养24 h,更换成终浓度2 × 102μmol/L 的LY294002 培养1 h,更换成终浓度10-4μmol/L 的木犀草素溶液培养2 h,给予Aβ25-35溶液,使其终浓度为20 μmol/L,继续培养24 h。
1.2.4 Western blot 法 充分裂解PC12 细胞,采用BCA 法检测总蛋白浓度,等量上样进行10% SDSPAGE 凝胶电泳,将蛋白转移到PVDF 膜上,用5%封闭液封闭2 h,加一抗孵育4 ℃过夜,加二抗孵育2 h,洗膜之后加ECL 化学发光液,凝胶成像系统进行检测分析。每个样本3 次平行试验,得到蛋白条带的积分光密度( IOD) ,利用Lane ID 凝胶软件分析数据。用IOD 目的条带/IOD 内参条带比值来表示检测目的蛋白表达水平。
1.2.5 ROS 的测定 细胞培养至对数期,以4×105/孔的量将细胞悬液种植至6 孔板,2 mL/孔,细胞按不同分组情况培养后,移除培养液,加入10 μmol/L的DCFH-DA 1 mL/孔,将6 孔板放在培养箱内静置20 min,每5 min 将孔板中的各孔混一次,使细胞充分接触探针,用无血清培养液洗涤三次,收集细胞,加入1 mL 无血清培养液,流式细胞仪检测。
1.2.6 MDA 的测定 细胞培养至对数期,以4×105/孔的量将细胞悬液种植至6 孔板,2 mL/孔,细胞按不同分组情况培养后收集至15 mL 离心管中,将RIPA 裂解液(含1% PMSF)添加到各离心管中,静置3 min 后将所有液体移至1.5 mL 离心管中,静置30 min 然后离心(4 ℃,12 000 r/min,5 min),离心后取上清,BCA 试剂盒进行蛋白定量。按照丙二醛测试盒说明书步骤,应用半自动生化分析仪,在波长532 nm 处,测定各组OD 值。
1.2.7 SOD 的测定 细胞培养至对数期,以4×105/孔的量将细胞悬液种植至6 孔板,2 mL/孔,细胞按不同分组情况培养后收集至15 mL 离心管中,将RIPA 裂解液(含1%PMSF)添加到各离心管中,静置3 min 后将所有液体移至1.5 mL 离心管中,静置30 min 然后离心(4 ℃,12 000 r/min,5 min),离心后取上清,BCA 试剂盒进行蛋白定量。按照总超氧化物歧化酶测试盒说明书步骤,应用半自动生化分析仪,在波长550 nm 处,测定各组OD 值。
1.2.8 统计学方法 用 SPSS 18. 0 软件进行数据分析,计量资料用均数±标准差(±s)表示,多组间比较采用方差分析,多组间两两比较采用 LSD 检验。以P <0. 05 为差异具有统计学意义。
2 结果与分析
2.1 木犀草素对Aβ25-35 损伤的PC12 细胞活性的影响
结果见表1,与空白组相比,Aβ25-35组增殖率显著降低(P <0.01);与模型组比较, 除10 μmol/L剂量组外各剂量木犀草素组细胞增殖率显著升高(P <0.01);其中10-4μmol/L 木犀草素组的细胞增殖率与空白组无显著差异。结果表明,10-4μmol/L 木犀草素对Aβ25-35损伤PC12 细胞保护作用最强,故选用该药物浓度进行后续实验。
表1 木犀草素对Aβ25-35 损伤PC12 细胞活性的影响(±s,n = 6)Tab. 1 Effect of luteolin on the activity of PC12 cells injured by Aβ25-35(±s,n = 6)
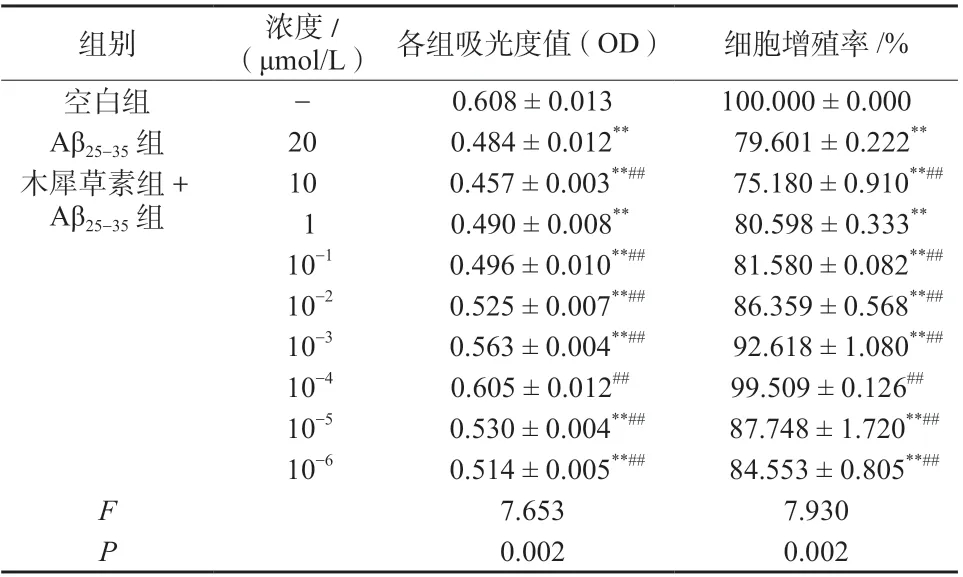
表1 木犀草素对Aβ25-35 损伤PC12 细胞活性的影响(±s,n = 6)Tab. 1 Effect of luteolin on the activity of PC12 cells injured by Aβ25-35(±s,n = 6)
注:与空白组比较,**P <0.01;与Aβ25-35 组比较,##P <0.01
组别 浓度/(μmol/L) 各组吸光度值(OD) 细胞增殖率/%空白组 - 0.608 ± 0.013 100.000 ± 0.000 Aβ25-35 组 20 0.484 ± 0.012** 79.601 ± 0.222**10 0.457 ± 0.003**## 75.180 ± 0.910**##1 0.490 ± 0.008** 80.598 ± 0.333**10-1 0.496 ± 0.010**## 81.580 ± 0.082**##10-2 0.525 ± 0.007**## 86.359 ± 0.568**##10-3 0.563 ± 0.004**## 92.618 ± 1.080**##10-4 0.605 ± 0.012## 99.509 ± 0.126##10-5 0.530 ± 0.004**## 87.748 ± 1.720**##10-6 0.514 ± 0.005**## 84.553 ± 0.805**##7.653 7.930 0.002 0.002木犀草素组+Aβ25-35 组F P
2.2 木犀草素对Aβ25-35 损伤PC12 细胞中ROS、MDA 及SOD 含量的影响
结果如表2 所示,与空白组相比,模型组ROS及MDA 的含量明显升高,SOD 活性降低(P <0.01);与模型组相比,木犀草素+Aβ25-35组ROS 及MDA 的含量降低,SOD 活性升高(P <0.01);与木犀草素+Aβ25-35组相比,木犀草素 + Aβ25-35+ LY294002 组ROS 及MDA 的含量升高,SOD 活性降低(P <0.01)。
表2 木犀草素对Aβ25-35 诱导PC12 细胞损伤中ROS、MDA 及SOD 含量的影响(±s,n = 3)Tab. 2 Effects of luteolin on the contents of ROS, MDA and SOD in PC12 cells injured by Aβ25-35(±s,n = 3)

表2 木犀草素对Aβ25-35 诱导PC12 细胞损伤中ROS、MDA 及SOD 含量的影响(±s,n = 3)Tab. 2 Effects of luteolin on the contents of ROS, MDA and SOD in PC12 cells injured by Aβ25-35(±s,n = 3)
注:与空白组比较,**P <0.01;与模型组比较,##P <0.01;与木犀草素+Aβ25-35 + LY294002 组比较,++P <0.01
SOD/(U/mgprot)空白组 100.000 ± 2.511 2.468 ± 0.312 56.254 ± 5.008 Aβ25-35 组 152.684 ± 6.301** 4.776 ± 0.421** 37.787 ± 6.901**木犀草素+Aβ25-35 组组别 Relative ROS content(% of control)MDA/(nmol/mgprot)120.367 ± 8.662## 2.801 ± 0.223## 49.669 ± 6.297##147.635 ± 7.634++ 4.569 ± 0.218++ 36.024 ± 5.448++40.559 45.507 7.914 0.000 0.000 0.009木犀草素+Aβ25-35 +LY294002 组P F
2.3 木犀草素对Aβ25-35 诱导PC12 细胞损伤中p-Akt、p-Tau 蛋白表达的影响
结果如表3 和图1 所示,与空白组相比,模型组p-Akt 的表达降低(P <0.01),p-Tau 含量升高(P <0.05);与模型组相比,木犀草素+ Aβ25-35组p-Akt 表达升高(P <0.01),p-Tau 的表达降低(P <0.05);与木犀草素+Aβ25-35组相比,木犀草素+Aβ25-35+ LY294002 组p-Akt 的表达降低(P <0.01),p-Tau 的含量升高(P <0.05)。
3 讨论
AD 是全世界老年人群中最普遍的痴呆形式,导致AD 发病的因素很多,其中Aβ 的聚集是最为突出的因素,被认为是AD 的典型特征[4]。有实验表明,雌激素替代疗法在AD 患者中有显著作用,但是雌激素也会产生不必要的副作用,如其对非神经细胞乳腺细胞和子宫内膜细胞有增殖和致癌作用[5]。因此,雌激素作为AD 治疗的使用是有限的,需要其它副作用较少的雌激素药物来开发替代治疗策略。植物雌激素是一类天然化合物,与雌激素具有结构相似性,并具有雌激素的生理和物理特性。且植物雌激素可以与雌激素受体(ER)相互作用,介导雌激素反应[6]。因此,植物雌激素在预防和治疗AD 作用机制中具有重要意义。
研究表明,PI3K/Akt 信号通路在阿尔茨海默病病理中起抗氧化作用,可在刺激ER 时被激活[7]。活化的PI3K 促进PI3K 下游激酶Akt 的活化,Akt通过刺激氧化代谢,促进线粒体耗氧并促进ROS积累。细胞内MDA 和SOD 是评价细胞或组织氧化应激水平的重要生物标志物。MDA 是ROS 诱导的膜脂过氧化产物,可导致膜损伤和破坏,而SOD 被认为是哺乳动物细胞的关键抗氧化酶[8]。因此,本研究检测了MDA、SOD 的含量。结果表明,木犀草素能显著降低Aβ 刺激的PC12 细胞中MDA 的含量,而增加SOD 的含量。流式细胞仪检测结果还表明,木犀草素能明显降低Aβ 刺激的PC12 细胞ROS 水平。提示AD 的发生与ROS、MDA 和SOD 的浓度有关,木犀草素通过降低MDA和ROS 的浓度,或通过增加SOD 发挥其神经保护作用。以上结果表明,木犀草素能明显减轻PC12细胞的氧化损伤。PI3K/Akt 通路在中枢和外周神经元中都起到抗氧化作用,这被认为是Aβ 诱导细胞损伤的细胞保护机制之一。Akt 是一种丝氨酸/苏氨酸激酶,是PI3K 信号传导的关键介质。在本研究中,木犀草素上调了p-Akt 的蛋白表达。结果表明,木犀草素可能是通过调节PI3K/Akt 通路从而对Aβ 诱导的PC12 细胞氧化损伤起到保护作用。已知Tau 蛋白过度磷酸化引起的神经元细胞死亡是阿尔茨海默病认知能力下降的主要原因。通过激活PI3K/Akt 途径,可降低在AD 脑中Tau 的过度磷酸化[9]。在本研究中,我们观察到Aβ25-35诱导PC12 细胞Tau高磷酸化在木犀草素处理后显著被抑制。结果表明,木犀草素可能通过抑制Tau 高磷酸化对Aβ 诱导的氧化损伤起到保护作用。本研究评估了木犀草素对Aβ诱导的PC12 细胞损伤的保护作用及其机制,PI3K/Akt 信号通路参与了氧化应激的过程,在抑制通路之后,变化结果倾向于保护过程是从此通路发生反应,进一步蛋白检测p-Akt、p-Tau 蛋白表达,从p-Akt的变化及组间对比证实之前的推论,Tau 蛋白结果表现出防止其磷酸化,从而达到保护作用。
表3 木犀草素对Aβ25-35 诱导PC12 细胞损伤中p-Akt、p-Tau 蛋白表达的影响(±s,n = 3)Tab. 3 Effect of luteolin on the expression of p-Akt and p-Tau protein in Aβ25-35 -induced PC12 cell injury(±s,n = 3)
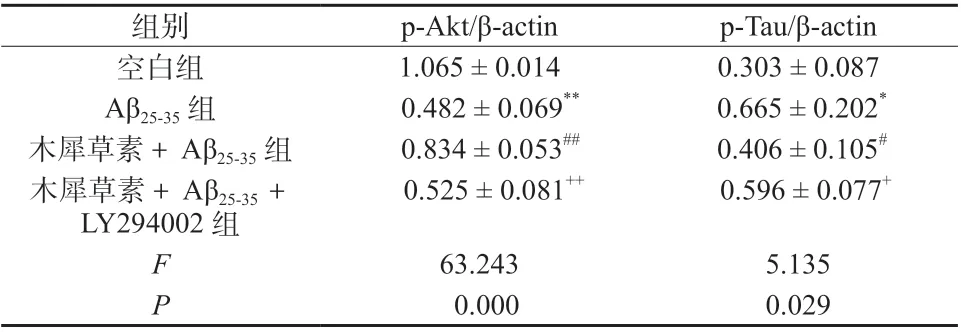
表3 木犀草素对Aβ25-35 诱导PC12 细胞损伤中p-Akt、p-Tau 蛋白表达的影响(±s,n = 3)Tab. 3 Effect of luteolin on the expression of p-Akt and p-Tau protein in Aβ25-35 -induced PC12 cell injury(±s,n = 3)
注:与空白组比较,**P <0.01,*P <0.05;与模型组比较,##P <0.01,#P <0.05;与木犀草素+ Aβ25-35 + LY294002 组比较,++P <0.01,+P <0.05
组别 p-Akt/β-actin p-Tau/β-actin空白组 1.065 ± 0.014 0.303 ± 0.087 Aβ25-35 组 0.482 ± 0.069** 0.665 ± 0.202*木犀草素+Aβ25-35 组 0.834 ± 0.053## 0.406 ± 0.105#0.525 ± 0.081++ 0.596 ± 0.077+63.243 5.135 0.000 0.029木犀草素+Aβ25-35 +LY294002 组F P
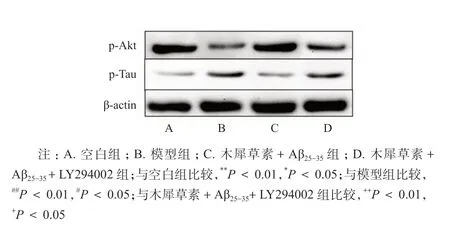
图1 木犀草素对Aβ25-35 诱导PC12 细胞损伤中p-Akt、p-Tau 蛋白表达的影响Fig. 1 Effect of luteolin on the expression of p-Akt and p-tau protein in Aβ25-35 -induced PC12 cell injury
4 结论
木犀草素可能通过激活PI3K/Akt 信号通路抑制氧化应激及Tau 蛋白的磷酸化发挥对Aβ25-35损伤PC12 细胞的保护作用。但作为体外实验,本实验结果可能具有一定局限性,木犀草素在动物模型中的神经保护作用有待进一步评估。本实验从分子角度出发,为木犀草素在AD 中的潜在应用提供了理论基础,同时为进一步研究木犀草素的神经保护作用提供实验依据。
