IVIM-DWI评估胶质瘤病理分级及Ki-67LI表达的应用研究
2021-05-21冯海霞安丽华
冯海霞 安丽华 顾 龙
1.济宁医学院附属医院影像科(山东 济宁 272029)
2.济宁市中医院放射科(山东 济宁 272000)
胶质瘤是颅内最常见的恶性肿瘤,死亡率较高。2016年WHO中枢神经肿瘤的分级标准将胶质瘤分为四级:Ⅰ、Ⅱ级为低级别胶质瘤(low grade gliomas,LGG),Ⅲ、Ⅳ级为高级别胶质瘤(high grade gliomas,HGG)。手术是根治胶质瘤的主要方法,但高级别的胶质瘤恶性度高,预后较差,需进行术后放化疗[1]。因此术前胶质瘤准确的分级对其采取合理的治疗方案及预后有重要价值。Ki-67是反映肿瘤细胞增殖活性及恶性程度、提示患者预后的标记物。史永志等[2]学者对18例脑胶质瘤的Ki-67进行研究发现,其表达程度分别在Ⅰ-Ⅳ级中呈上升趋势。
Le等[3]于1986年首次提出体素内不相干运动弥散加权成像(intravoxle incoherent motion diffusion-weighted imaging,IVIM)的概念,该序列基于双指数模型,应用10个左右的b值将水分子的真实弥散与微灌注区分开,获得微灌注相关参数D*值,真实扩散系数D值 及灌注分数f值。胶质瘤的微观结构及血管分布是病理分级的基础,本研究运用IVIM-MRI定量指标(D*、D及f值)探究肿瘤的微灌注及水分子扩散,进而对精确评估胶质瘤病理分级、制定合理的诊疗方案以及判断预后提供参考。
1 资料与方法
1.1 临床资料回顾性分析济宁医学院附属医院2017年11月至2019年1月行IVIM检查的30例患者,病理类型及分级根据2016版WHO中枢神经系统肿瘤分类标准,低级别组13例,Ⅰ级毛细胞星形胶质细胞瘤1例,Ⅱ级弥漫性星形胶质细胞瘤6例,Ⅱ级少突胶质细胞瘤2例,Ⅱ级混合胶质细胞瘤4例;高级别组17例,其中Ⅲ级间变型胶质细胞瘤10例,Ⅳ级多形性胶质母细胞瘤7例。男性13例,女性17例,年龄30~73岁,平均年龄(47.7±17.5)岁。
1.2 检查方法采用Siemens Magnetom Verio 3.0T MR扫描仪,头部八通道相控阵线圈。平扫FSE 序列;T1WI:TR 400~600ms,TE 15~20ms,T2WI:TR 1800~3000ms,TE 70~90ms;脂肪抑制T2WI序列:TR 2000~4500ms,TE 70~100ms,NEX 2;层厚5mm,层间距1mm,FOV 160~400mm,矩阵256×256。IVIM成像序列基于弥散加权的单次激发的平面回波脉冲序列,具体参数为T R/TE=2000ms/80ms,FOV 160~400mm,层厚5mm;矩阵为192×192,激励次数3。选取12个b值(0、10、20、40、80、130、200、400、700、1000、1200及1500s/mm2),扩散梯度场施加在相互垂直的X、Y、Z轴3个方向上,应用能覆盖全脑的匀场框以减小磁敏感伪影。增强扫描使用高压注射器经肘静脉团注对比剂Gd-DTPA,剂量0.1mmoL/kg,流率2~3mL/s,TR/TE=2150ms/24ms。30例患者均行MRI平扫及IVIM检查,其中28例行增强扫描。
1.3 图像处理及数据分析将IVIM-DWI以DICOM格式文件导出,并由Siemens公司提供的后处理软件进行分析,获得真性扩散系数D伪彩图、灌注分数f伪彩图,假性扩散系数D*伪彩图。对照T2WI高信号或增强扫描强化最明显的区域(避开血管、脑沟、出血、液化坏死及囊变区等),在同层面IVIM彩图上放置感兴趣区(region of interest,ROI),划取3个ROI,面积(30±5)mm2,并计算该区域的f、D及D*平均值。由两名影像诊断医师(三年及五年影像诊断工作经验)采用双盲法对IVIM参数进行测量,然后取两者测量的平均值。
1.4 组织病理学检查所有病例在切除后选用石蜡包埋病变组织,连续切片数张,一部分通过HE染色进行病理学检查,另一部分用S-P免疫组化染色用于Ki-67LI的计数,计数方法为:在400倍视野下,随机选择10个视野,计数500~1000个细胞,Ki-67阳性细胞为细胞核着色,呈棕黄或棕黑色,所计数的500~1000个细胞中阳性细胞百分率即为Ki-67LI。
1.5 统计学分析应用SPSS 17.0及MedCalc进行统计学分析,P<0.05有统计学意义。所有计量资料符合正态分布运用(±s),不符合正态分布采用中位数±四分位间距;对于所有计量资料两次测量的一致性运用ICC检验(ICC>0.80表示一致性较强,0.61~0.80表示一致性良好,0.41~0.60属于一致性一般,0.11~0.40属于一致性较低);高、低级别组胶质瘤的D值,f值及D*值的比较采用独立样本t检验及Mann-Whitney U非参数秩和检验。Ki-67LI与D值、f值及D*值的相关性运用双变量Spearson相关分析。各个参数的诊断效能运用受试者特性曲线及AUC进行评价。AUC值小于0.7、07~0.9、大于0.9依次提示低、中、高的诊断效能;AUC的比较采用Z检验。
2 结 果
2.1 IVIM各参数的一致性分析D、D*及f值两次测量的ICC分别为0.995、0982、0.996,一致性均较强。
2.2 LGG与HGG组间IVIM参数的差异性分析17例HGG及13例LGG的D、D*及f值差异性具有统计学意义(P<0.05),且HGG组的D值平均值小于LGG组,D*及f值大于LGG组。见表1和图1。

表1 LGG与HGG组间IVIM诸参数的差异性分析
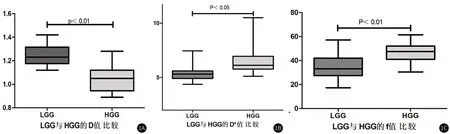
图1 D、D*及f值的箱图
2.3 IVIM各参数的鉴别诊断效能分析IVIM的D值的AUC为0.928(P<0.01),对于良恶性胶质瘤的鉴别诊断效能有统计学意义,敏感度为82.35%,特异度为92.31%,此时最佳阈值为1.12×10-3mm2/s,大于该值,考虑LGG可能性大,低于该值,则倾向于HGG。D*值的AUC为0.842(P<0.01),具有鉴别诊断效能,敏感度为82.35%,特异度为84.62%,此时最佳阈值为5.68×10-2mm2/s,即大于该值,考虑HGG可能性大,反之,则倾向于LGG。f值的AUC为0.835(P<0.01),具有鉴别诊断效能,敏感度为82.24%,特异度为69.23%,此时最佳阈值为38.7%,大于该值,提示HGG可能,小于该值,提示为LGG。D、D*及f值的AUC两两比较,差异不具有统计学意义,则表明三者均具有很好的鉴别诊断效能。见表2和图2。

表2 LGG组与HGG组IVIM诸参数的ROC曲线分析及AUC的比较
2.4 IVIM各参数与Ki-67LI的相关性分析LGG与HGG之间Ki-67LI差异具有统计学意义(P<0.05),D值与Ki-67LI呈负相关,相关系数r为-0.659(P<0.01);D*及f值均与Ki-67LI呈正相关,相关系数r依次为0.653、0.676(P<0.01)。见表3和图3。

表3 LGG与HGG组间的Ki-67LI的差异性分析
2.5 典型病例影像学分析影像学分析结果见图4~图5。
3 讨 论
3.1 真性扩散分数D值对胶质瘤分级的诊断D值主要反映肿瘤细胞外水分子的真实弥散运动。本研究中D值在高低级别胶质瘤中差异具有统计学意义,HGG组的D值平均值小于LGG组,与Lin等[4]、Togao等[5]学者的研究结果相一致,其病理基础为肿瘤恶性程度越高,细胞增殖速度越快,密集程度越高,细胞外水分子扩散受限程度越明显。此外徐蒙莱等[6]研究发现ADC值在HGG组及LGG组的差别无统计学意义,在两者间有很大的重叠,所以认为D值是在剔除低b值段快速扩散的影响后得到的细胞外真实水分子弥散,对于胶质瘤术前分级较ADC值更有价值。
3.2 灌注相关扩散参数D*值对胶质瘤分级的诊断价值胶质瘤大量的微血管形成是其病理分级的重要参考指标,即微血管数量越多,微循环越丰富,肿瘤恶性程度越高;D*值代表血液微循环灌注产生的扩散系数,且b值越低,所得D*值越精确;Shen等[7]研究表明D*与肿瘤内微血管密度(MVD)有关,而

图2 D、D*及f值的ROC曲线
且微血管密度同时表现在微血管数量及血流速度两个方面,从影像-病理对照的角度印证了D*值反映肿瘤微血供的价值。本研究中D*值在高低级别胶质瘤中差异具有统计学意义,HGG组的D值平均值大于LGG组,与曲源等[8]的研究结果相一致,其病理基础为胶质瘤肿瘤级别越高,微血管密度越高,血管壁通透性越高,流速更快,D*值越高。但Federau等[9]研究发现D*对高低级别胶质瘤无鉴别诊断价值,笔者认为D*值的这种不稳定性,可能是由b值的选择、脑脊液的搏动、图像信噪比及心动周期等多种因素造成的,期待进一步扩大样本量,尽可能排出多种影响因素后进一步确认其价值。

图3 IVIM各参数与Ki-67LI相关性分析


图4 女,43岁,左侧额叶少突胶质细胞瘤(WHOⅡ级)。图4A~图4B:T2WI呈高信号,增强扫描呈轻度强化;图4C:病灶在D图上呈高信号,值为1.16×10-3mm2/s;图4D:病灶于D*图上呈稍高信号,值为5.06×10-2mm2/s;图4E:图上病灶中央部分呈高信号,周围水肿区呈低信号,f值为29.2%;图4F:镜下肿瘤细胞密度增高,细胞核多呈类圆形,深染,核周空晕,核分裂象少见,周围有散在分支状血管(HE,×200);图4G:肿瘤细胞内少见棕黄或棕黑色颗粒,Ki-67约为0~5%。图5 女,65岁,左侧侧脑室后角旁多形性胶质母细胞瘤(WHOⅣ级)。图5A~图5B:左侧额颞叶病灶T1WI呈低信号,T2WI呈高信号,增强扫描呈环形强化;图5C~图5E:病灶于D、D*及f图上均呈高信号,D值为0.97×10-3mm2/s,D*值为6.53×10-2mm2/s,f值为47.4%;图5F:镜下肿瘤细胞排列紧密,细胞核大小不一,深染,可见核分裂象,可见瘤内血管及假栅栏状坏死(HE,×200);图5G:肿瘤细胞内多发棕黄或棕黑色颗粒,Ki-67约为20%-30%。
3.3 灌注分数f值对胶质瘤分级的诊断价值f值为灌注分数,是体素内微循环灌注效应所致的弥散在总体弥散效应中所占的比率,代表着肿瘤的血容量。理论上,胶质瘤级别越高,肿瘤血流灌注容量约大,f值越高。本研究中f值在高低级别胶质瘤中差异具有统计学意义,HGG组的D值平均值大于LGG组,但与Lin等[4]、Hu等[10]的研究结果相反,究其原因,f值易受TE时间、脑脊液和水肿的影响。因此,尽管在本研究中f值在胶质瘤分级中具有鉴别诊断价值,其稳定性仍需要进一步探究。
3.4 D、D*及f值对胶质瘤分级的诊断效能分析本研究D、D*及f值的ROC曲线下面积分别为0.928、0.842、0.835,对于良恶性胶质瘤的鉴别诊断效能均有统计学意义(P<0.01),其中D值的敏感度为82.35%,特异度为92.31%,此时最佳阈值为1.12×10-3mm2/s,大于该值,考虑LGG可能性大,低于该值,则倾向于HGG。D*值的敏感度与D值相同,为82.35%,特异度较D值低,为84.62%,此时最佳阈值为5.68×10-2mm2/s,即大于该值,HGG可能性大,反之,则倾向于LGG。f值的敏感度为82.24%,特异度为69.23%,两者均低于D与D*值,最佳阈值为38.7%,大于该值,提示HGG可能,小于该值,提示为LGG。D、D*及f值的AUC两两比较,差异不具有统计学意义,表明三者均具有很好的鉴别诊断效能,但根据其AUC数值及敏感度、特异度的数值比较,仍认为D值鉴别诊断价值更大,其次为D*值,最后为f值。
3.5 D、D*及f值对预测胶质瘤细胞增殖的诊断价值Ki-67是肿瘤细胞生长活跃程度的标志,是监测肿瘤细胞增殖活性的最可靠的指标,标记指数(Ki-67LI)数值越高,肿瘤的增殖活性越强,恶性程度(分级)越高,预后越差[11]。Yamashita等[12]对各级别的胶质瘤进行Ki-67免疫组化研究,结果显示低级别胶质瘤和高级别胶质瘤之间表达存在差异。Qu等[13]研究发现,32例LGG和24例HGG的Ki-67的阳性表达差异有统计学意义。本研究结果显示,Ki-67LI于高低级别胶质瘤中的差异性具有统计学意义,且HGG的L-67LI较LGG高。值得注意的是,有的高级别胶质瘤的Ki-67出现了低表达,而有的低级别胶质瘤中出现了Ki-67的高表达,究其原因可能是肿瘤异质性不同,病理取材时未能反映瘤内增殖最活跃的区域。此外,某些低级别胶质瘤有向高级别胶质瘤进展的趋势,因此会出现两者间的重叠。本研究还发现D值与KI-67LI呈中度负相关,D*及f值与KI-67LI呈中度正相关,因此IVIM诸定量参数可间接评估胶质瘤增殖细胞活性,进而判断其预后。其病理基础为随着细胞增殖活性增强,细胞密度增加、排列紧密,水分子的弥散明显受到限制,D值就相应减小,因此与KI-67LI呈负相关。肿瘤增殖活跃,微小血管生成增多,使D*及f值增大,因此与KI-67LI呈正相关。
本研究还存在几个不足之处:(1)本实验的样本量相对较小,样本数据有偏差,Ⅰ级及IV级的患者数量过少,故而未能对Ⅰ~Ⅳ期进行严格分期对照研究,期望在未来的研究中,继续增大样本量。(2)b值的选择缺乏统一的标准,现如今国内外学者运用多b值的IVIM对多系统肿瘤进行定量分析,但仍没有制定出统一标准,本研究中12个b值中因考虑扫描时间问题,高b值数量较少,可能存在研究结果的偏倚,现课题组研究者们正探索不同配置的b值的IVIM序列在胶质瘤中的应用。(3)缺乏影像-病理的精确对照分析,本研究在测量影像数值时未能与病理切片进行点对点对照,期待以后在影像-病理精确对照分析上进行探究。
综上所述,IVIM的参数D、D*及f值可定量评价胶质瘤术前病理分级及肿瘤细胞增殖活性,进而评估其预后。
