扩散峰度成像在评估宫颈癌病理类型及分化程度中的价值
2021-05-21陈静曹雷顾红梅
陈静,曹雷,顾红梅
宫颈癌的治疗首选宫颈癌根治术,宫颈癌国际妇产科联盟(international federation of gynecology and obstetrics,FIGO)提出FIGO分期中ⅡB期及更高分期的患者,一般采用非手术治疗方法[1],对于不能进行根治手术的宫颈癌患者,通过活检获得病理学资料,但由于肿瘤异质性等原因常难以获得精确的组织病理学类型及肿瘤分化程度,对于不同病理类型及分化程度的宫颈癌,其治疗及疗效存在差异,宫颈癌的病理分化等级是判断宫颈癌侵袭及转归的可靠及重要因素,宫颈癌病理类型的判断对治疗与预后的评估尤为重要[2-3]。因此,积极寻求影像学方法判断宫颈癌的病理类型及病理分化程度对宫颈癌的治疗具有重要意义。有学者报道DWI定量参数值与宫颈鳞癌的高中低分化呈负相关,并且宫颈鳞癌与宫颈腺癌的表观扩散系数(apparent diffusion coefficient,ADC)值差异有统计学意义[4]。近年来,以非高斯分布为基础的扩散峰度成像(diffusion kurtosis imaging,DKI)发展迅速,广泛应用于各系统,如肝脏、直肠以及肾脏等[5-7]。有研究报道人体组织结构中水分子扩散极为复杂,ADC值除了受生理、病理因素的影响外,还受外部的磁共振扫描硬件与软件的影响,如扫描机型、序列及参数等,为了消除这些影响,引入了相对表观扩散系数(relative apparent diffusion coefficient,rADC),使ADC标准化[8]。并且有研究证实,ADC与rADC值有潜力反映宫颈癌的病理分级[9]。此前有学者应用DKI相关参数相对平均扩散峰度(relative mean kurtosis,rMK)、相对平均扩散率(relative mean diffusion,rMD)对WHOⅡ级脑胶质瘤IDH基因分型进行预测研究[10]。本研究引入DKI的参数平均扩散峰度(mean kurtosis,MK)、平均扩散系数(mean diffusion,MD)及rMK、rMD,进一步研究DKI参数与宫颈癌病理类型及分化程度的关系。
材料与方法
1.病例资料
回顾性搜集2018年7月-2019年2月以及2019年9月-2020年5月在本院行磁共振检查并加扫DKI序列的宫颈癌患者61例,患者检查前未进行任何治疗,检查后10天内进行了宫颈癌根治术,于术后获得了明确的完整病理结果,部分患者进行了免疫组化检查。
2.检查方法
MRI检查采用GE 3.0T Discovery MR750超导型磁共振扫描仪,腹部32通道相阵控线圈,使用腹带以减少呼吸运动伪影。患者检查时取仰卧位,脚先进,呼吸保持自然放松的状态。常规扫描标准序列扫描参数:横轴面T1WI,TR 522 ms,TE 22.4 ms,视野340 mm×340 mm,矩阵320×256,层厚/层间距5 mm/1 mm,层数22,激励次数1;横轴面T2WI,TR 3275 ms,TE 85 ms,视野280 mm×280 mm,矩阵288×244,层厚/层间距5 mm/1 mm,层数22,激励次数4;矢状面FSE T2WI,TR 2587 ms,TE 85 ms,视野260 mm×260 mm,矩阵320×256,层厚/层间距5 mm/1 mm,层数17,激励次数3;冠状面T2WI,TR 2587 ms,TE 85 ms,视野260 mm×260 mm,矩阵320×260,层厚/层间距5 mm/1 mm,层数22,激励次数3。DWI检查采用平面回波(echo planar imaging,EPI)序列轴面成像,TR 6163 ms,TE 102 ms,视野360 mm×360 mm,矩阵128×128,层厚/层间距5 mm/1 mm,层数24,激励次数1、8,扩散敏感梯度b值取0、800 s/mm2。DKI检查采用EPI序列轴面成像,TR 2351 ms,TE 87.7 ms,视野380 mm×380 mm,矩阵128×128,层厚5 mm,无间距扫描,扩散敏感梯度b值取0、400、800、1200、1600、2000 s/mm2,激励次数依次为1、2、2、2、2、2,扫描层数根据子宫及宫颈的大小而异,在15~20层之间,共15个扩散方向。DKI的扫描时间总计约5分30秒至7分30秒,DKI检查利用饱和带减少膀胱、直肠带来的磁场不均或运动伪影。
3.图像后处理
将DKI图像传输到GE AW4.6后处理工作站,利用DKI软件对图像进行后处理。在DKI图像上选取肿瘤瘤体实质部分面积最大的层面勾画感兴趣区(region of interest,ROI),避开大血管、坏死、囊变、出血及边缘区等,同时在正常子宫体部肌层组织中勾画ROI,后处理软件自动生成DKI参数,包括平均扩散率、平均扩散峰度。勾画3个ROI取平均值,同时获得各参数相应伪彩图。rMK=宫颈癌MK/正常子宫肌层MK,rMD=宫颈癌MD/正常子宫肌层MD。
4.统计学分析
采用SPSS 21.0及Medcalc软件进行统计学分析。对所有计量资料进行正态性检验,符合正态分布者以均值±标准差表示,不符合正态分布者以中位数和四分位数间距表示。因高分化鳞癌与中-低分化鳞癌病例数较少,分别与中分化、低分化宫颈鳞癌合并为一组进行统计学分析。采用独立样本t检验(正态分布)或非参数检验(非正态分布)比较不同病理类型及病理分化程度(高/中分化与中-低/低分化鳞癌)间各DKI参数的差异。各参数与病理分化程度的相关性分析采用Spearman秩相关检验(相关系数r为0.000~0.300表示弱相关,0.30~0.500表示中度相关,0.501~1.000表示强相关)。采用受试者工作特征(receiver operating characteristic,ROC)曲线分析各参数对不同病理类型及病理分化程度宫颈癌的鉴别诊断效能,并确定最佳阈值。以P<0.05为差异有统计学意义。
结 果
61例宫颈癌患者中,宫颈腺癌10例,宫颈鳞癌51例,其中高分化鳞癌3例、中分化鳞癌19例、中-低分化鳞癌5例、低分化鳞癌24例。患者年龄范围为29~78岁。宫颈癌在DKI上表现为高信号,并且随着b值增加,肿瘤实质的信号增高,与周围正常组织低信号对比更明显,囊变及坏死液化区的信号减低(图1a)。在MK伪彩图上,宫颈癌表现为高于周围正常组织的相对高信号(图1b);在MD伪彩图上,宫颈癌表现为低于周围正常组织的相对低信号(图1c)。
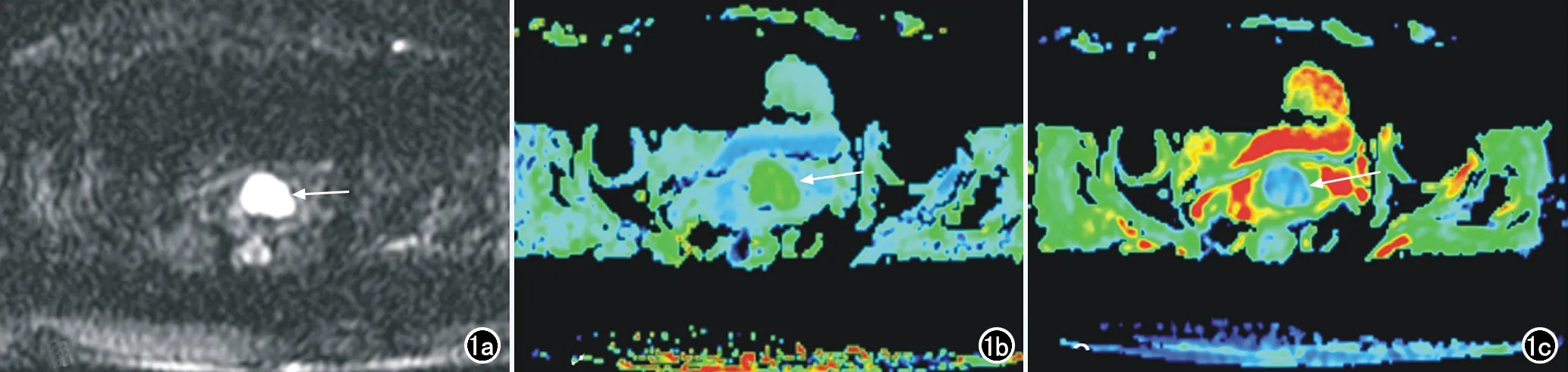
图1 宫颈癌患者,女,62岁。a) DKI图示病灶呈明显高信号(箭); b) MK伪彩图,宫颈癌病灶表现为高于周围正常组织的相对高信号(箭); c) MD伪彩图,宫颈癌表现为低于周围正常组织的相对低信号(箭)。
宫颈腺癌的MK、rMK、MD、rMD值分别为0.72±0.05、1.27±0.09、(1.17±0.10)×10-3mm2/s、0.90±0.07,宫颈鳞癌的MK、rMK、MD及rMD值分别为0.89±0.15、1.47±0.10、(1.05±0.12)×10-3mm2/s、0.81±0.08,宫颈腺癌的MK、rMK值低于宫颈鳞癌,MD、rMD值高于宫颈鳞癌,差异均具有统计学意义(P值均<0.05,表1)。通过ROC曲线分析各参数对宫颈鳞癌与腺癌的鉴别诊断效能(图2),MK、rMK、MD及rMD鉴别诊断不同病理类型宫颈癌的曲线下面积(area under the curve,AUC)、阈值、敏感度、特异度见表2。MK、rMK、MD及rMD鉴别不同病理类型宫颈癌的AUC两两相互比较,差异均无统计学意义(P值均>0.05)。
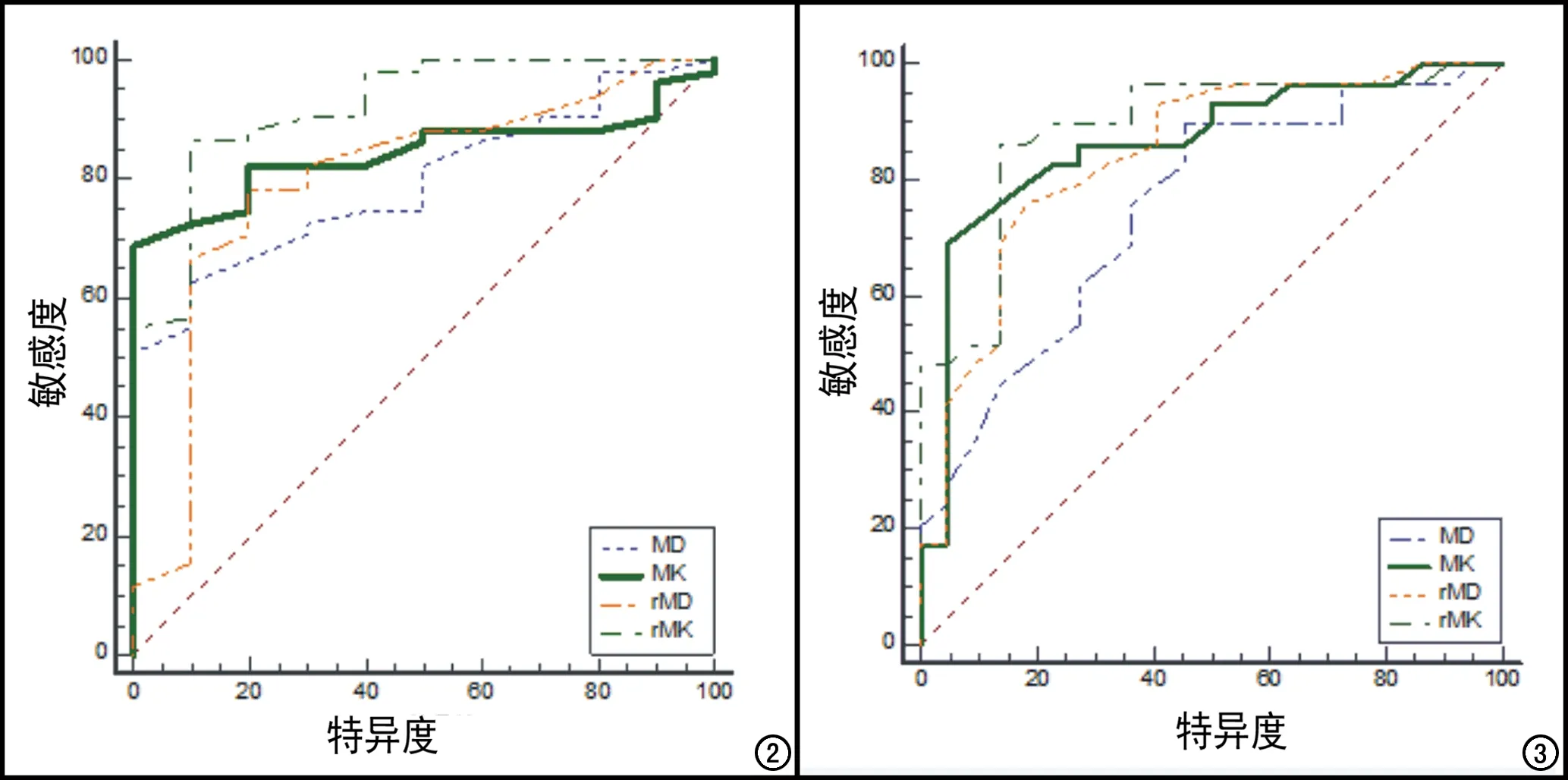
图2 DKI各参数鉴别不同病理类型宫颈癌的ROC曲线。 图3 DKI各参数鉴别不同病理分化程度宫颈鳞癌的ROC曲线。

表1 宫颈腺癌与鳞癌各DKI参数比较结果
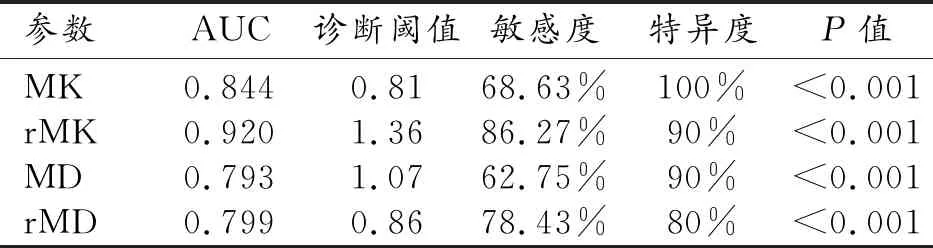
表2 鉴别不同病理类型宫颈癌的ROC曲线分析结果
高/中分化鳞癌的MK、rMK、MD、rMD值分别为0.79±0.11、1.39±0.08、(1.12±0.12)×10-3mm2/s、0.86±0.06,中-低/低分化鳞癌的MK、rMK、MD、rMD值分别为0.97±0.12、1.52±0.08、(1.01±0.11)×10-3mm2/s、0.77±0.08,高/中分化鳞癌的MK、rMK值低于中-低/低分化鳞癌,而MD、rMD高于中-低/低分化鳞癌,差异均具有统计学意义(P值均<0.05,表3)。通过ROC曲线分析各参数对不同分化程度宫颈鳞癌的鉴别诊断效能(图3),MK、rMK、MD及rMD鉴别诊断不同分化程度宫颈鳞癌的AUC、阈值、敏感度、特异度见表4。MK、rMK、MD及rMD鉴别不同分化程度宫颈鳞癌的AUC两两相互比较,仅MD与rMD之间差异具有统计学意义(P=0.036),其余差异均无统计学意义(P值均>0.05)。
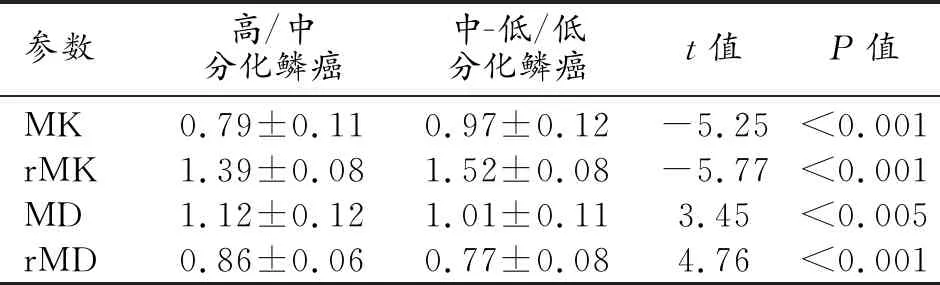
表3 高/中分化鳞癌与中-低/低分化鳞癌的DKI参数比较结果
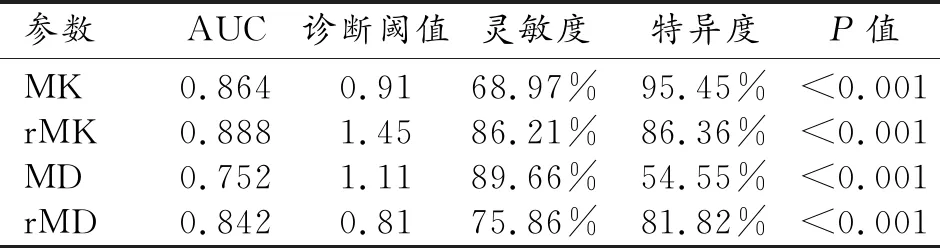
表4 鉴别不同分化程度宫颈鳞癌的ROC曲线分析结果
Spearman相关性分析结果显示,DKI参数MK及rMK与宫颈鳞癌的分化程度呈显著正相关,相关系数(r)分别为0.626及0.666,MD及rMD与宫颈鳞癌的分化程度呈显著负相关,相关系数分别为-0.434及-0.588(表5)。
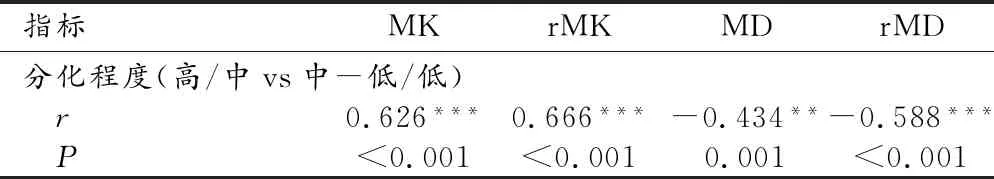
表5 宫颈鳞癌不同分化程度与DKI定量参数的相关性分析结果
讨 论
本研究中rMK值及rMD值是由宫颈癌患者的肿瘤MK或MD值除以宫颈癌患者的正常体部肌层组织的MK或MD值,而不是选用宫颈癌患者的肿瘤MK或MD值除以其他受试者正常宫颈组织的MK或MD值,是因为有研究证实宫颈癌组织与正常宫颈组织、正常子宫体部肌层的灌注及扩散存在很大差异,而正常宫颈组织与子宫体部肌层的灌注及扩散相似[11]。选取宫颈癌患者的子宫体部肌层主要是为了避免年龄、个人体质及其他环境因素带来的个体差异,以及减少前期工作量。
新兴的DKI技术是以非高斯分布为基础,较传统的DWI能更准确地监测水分子在人体内的扩散运动受限情况,真实地反映人体组织结构的复杂性,为临床提供更有效的信息[12]。宫颈鳞癌是宫颈恶性肿瘤中最常见的类型,其次为宫颈腺癌,腺鳞癌最少。本研究发现宫颈鳞癌的MK及rMK值高于宫颈腺癌,而MD、rMD值与之相反,且差异均具有统计学意义,这与闫坤等[13]的研究结果一致。早期有研究证实DWI在鉴别宫颈癌病理类型中有一定价值[14,15]。笔者分析出现以上结果的主要原因包括:①鳞癌细胞排列密集,细胞密度较腺癌明显增高,导致细胞外空隙较小,水分子扩散受限较为严重[16]。并且细胞密集程度越高伴随着细胞复杂性的升高,细胞器增多,进一步限制水分子扩散[17];②腺癌内存在腺样管结构,存在腺体分泌及导管引流等运动对水分子扩散产生影响;③有研究报道宫颈腺癌的微血管密度要比宫颈鳞癌密集,血管通透性也要高于鳞癌[18],这也会直接影响水分子的扩散运动。
本研究结果显示高/中分化宫颈鳞癌组的MK值及rMK值低于中-低/低分化组,而高/中分化组的MD值及rMD值高于中-低/低分化组,并且差异均有统计学意义(P值均<0.05);MK及rMK值与宫颈鳞癌分化程度呈正相关,MD及rMD值与宫颈鳞癌分化程度呈负相关。这与很多研究的结果相似:Yamada等[19]研究DKI与子宫内膜癌病理特征的关系,发现高级别子宫内膜癌的K值明显高于低级别子宫内膜癌,D值与之相反;Sun等[20]研究证实了高级别乳腺癌较低级别乳腺癌有更高的MK值及更低的MD值,MK值与浸润性乳腺癌的组织学分级呈正相关,MD值与浸润性乳腺癌的组织学分级呈负相关。低分化宫颈鳞癌之所以具有较高的MK及rMK值,较低的MD及rMD值,可能与以下因素有关:①低分化宫颈鳞癌的肿瘤细胞过度增殖,细胞密度大,细胞间空隙缩小,水分子扩散受限严重[21];②低分化宫颈鳞癌细胞密集,其内微血管受压,血流减慢,微循环灌注减少,影响水分子扩散速率;③分化程度越低的宫颈鳞癌细胞异型性越大,细胞内的核浆比也会升高,随之而来的是细胞内细胞器增多,细胞内水分子扩散受限严重;④低分化宫颈鳞癌细胞密集,异型性大,细胞器增多,膜性结构增多,膜性结构在一定程度上限制水分子的扩散运动;⑤低分化宫颈鳞癌的组织结构复杂,内部存在出血、坏死、囊变等,影响水分子运动的因素较分化程度高的宫颈鳞癌多。
本研究结果显示DKI在宫颈癌病理类型鉴别及宫颈鳞癌的分化程度评估中具有一定价值。本研究存在以下局限性:样本量较小;宫颈癌病理类型单一,宫颈腺癌仅有10例,并且这10例宫颈腺癌大部分为低分化与中-低分化,所以未对宫颈腺癌的病理分化程度与DKI相关参数之间的关系进行研究;本研究中高分化宫颈鳞癌及中-低分化宫颈鳞癌病例数太少,未能对宫颈鳞癌分化程度与DKI相关参数之间的关系进行细化研究。本研究中ROI均选择了肿瘤的中心部位,剔除了肉眼可见的出血、囊变、坏死等部位,未能进行整个肿瘤的测量,对于异质性较大的肿瘤所测得的参数值可能存在一定偏差。DKI在评估宫颈癌病理类型及分化程度中的价值仍需进一步细化研究。
