天门冬离体快繁技术
2021-05-20张明生彭思静吴尚浇于晓松杨朝雄
李 林,李 扬,张明生*,彭思静,吴尚浇,贾 娜,刘 智,于晓松,杨朝雄
(1.贵州大学生命科学学院 / 山地植物资源保护与种质创新教育部重点实验室,贵州 贵阳 550025;2.贵州仙草农业集团有限公司,贵州 贵阳550081)
天门冬(Asparagus cochinchinensis)为百合科(Liliaceae)天门冬属(Asparagus)多年生攀缘状亚灌木,又名天冬草、武竹等[1]。天门冬以干燥块根入药,是传统大宗药材之一[2—4],其性寒、味甘微苦,归肺、肾经;具有养阴润燥,清肺生津的功效;用于肺燥干咳、顿咳痰黏、腰膝酸痛、骨蒸潮热、内热消渴、热病津伤、咽干口渴、肠燥便秘等症[5]。天门冬虽然广泛分布于我国中部、西北、长江流域及南方各地,但因天然种子产量低,种皮坚硬致密、萌发困难,故自然种群极小,多呈零星分布[6—8],加之长期人为掠夺式采挖,致其野生资源日渐稀少,远不能满足药材市场需求,亟需进行人工种植[9]。优质种子种苗繁育是中药材规模化种植的关键环节,因此天门冬优质种苗的组培快繁是实现其药材规范化、规模化生产的有效途径之一[10]。本研究以天门冬种子无菌萌发的胚轴为材料,通过愈伤组织诱导、丛生芽诱导分化与增殖、试管苗壮苗生根与炼苗移栽等适宜培养条件的探索,初步建立其种苗繁育技术,以期为构建天门冬药材产业化技术体系奠定基础。
1 材料与方法
1.1 材料
天门冬种子来自贵州省务川仡佬族苗族自治县天门冬生产基地。
1.2 方法
1.2.1 愈伤组织诱导与增殖
以无菌萌发25 d的天门冬种子胚轴为外植体,分别接种于10种培养基(处理)(表1),每处理接种3瓶,每瓶接种5个外植体,重复3次,培养14 d后统计愈伤组织诱导率。以5 mm2愈伤组织小块为外植体,设置 NAA (0、1.0、2.0、2.5 mg·L-1)、6-BA (0、0.5、1.0 mg·L-1)的生长调节物质组合实验,共7个处理(表2),每处理接种3瓶,每瓶接种5个外植体,重复3次,培养20 d后统计愈伤组织增殖倍数。
除特别说明外,培养基均以MS为基本培养基,添加琼脂 6.5 g·L-1,蔗糖 30 g·L-1,pH 5.8~6.0,培养条件均为培养温度(25±2) ℃,光照强度2000 lx,光照时间 12 h·d-1。
1.2.2 丛生芽诱导
以增殖后的愈伤组织1.0 mm2小块为外植体,采用 L9(34)正交试验设计,设置 6-BA (0.2、0.5、0.7 mg·L-1)、NAA (0.1、0.2、0.3 mg·L-1)、KT (0.1、0.2、0.3 mg·L-1)三因素三水平,共 9个处理(表 3),每处理接种3瓶,每瓶接种5个外植体,重复3次,培养21 d后统计丛生芽诱导率。
1.2.3 无根苗诱导与壮苗培养
以上述丛生芽为外植体,设置IAA (0、0.5、1.0、1.5 mg·L-1)与 6-BA (0、0.1、0.2、0.3 mg·L-1)组合实验,共9个处理(表4),每处理接种3瓶,每瓶接种5个外植体,重复3次,培养21 d后统计无根苗诱导及其生长情况。
1.2.4 生根培养
选生长健壮、高5 cm左右的无根苗,采用不同基本培养基(MS、1/2MS、1/4MS)与NAA (1.0、2.0、3.0 mg·L-1)组合处理(表5),每处理接种3瓶,每瓶接种5棵,重复3次,35 d后统计生根率和生根数。
1.2.5 炼苗移栽
生根培养40 d后,选择根系较发达、高5~7 cm的天门冬试管苗打开培养瓶瓶盖,置于室温下炼苗(期间适当喷雾维持一定环境湿度)。3 d后将苗取出,用自来水洗净根部培养基后移栽至泥炭土:蛭石(2:1)混合基质,浇透水。小拱棚覆膜保湿,7 d后揭开薄膜,喷雾保湿,30 d后统计组培苗成活率。
1.2.6 数据统计分析
采用SPSS 17.0对数据进行方差分析、LSD多重比较等。统计中涉及的项目计算公式如下:
愈伤组织诱导率=(诱导产生愈伤组织的外植体个数/接种数)×100%
愈伤组织增殖倍数=增殖后愈伤组织鲜重/接种愈伤组织鲜重
丛生芽诱导率=(诱导出5个及5个以上芽的个数/接种数)×100%
平均苗高=(最高苗高+最低苗高) /2
生根率=(生根外植体数/接种数)×100%
平均生根数=生根总数/生根外植体数
试管苗成活率=(成活苗株数/移栽试管苗株数)×100%
2 结果与分析
2.1 天门冬愈伤组织诱导的适宜培养基
以天门冬种子无菌萌发的胚轴为外植体(图 1:a),按表1处理组合筛选适宜的愈伤组织诱导培养基(图1: b)。结果表明,单独添加6-BA不能诱导无菌胚轴产生愈伤组织,而NAA和6-BA组合对提高愈伤组织诱导率有显著效果。当NAA浓度一定时,随着6-BA浓度增加,愈伤组织诱导率先提高后降低,6-BA浓度为1.0 mg·L-1时愈伤组织诱导率显著高于其他两个浓度。处理 A2的愈伤组织诱导率与处理 A5差异不显著,但其愈伤组织生长状况差异较大,前者愈伤组织量较少、易分化,接种于增殖培养基中增殖慢、易褐化,生长势较弱;处理 A5的愈伤组织量较大(图1: c),虽有少量分化转绿,但转移至增殖培养基中增殖较快、生长势强(图1: d)。因此,适于天门冬愈伤组织诱导的培养基为 MS +6-BA 1.0 mg·L-1+ NAA 0.5 mg·L-1,诱导率为 95.6%。

表1 不同浓度NAA和6-BA对愈伤组织诱导的影响Table 1 Effects of different concentrations of NAA and 6-BA for callus induction

图1 天门冬愈伤组织诱导、分化和植株再生Fig. 1 Callus induction and differentiation and plant regeneration of A. cochinchinensis
2.2 天门冬愈伤组织增殖的适宜培养基
将天门冬愈伤组织切成小块,接入表2处理组合的增殖培养基培养。结果表明,单独添加 6-BA或NAA均能使天门冬愈伤组织增殖(处理B2、B3、B7),但效果较差,且单独添加NAA时愈伤组织周围可分化产生不定根。当 NAA 浓度为 1.0 mg·L-1时,愈伤组织增殖较快,颜色翠绿,质地较为紧实且很快分化出芽(处理 B1和 B4);6-BA 浓度为0.5 mg·L-1、NAA 浓度为 2.0 mg·L-1(处理 B5)的愈伤组织增殖倍数最高(9.7),黄绿色、质地较疏松、增殖快而分化晚,适于后期继续培养诱导丛生芽(图1: d);NAA浓度增至2.5 mg·L-1时,愈伤组织增殖倍数下降,其边缘及表面逐渐老化、褐化(处理B6)。因此,适于天门冬愈伤组织增殖的培养基配方为MS + 6-BA 0.5 mg·L-1+ NAA 2.0 mg·L-1。

表2 不同浓度6-BA和NAA对愈伤组织增殖的影响Table 2 Effects of different concentrations of 6-BA and NAA for callus proliferation
2.3 天门冬丛生芽诱导的适宜培养基
将增殖的天门冬愈伤组织切成小块接入丛生芽诱导培养基,约10 d后出现白色芽点,14 d后淡黄色愈伤组织上诱导出较多丛生芽,颜色逐渐变绿,生长势强(图1: e),28 d后丛生芽快速增殖、加粗变长,颜色翠绿(图1: f)。随后,根据文献[10—12]筛选出对丛生芽诱导分化有重要影响的因素设计正交试验(表3)。以丛生芽诱导率为指标,培养基中各成分对丛生芽诱导率影响作用依次为6-BA>KT>NAA,随着6-BA浓度增加,丛生芽诱导率先上升后下降,6-BA 浓度为 0.5 mg·L-1时诱导率较高(处理 C4~C6),根据正交试验,适于天门冬丛生芽诱导的培养基配方为 MS + 6-BA 0.5 mg·L-1+ NAA 0.1 mg·L-1+KT 0.1 mg·L-1。

表3 不同浓度6-BA、NAA和KT对丛生芽诱导的影响Table 3 Effects of different concentrations of 6-BA, NAA and KT for cluster buds induction
2.4 天门冬壮苗的适宜培养基
将诱导 28 d的丛生芽转至不同壮苗培养基培养。从表4可以看出,9个不同处理的幼苗生长情况差异较大,不添加任何植物生长调节物质的培养基中丛生芽几乎停止生长,不分化成苗,茎逐渐玻璃化而死亡(处理D1)。单独添加6-BA或IAA均能促进丛生芽生长,但二者效果差异较大。单独添加6-BA时,芽苗茎粗而矮,且腋芽不能分化形成枝叶(处理D2~D4);而单独添加IAA时,芽苗茎细长,且腋芽可分化成枝叶,但生长势弱(处理D5~D7)。当同时添加6-BA和IAA时,芽苗茎粗而长、分枝多,但以 6-BA 0.2 mg·L-1、IAA 1.0 mg·L-1较为适宜(处理D8),培养7 d后丛生芽明显长高长粗并分化成幼苗,21 d后幼苗的茎节上出现腋芽并逐渐分枝形成细叶,幼苗生长势强,色泽翠绿(图1: g)。因此,适于天门冬组培壮苗的培养基配方为 MS + 6-BA 0.2 mg·L-1+ IAA 1.0 mg·L-1。

表4 不同浓度IAA和6-BA对幼苗生长的影响Table 4 Effects of different concentrations of IAA and 6-BA for shoots growth
2.5 天门冬生根的适宜培养基
从表5可知,不同培养基诱导生根的效果差异较大,添加NAA能促进试管苗生根,随着NAA浓度增加,生根率先增后降(处理E3~E5)。无机盐浓度对试管苗生根的数量和质量均有一定影响,生根数为1/4MS>1/2MS>MS;MS中试管苗生根慢,主根短,侧根少,幼苗叶片出现白化,长势差,移栽成活率低(处理E2);1/2MS中试管苗生根快,主根较长,侧根多且韧性强,幼苗长势好,移栽成活率高(处理E3~E5);1/4MS中试管苗生根稍慢,主根和侧根均纤细、易脆,幼苗生长势较弱,移栽成活率较低(处理E6)。综合比较得出,天门冬试管苗适宜的生根培养基配方为1/2MS+NAA 2.0 mg·L-1,用该培养基培养天门冬无根苗10 d后苗基部出现突起,个别苗龄较大的幼苗开始生根,继续培养35 d后形成完整根系(图1: h, i),生根率为84.4%,经炼苗后移栽成活率达88.3%,植株生长健壮(图1: j)。
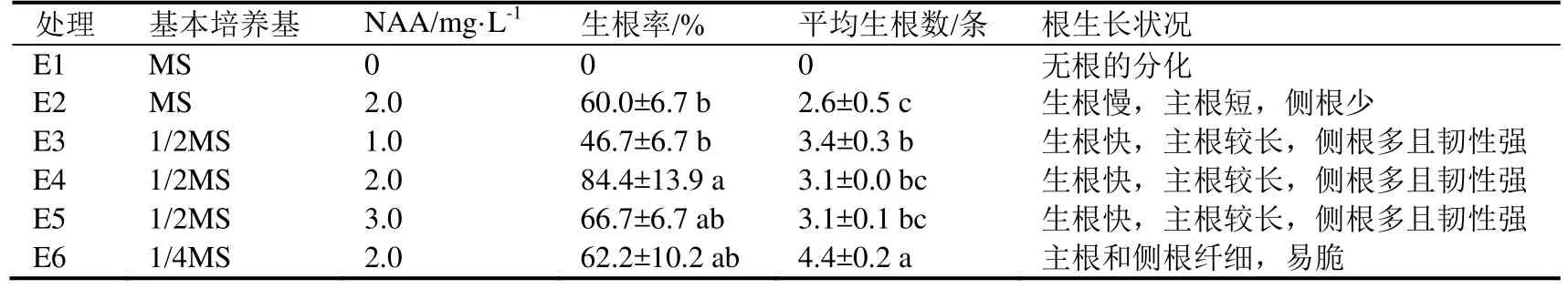
表5 不同基本培养基和NAA浓度对试管苗生根的影响Table 5 Effects of different basic media and NAA concentrations for test-tube plantlets rooting
4 讨论
外植体的选择是影响组培快繁成功与否的重要因素。天门冬为多年生攀缘状亚灌木,虽有报道其一年生茎、叶和芽作为外植体可诱导愈伤组织和建立植株再生体系[10],但实际上十分困难,效果不理想,至今也未能真正实现天门冬规模化的种苗繁育。对以营养器官作外植体难以建立其组培快繁体系的物种,尝试用种子胚性组织诱导愈伤组织,以此再分化形成胚状体或丛生芽,并进一步发育成再生植株,是一种有效途径,本研究即是以此途径较为成功地建立了天门冬的离体快繁技术。
天门冬种子表面光滑,质地坚硬[11],表面消毒容易[12],但必须以强酸处理种子方能吸胀萌动获得具有活力的胚性组织。在植物组织培养中,外植体剪切伤口过大易导致外植体褐化和白化死亡[13],天门冬组培快繁也是如此。研究发现,不同种类、不同配比的植物生长调节物质对植物组培快繁各个环节均有明显影响,适宜的6-BA与NAA组合有助于愈伤组织诱导与增殖,6-BA与较低浓度 NAA和KT组合,能有效促进愈伤组织分化丛生芽[14—15],6-BA与IAA组合可提高芽的生长势[16]。天门冬种苗快繁中,丛生芽诱导增殖是最关键的环节,与全妙华等[12]的方法相比,本研究通过对 6-BA、KT、NAA的合理组合获得较高的丛生芽诱导率。在壮苗培养过程中,6-BA能促进主茎变粗,茎上出现明显腋芽,但不易分枝长叶,而IAA可促进腋芽分枝并长出细叶,两种生长调节剂配合使用,能有效促进丛生芽生长成苗,并提高生根率和移栽成活率。NAA、较低浓度无机盐的MS基本培养基对天门冬生根有利。
