超声法制备铜纳米簇并应用于谷胱甘肽检测
2021-05-19张雨婷高鹏飞李天栋双少敏张彦
张雨婷,高鹏飞,李天栋,2,双少敏,张彦*
(1.山西大学 化学化工学院,山西 太原 030006;2.浙江传化智联股份有限公司,浙江 杭州 311215)
0 引言
金属纳米簇是一种尺寸小于2 nm的超小纳米粒子,因其荧光性能强、Stocks位移大、光稳定性和水溶性好、抗光漂白能力强等优点,纳米粒子合成和表征引起了诸多关注[1-3]。由于金属纳米簇的粒径一般小于2 nm,表面能非常大,易团聚成不发光的大颗粒,因此,制备稳定性好的金属纳米簇有十分重要的科学意义。与金银等贵金属纳米簇相比,铜纳米簇有着不可比拟的价格优势,并且电化学性能好,荧光性强,生物相容性良好[4-9]。铜纳米簇作为一类新型的光致发光和纳米催化材料,在光致发光分析,生物探针成像和催化等领域越来越受到广泛的关注,是一类较为理想的金属纳米簇材料。目前已有采用脱氧核糖核酸(DNA)、肽、蛋白质、小分子配体和聚合物等作为模板制备铜纳米簇的文献报道。如:Mao等将DNA先在90oC加热10 min后,加入硫酸铜和抗坏血酸还原剂在25oC下孵育15 min制备得到铜纳米簇[10]。Luo等以谷胱甘肽作为还原剂和配体保护剂,在生理温度(37oC)下,1 h内合成了铜纳米簇[11]。Wang等采用牛血清白蛋白作为稳定剂,水合肼作为还原剂,制备了水溶性好的荧光铜纳米簇[12]。Li等利用腐殖酸作为还原剂和稳定剂,在600oC下反应2 h合成稳定的铜纳米簇[13]。Wang等以抗坏血酸作为还原剂,制备了聚乙烯吡咯烷酮负载的铜纳米簇[14]。但是目前已报道的方法需要在加热条件下进行,或者需要加入水合肼、抗坏血酸等还原剂,获得环保、绿色、简单的化学合成方法一直都是研究者努力的方向。超声法具有效率高,仪器要求低,成本低廉以及处理时间短,因此被认为是新型“绿色”技术[15]。2-巯基-5-苯并咪唑磺酸钠(MBISA)是一种带有巯基基团和咪唑环的化合物,已有文献报道以MBISA作为保护剂,采用硼氢化钠作还原剂制备了金纳米粒子[16],说明MBISA中含有的巯基可以与贵金属形成较强的键合作用,且MBISA中含有的磺酸基可使形成的纳米簇具有良好的水溶性及良好的生物相容性。本文采用MBISA为配体及还原剂,以超声化学法制备了荧光铜纳米簇。
谷胱甘肽(Glutathione,GSH)是一种广泛存在于体内的小分子肽,能帮助保持正常的免疫系统功能,并具有抗氧化作用、整合解毒作用,许多疾病的产生与体内谷胱甘肽的含量变化有关[17-18],因此,准确检测GSH含量在健康扫描、疾病检测等方面用途广泛,具有重要的研究价值[19-20]。目前,测定谷胱甘肽的常用方法有:高效液相色谱法[21]、毛细管电泳法[22]、分光光度法[23]、电化学法[24]、酶法[25]、荧光分析法[26]等,与其他方法相比,荧光分析法具有操作简便、灵敏度高及能够可视化观察等优点[27-29]。本文制备的MBISA保护的铜纳米簇在GSH的存在下荧光强度会有所增强,且荧光强度和GSH浓度有良好的线性关系,基于此建立了可选择性测定GSH的检测新方法,并应用于实际样品的检测。
1 实验部分
1.1 试剂与仪器
三水合硝酸铜,上海阿拉丁试剂有限公司(99%);2-巯基-5-苯并咪唑磺酸钠(MBISA),美国ALDRICH公司(98%);谷胱甘肽(GSH),阿拉丁(99.99%)。
紫外可见分光光度计(Hitachi,U-2910);爱丁堡稳态瞬态荧光光谱仪(FLS920);红外光谱仪(珀金埃尔默仪器有限公司,Paragon 1000);纳米粒径电位分析仪(马尔文,NanoZS90);超声波细胞粉碎仪(宁波新芝生物科技股份有限公司,SCIENTZ-ⅡD);透射电子显微镜(JEOL有限公司,JEM-2100)。
1.2 铜纳米簇的制备
在 10 mL离心管中分别加入 100 μL Cu(NO3)2(0.1 mol·L-1),300 μL MBISA(0.1 mol·L-1)和 4.6 mL二次去离子水,摇匀后用1 mol·L-1的氢氧化钠溶液调节pH值至6.30,此时的产物标记为Cu(I)-MBISA配合物,再将其置于300 W的超声波细胞粉碎仪中超声反应15 min,得到MBISA@CuNCs,于4℃下保存用于后续分析。
为了优化合成条件,在不同反应条件下制备了一系列CuNCs,并测定了其荧光强度。反应条件如下:Cu(NO3)2·3H2O 和 MBISA 的物质的量比为 1∶1,1∶3,1∶6,1∶9,1∶12、反应 pH 值为 5.70,5.90,6.10,6.30,6.50,6.70,6.90以及超声反应时间为0,5,10,15,20,25,30,35,40,45 min。
1.3 铜纳米簇的表征
将 100 μL MBISA@CuNCs和 2 mL 的磷酸缓冲液(PBS,pH 6.3,0.03 mol·L-1)混合,测定其紫外-可见吸收光谱,激发、发射光谱,荧光寿命,并进行纳米粒径电位分析测定Zeta电位值。将少量的MBISA@CuNCs固体粉末与KBr粉末混合,压片后扫描其在4 000 cm-1~375 cm-1波数范围内的红外吸收光谱。将MBISA@CuNCs水溶液滴加到超薄碳膜上,完全干燥后进行透射电子显微镜测试。
1.4 谷胱甘肽的测定实验
将10 μL不同浓度的GSH标准溶液加入含有100 μL CuNCs的 PBS缓冲液中(2.0 mL,0.03 mol·L-1,pH 6.3),分别测定荧光光谱。并测定在体系中加入铜纳米簇和14种其它小分子干扰物(氨基葡萄糖、维生素B1、维生素B6、维生素B12、N-羟基琥珀酰亚胺、D,L-半胱氨酸、D,L-苯丙氨酸、高半胱氨酸、谷氨酰胺、L-半胱氨酸、NAC、天门冬氨酸、维生素C、缬氨酸)的荧光光谱。
将 1.5 mL 不同 Cu(NO3)2·3H2O 和 MBISA 摩尔比下制备好的CuNCs分别滴加在剪好的滤纸条上,再滴加 10 μL GSH(0.01 μmol·L-1),自然风干后分别在日光和365 nm的紫外灯下观察滤纸条的颜色。
1.5 实际样品中谷胱甘肽含量的检测
水样取自我校令德湖水、迎泽公园湖水和实验室自来水,血清样品取自我校校医院。使用过滤器将水样过滤,除去水中杂质,以10 000 r·min-1离心10 min,将血清稀释20倍。将1.0 mL水样/血样、100 μL 的 MBISA@CuNCs和 1.0 mL PBS 缓冲溶液混合,测定荧光光谱,并分别将1.5、3.0和15.0 μmol·L-1的GSH标准溶液加入上述溶液中,测其荧光光谱。
2 实验结果与讨论
2.1 CuNCs的性能表征
采用紫外-可见吸收光谱、荧光光谱、透射电子显微镜、傅里叶红外光谱和纳米粒径电位分析对制备的MBISA@CuNCs进行了表征。图1A为MBISA,Cu(NO3)2·3H2O,CuNCs 和 CuNCs+GSH 的UV-vis吸收光谱图。从MBISA-CuNCs的光谱图中观察到其在332 nm处有一个较为明显的吸收峰,这与配体 MBISA及Cu(NO3)2·3H2O的吸收光谱有明显的区别,且在300 nm~400 nm范围内,吸收强度逐渐减低,符合纳米团簇的吸收特征[11]。图1B为CuNCs的荧光光谱图,分别在332 nm和642 nm处显示最大激发和发射峰,较大的斯托克斯位移(310 nm)可以避免激发和发射峰的重叠。铜纳米簇在332 nm处的吸收峰信号与荧光激发光谱相一致。从TEM表征结果(图1C)可看出MBISA@CuNCs呈现球形,无明显聚集,分散性较好,且从图1C插图可观察到明显的晶格结构,从粒径分布直方图(图1D)中可得CuNCs的平均粒径为2.8 nm。

图1 (A)紫外-可见吸收光谱图。a线:MBISA,b线:CuNCs+GSH,c线:Cu(NO3)2,d线:CuNCs;(B)CuNCs的激发和发射荧光光谱图。Ex:激发光谱,Em:发射光谱;(C)CuNCs的HRTEM图。(D)CuNCs的粒径分布直方图Fig.1 (A)UV-visible absorption spectra.a:MBISA,b:CuNCs+GSH,c:Cu(NO3)2·3H2O,d:CuNCs;(B)Fluorescence excitation and emission spectra of CuNCs.Ex:excitation,Em:emission spectra.(C)HRTEM image of the as prepared CuNCs;(D)The particle size histogram from several TEM images
比较配体MBISA和CuNCs的IR光谱图(图2A),结果表明MBISA的S-H拉伸带(2 580 cm-1)在CuNCs的光谱中消失,说明MBISA分子在铜纳米簇中形成了硫醇盐。3 394 cm-1处的吸收峰可归属于MBISA的仲胺υNH,1 625 cm-1~1 450 cm-1处的吸收带归属于苯环框架振动。与游离MBISA相比,CuNCs在1 653 cm-1处的吸收峰蓝移了29 cm-1,且归属于C=N双键组的在1 690 cm-1~1 500 cm-1范围内吸收峰变的松散,可能是归因于Cu原子的诱导效应和MBISA的官能团与CuNCs之间的相互作用。此外,由于传导电子的影响,与配体MBISA相比,CuNCs在<1 400 cm-1的吸收带中的精细结构变宽。动力学稳定性实验结果表明CuNCs在332 nm的紫外光照射50 min后仍保持95%以上的荧光强度,如图2B所示,说明CuNCs具有良好的抗光漂白性。对CuNCs的纳米粒径电位分析结果可知,MBISA@CuNCs的Zeta电位为-18.1 mV,如图2C所示,表明该纳米簇带负电荷,在水溶液中有良好的稳定性。

图2 (A)MBISA、CuNCs和CuNCs+GSH的傅里叶红外光谱图。a线:CuNCs,b线:CuNCs+GSH,c线:MBISA;(B)CuNCs动力学稳定性曲线图;(C)CuNCs和CuNCs+GSH的Zeta电位图。a柱:CuNCs,b柱:CuNCs+GSHFig.2 (A)FTIR spectra of MBISA,CuNCs and CuNCs+GSH.a:CuNCs,b:CuNCs+GSH,c:MBISA;(B)Kinetic stability curve of CuNCs;(C)Zeta potentials of CuNCs and CuNCs+GSH.a:CuNCs and b:CuNCs+GSH
2.2 CuNCs的合成
首先硝酸铜水溶液和2-巯基-5-苯并咪唑磺酸二水合钠盐(MBISA)水溶液混合,MBISA通过咪唑环与二价铜Cu(Ⅱ)发生配位形成Cu(Ⅱ)-MBISA配合物;使用NaOH溶液调节pH为6.3,由于2-巯基-5-苯并咪唑磺酸二水合钠盐(MBISA)中苯并咪唑的pKa约为5.53,所以此时其中的咪唑环是一个富电子中心,其还原性增强,可把Cu(Ⅱ)还原为Cu(I),形成 Cu(I)-MBISA 配合物;在 300 W 功率的超声环境中反应15 min,一部分Cu(I)-MBISA配合物在超声波的能量下被还原为零价Cu并聚集成Cu核,未被还原的Cu(I)-MBISA配合物的聚集在零价Cu核周围,形成了铜纳米簇。
为了制备出最佳荧光性能的MBISA@CuNCs,本文通过单一变量法分别探索了MBISA与Cu(NO3)2·3H2O物质的量之比、pH条件、超声时间等主要合成条件对铜纳米簇荧光强度的影响。图3A中结果表明当 MBISA与 Cu(NO3)2·3H2O物质的量之比为1∶3时铜纳米簇的荧光强度最高,且试纸条的显色也得同样的结果(图3B)。从图3C结果可得在合成过程中pH值为6.3时,MBISA@CuNCs的荧光强度最高。这是由于当pH值为6.30时,MBISA的咪唑环完全成为一个富电子中心,还原能力最强,当pH值大于或小于这个值时就会降低MBISA中咪唑环的还原性,造成铜纳米簇的荧光强度降低。部分Cu(I)-MBISA配合物在超声环境中被还原,未被还原的Cu(I)-MBISA配合物的聚集在零价Cu核周围,形成了铜纳米簇。通过对照未超声的产物(Cu(I)-MBISA配合物)的吸收和荧光光谱,如图3D所示,CuNCs在310 nm~380 nm处吸收峰强度比Cu(I)-MBISA配合物的高,且荧光强度提高了约6倍。从图3D插图的照片可看出超声后的铜纳米簇水溶液日光下呈偏黄色,而未超声的产物(Cu(I)-MBISA配合物)在日光下呈现蓝色。如图3D插图所示,超声时间为15 min~20 min荧光强度最高,本着省时经济,选择超声15 min继续后续实验。
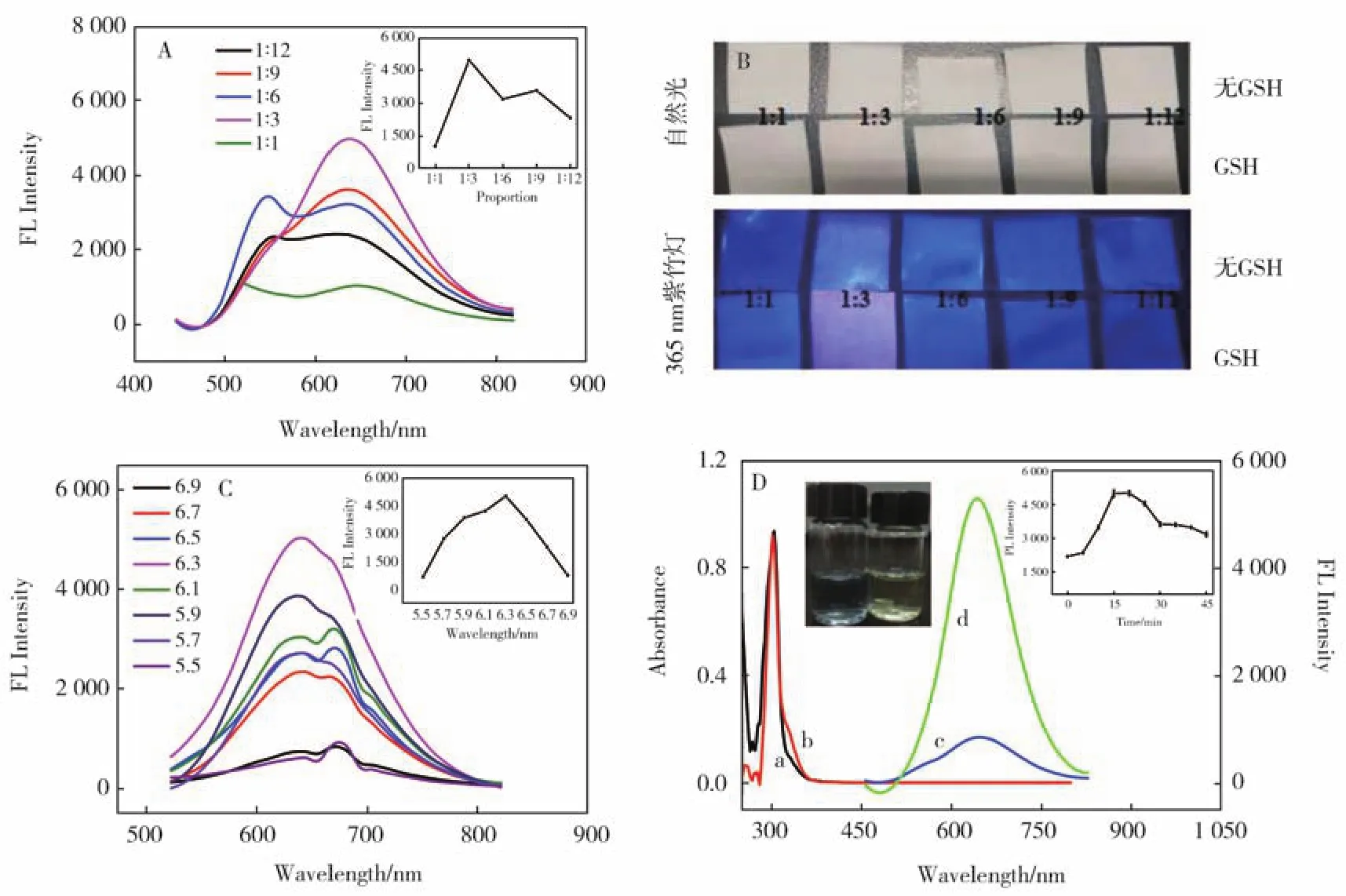
图3 (A)不同Cu(NO3)2·3H2O和MBISA摩尔比下合成的CuNCs的荧光光谱图,插图为Cu(NO3)2·3H2O和MBISA的摩尔比对合成CuNCs的荧光强度影响;(B)在自然光和365 nm紫外灯照射下有无加入GSH的CuNCs在滤纸上的照片(从左到右依次为 Cu(NO3)2·3H2O和MBISA摩尔比为1∶1,1∶3,1∶6,1∶9,1∶12下合成的 CuNCs)。上图为在自然光下拍摄,下图为在365 nm紫外灯下拍摄;(C)不同pH下合成的CuNCs的荧光光谱图,插图为pH值对合成CuNCs的荧光强度的影响;(D)a和c线为Cu(I)-MBISA配合物的紫外可见吸收和荧光发射光谱,b和d线为CuNCs的紫外可见吸收和荧光发射光谱。插图为超声时间对CuNCs的荧光强度影响。插图图片为Cu(I)-MBISA配合物(左图)和CuNCs在日光下的照片(右图)Fig.3 (A)Fluorescence spectra of CuNCs synthesized under different mole ratio of Cu(NO3)2·3H2O and MBISA;(B)Photographs show the filter paper added CuNCs with and without GSH under sun light and 365 nm UV light;(C)Fluorescence spectra of CuNCs synthesized under different pH;(D)UV-visible absorption and fluorescence spectra of Cu(I)-MBISA complex(a and c)and CuNCs(b and d).Inset:effect of ultrasonic time on the fluorescence intensity of CuNCs.Inset pictures:the photographs of Cu(I)-MBISA complex(left)and CuNCs(right)under sun light
2.3 探究CuNCs的选择性
选择性是判断一个传感器能否良好的应用于实际样品检测的关键因素。因此,在实验条件最佳情况下,考察各种可能存在的物质对铜纳米簇探针荧光强度的影响。如图4A所示,在332 nm激发波长下测定加入不同小分子后CuNCs的荧光强度,结果表示GSH的加入能显著增强CuNCs的荧光,其他潜在干扰物对其荧光强度几乎无影响,说明该CuNCs对GSH具有良好的选择性。如图4B所示,在自然光下和365 nm紫外灯下加入不同小分子后铜纳米簇的颜色变化,其中加入GSH后CuNCs在紫外灯照射下有明显的荧光增强,说明该CuNCs可选择性识别GSH。
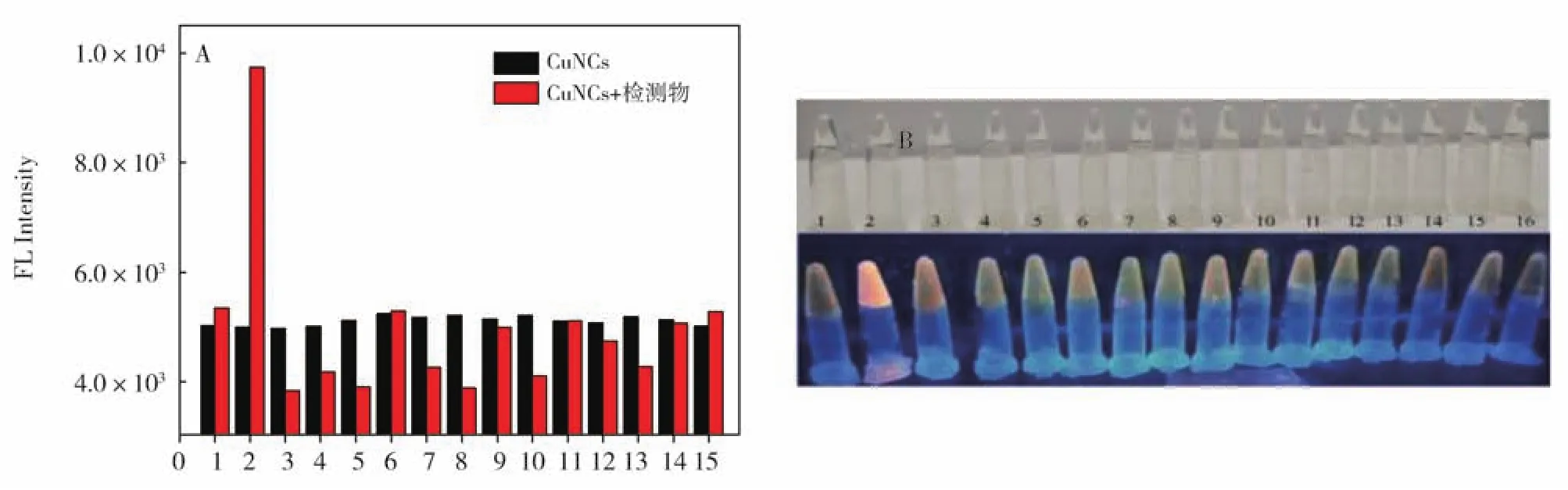
图4 (A)在不同小分子存在下CuNCs的荧光强度图,浓度:GSH:0.01 μmol·L-1,其他小分子:0.1 μmol·L-1(1:氨基葡萄糖、2:谷胱甘肽、3:VB6、4:VB12、5:N-羟基琥珀酰亚胺、6:D,L-半胱氨酸、7:D,L-苯丙氨酸、8:高半胱氨酸、9:VB1、10:谷氨酰胺、11:L-半胱氨酸、12:NAC、13:天门冬氨酸、14:VC、15:缬氨酸);(B)在日光和365 nm紫外灯照射下CuNCs的照片Fig.4 (A)Fluorescence intensities of CuNCs with other small molecules.GSH:0.01 μmol·L-1,other small molecules:0.1 μmol·L-1(1:Glucosamine,2:glutathione peptide,3:VB6,4:VB12,5:N-hydroxysuccinimide,6:D,L-cysteine,7:D,L-phenylalanine,8:homocysteine,9:VB1,10:glutamine,11:L-cysteine,12:NAC,13:aspartate,14:VC,15:proline);(B)Photographs of CuNCs under sun light and 365 nm UV lamp
2.4 GSH的检测条件优化
MBISA@CuNCs的量和孵育时间等因素均会影响GSH的检测。考察了MBISA@CuNCs的用量在20 μL~200 μL范围内荧光强度的变化如图5A,并向其中加入 0.01 μmol·L-1的 GSH,得到荧光强度的升高值F-F0,其中F0代表MBISA@CuNCs的荧光强度,F代表MBISA@CuNCs中加入GSH的荧光强度,从图中可看出在CuNCs用量为120 μL时F-F0值最大,故选取 120 μL CuNCs的量作为GSH的最佳检测用量。此外,还考察了孵育时间对MBISA@CuNCs荧光强度的影响(图5B)。CuNCs中加入 0.01 μmol·L-1的 GSH,其荧光强度在 6 min之内迅速增大,之后荧光强度逐渐稳定不再增加,说明此时二者之间的作用达到平衡,在后续实验中选择孵育时间为6 min,较短的孵育时间为体系的快速检测提供了可能。此外,如图3B可知,在MBISA与 Cu(NO3)2·3H2O 物质的量之比为 1∶3 时,在 365 nm紫外灯下滴加GSH的MBISA@CuNCs的荧光强度增强最明显。

图5 (A)MBISA@CuNCs用量对荧光强度的影响。(B)孵育时间对MBISA@CuNCs荧光强度的影响Fig.5 (A)Effect of MBISA@CuNCs amount on fluorescence intensity.(B)Effect of incubation time on fluorescence intensity of MBISA@CuNCs
2.5 GSH的检测机理
本文进一步探讨了CuNCs对GSH的检测机理,由图2A的红外光谱图中我们可以看出,CuNCs加入GSH前后的红外吸收光谱无明显变化,表明配体中的残基并未与GSH发生反应。因此,CuNCs荧光强度的增加并非源自GSH与CuNCs表面上的MBISA之间的相互作用,可能是由GSH与CuNCs的Cu核发生了作用[30]。由图2C可得加入GSH后CuNCs的Zeta电位为-19.7 mV,与CuNCs的Zeta电位值(-18.1 mV)相比变化不大,进一步证明CuNCs荧光增强并不是由于CuNCs表面上的配体MBISA与GSH作用所致。TEM表征结果(图6A)表明CuNCs中加入GSH后,铜纳米簇被GSH诱导发生了聚集,并进一步聚集成更大的聚集体,其平均粒径为118 nm(图6B)。因此,CuNCs对GSH的高选择性识别作用可解释为是基于聚集诱导的发射增强效应。从加入不同浓度GSH的CuNCs的紫外吸收光谱图(图6C)可看出加入GSH后CuNCs的吸收峰无明显变化,并无观察到铜纳米粒子的表面等离子体吸收峰,因此推测聚集后的较大粒径的铜纳米簇在尺寸和形态上也均是单分散的,这为分析应用提供了独特的优势[31]。CuNCs的吸收强度随GSH浓度的增大逐渐降低,表明由GSH引起的CuNCs的荧光增强作用仅仅发生在基态之间。这和荧光寿命测试结果一致,如图6D所示,CuNCs的寿命为 0.70 ns(χ2=1.141),在加入GSH 后 ,CuNCs的寿命为 0.81 ns(χ2=1.072)。荧光寿命基本无变化,说明GSH的加入没有改变CuNCs的配体/配体,配体/金属和金属/金属之间的相互作用(LMMCT),电荷由配体转移到 Cu(I)-Cu(0)原子。该实验结果进一步表明,加入GSH后的荧光增强是由GSH诱导CuNCs的聚集,产生了聚集诱导荧光增强效应引起的。
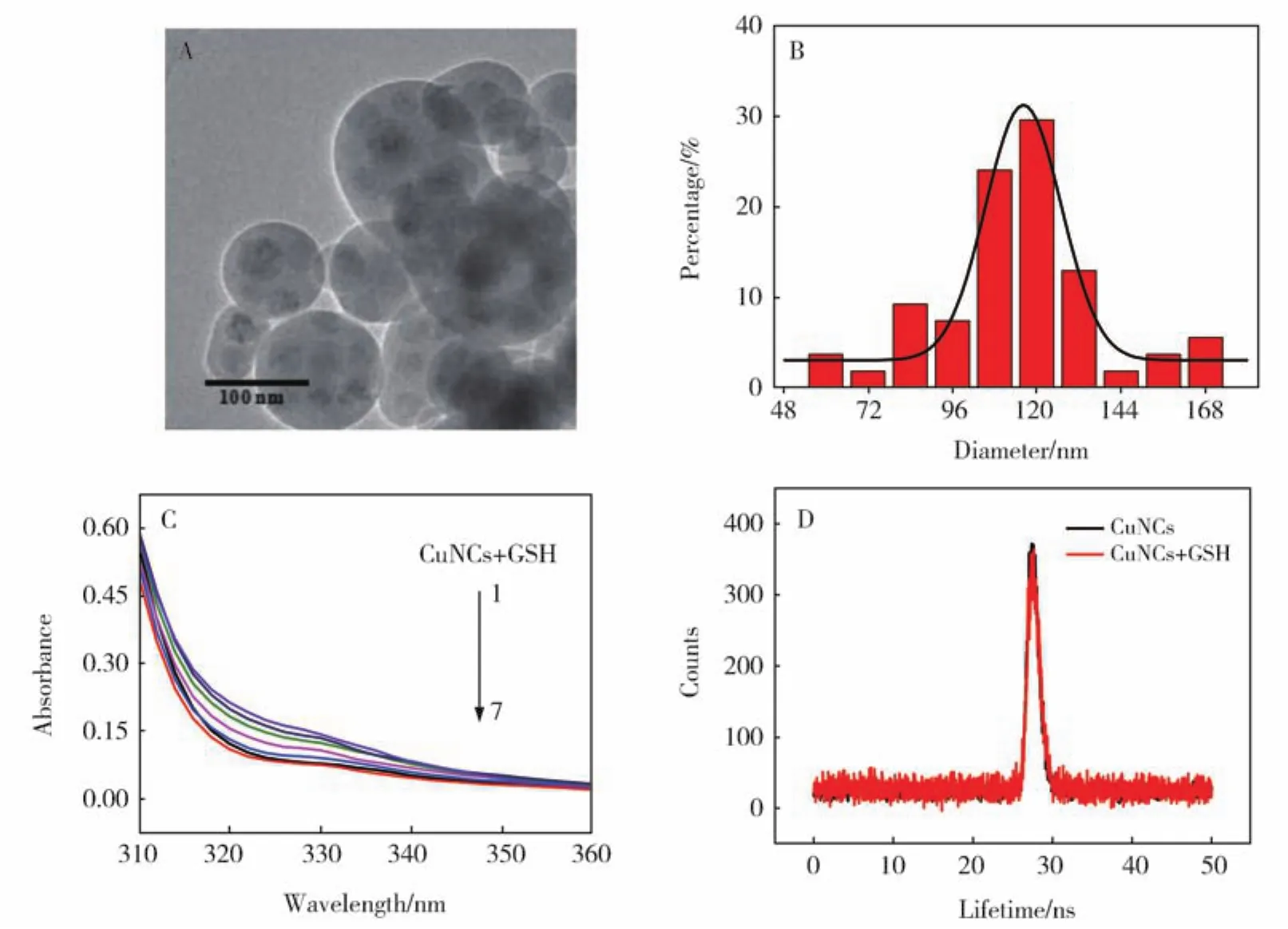
图6 (A)和(B)分别为 CuNCs中加入10 μL 0.01 μmol·L-1GSH后的TEM图和其粒径分布直方图;(C)向CuNCs滴加不同浓度 GSH后的紫外可见吸收光谱图;1-7分别滴加了10,20,40,100,380,740 μL的GSH(0.01 μmol·L-1);(D)CuNCs的荧光寿命曲线图。a线:CuNCs,b线:CuNCs中加入了 10 μL 0.01 μmol·L-1的 GSHFig.6 (A)and(B)are TEM image of the CuNC with 10 μL 0.01 μmol·L-1GSH and the particle size histogram respectively;(C)UV-visible absorption spectra of CuNCs in the presence of various concentrations of GSH;1-7 represent addition of 0,10,20,40,100,380,740 μL GSH(0.01 μmol·L-1)respectively;(D)Fluorescence decay spectra of CuNCs without(a)and with 10 μL 0.01 μmol·L-1GSH(b)
2.6 CuNCs对GSH传感的灵敏度
所制备的MBISA@CuNCs的发光可以被GSH有效地增强,据此研究了测定谷胱甘肽浓度的荧光增强型化学传感方法。加入不同浓度GSH的MBISA@CuNCs的荧光光谱如图7A所示,随着GSH浓度的增加,荧光强度逐渐增强。图7B是荧光强度F对GSH浓度的谷胱甘肽浓度的依赖性,其中F是加入GSH后CuNCs的荧光强度值。可得GSH检测线性范围为6.59×10-7mol·L-1至 4.26×10-5mol·L-1,相关系数R2为0.996。在信噪比为3时,检测限为4.46×10-7mol·L-1。
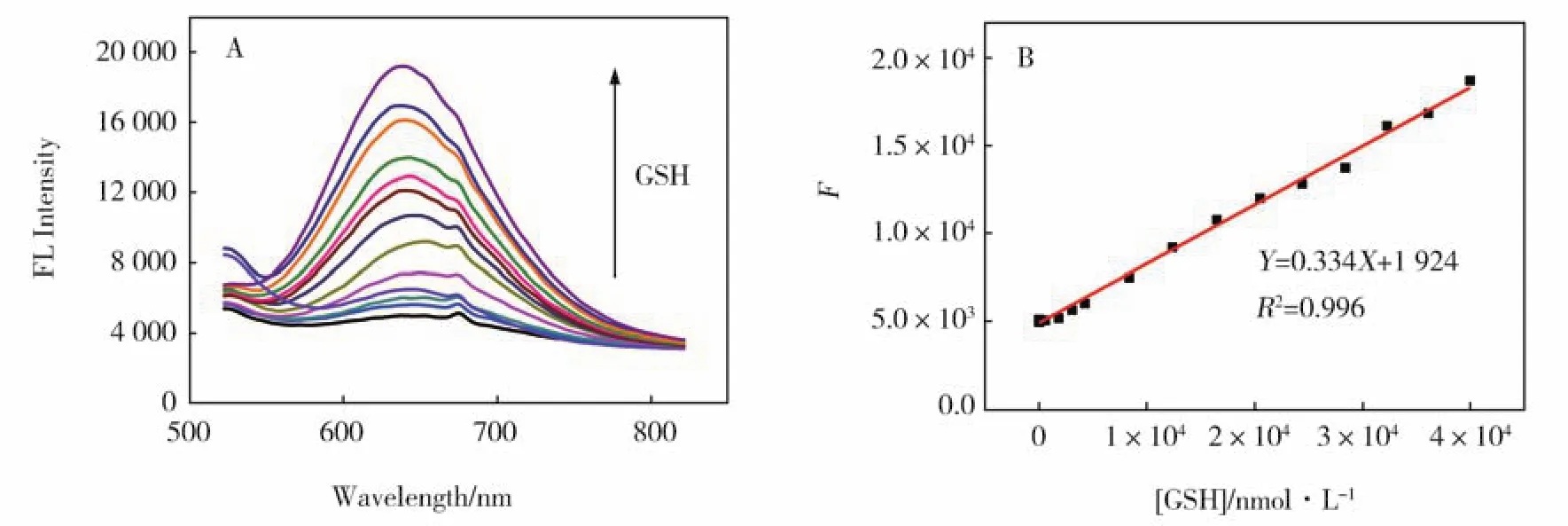
图7 (A)加入不同浓度的GSH后CuNCs的荧光光谱图;(B)荧光强度F与GSH浓度的线性关系Fig.7 (A)Fluorescence spectra of CuNCs with different concentrations of GSH.(B)Linear relationship between relative fluorescence intensity F and GSH concentration
2.7 实际样品中GSH含量的检测
GSH在生命活动中起着至关重要的作用,因此检测饮用水、生活用水以及血清中的GSH含量具有非常重要的实际意义。利用上述传感检测方法,对实际样品中的谷胱甘肽进行了检测,如表1所示。

表1 MBISA@CuNCs应用于测定实际样品中GSH的测定结果Table 1 Analytical results of GSH in real samples based on MBISA@CuNCs.
结果表明,用本文建立的方法在实际水样自来水、湖水中并未检测到GSH,在2个人血清样品中检测到 GSH 的含量分别为 4.44 和 4.24 μmol·L-1。同时对各实际样品采用加标回收法测定,得回收率为96.09%~106.62%,经6次测定计算的相对标准偏差(RSD)低于3.0%,进一步证实了基于MBISA@CuNCs的荧光增强型传感检测方法具有较好的可靠性,可应用于实际水样和血样中GSH的检测,且该方法有望应用于生物样品中谷胱甘肽的检测。
3 结论
本文采用2-巯基-5-苯并咪唑磺酸二水合钠盐和硝酸铜为原料,以超声化学法制备了水溶性稳定性好的铜纳米簇,其中MBISA既作保护剂又作还原剂,最佳激发波长和发射波长分别是332 nm和642 nm。基于GSH对MBISA@CuNCs荧光强度的增强,建立了一种检测谷胱甘肽含量的传感检测新方法,并将其应用于实际样品的检测。谷胱甘肽浓度在 6.59×10-7mol·L-1~ 4.26×10-5mol·L-1的范围内与CuNCs的荧光强度成线性关系,检出限为4.46×10-7mol·L-1,回收率为 96.09%~106.62%。本文所制备的铜纳米簇有反应条件温和、制备工艺简单、响应特性优良、抗干扰能力强、绿色环保等优点,在检测GSH含量方面具有较好的应用前景。
