橘绿木霉降解山西褐煤效果分析*
2021-05-19孙景红解玉红
冯 炘 孙景红 解玉红,2
(1.天津理工大学环境科学与安全工程学院,300384 天津;2.易科力(天津)环保科技发展有限公司,300384 天津)
0 引 言
近年来,煤的生物降解研究受到了广泛的关注,研究表明微生物可破坏煤基质结构并释放液体物质。在过去几十年中,在全国范围内学者们已经利用各种煤和微生物进行了研究,青霉菌(Penicilliumspp.)和黄孢原毛平革菌(Phanerochaetechrysosporium)等真菌对煤的降解已被广泛报道,结果表明褐煤更容易被真菌降解[1-2]。REISS[3]测试了7种担子菌、1种子囊菌和5种疏水菌对德国烟煤和褐煤的溶解能力,其中3种杏鲍菇是最有效的,相应的生物降解率在5.8%~7.6%;非担子菌活性最低,降解率小于3.5%,完成转化需要2周时间。由于褐煤的化学结构与木质素的化学结构相似,因此,降解木质素的真菌也具有降解褐煤的能力且对煤的降解效果很好[4-5]。
在大多数生物降解煤实验中,能降解木质素的真菌菌株对煤的有效降解起着至关重要的作用。银耳能够在木屑环境下生存,但银耳菌丝本身几乎没有降解木质素的能力,而是由与银耳相伴生长的菌起主要作用[6]。因此,本研究从银耳种子中分离到一株木霉菌(记为A-1),研究该真菌的降解能力,并利用扫描电镜、傅立叶红外光谱(FTIR)、气相色谱-质谱联用(GC-MS)技术对煤样及降解产物进行化学分析。
1 实验部分
1.1 煤样及预处理
实验所用的褐煤取自山西大同煤矿,先将煤块破碎并取0.100 mm~0.125 mm的煤样作为实验原煤,再对原煤进行H2O2预处理。预处理可以提高煤炭的生物溶解度,H2O2相比其他强氧化物而言,对煤层微生物影响较小,且H2O2分解产生H2O和O2,污染较少。将原煤与质量分数为30%的H2O2按照1 g∶10 mL的比例进行混合并于磁力搅拌器上搅拌15 h,然后用去离子水冲洗至滤液pH呈中性,于80 ℃烘箱中干燥36 h,使用Varro-ELIII元素分析仪测定原煤、H2O2预处理后的氧化煤和生物降解后残煤的碳、氢、氧、氮、硫的质量分数。
1.2 菌种及培养基
实验所用的木霉菌A-1是在实验室于银耳种子中分离得到的。A-1菌分离步骤为:首先,将100 mL生理盐水与5 g银耳种子于锥形瓶中混合制备菌悬液,从菌悬液中取出1 mL原液加入含有9 mL生理盐水的试管中,混合均匀,形成10-2的稀释液;再从10-2稀释液中取出1 mL加入含有9 mL生理盐水的试管中,混合均匀,形成10-3的稀释液;同上,再依次稀释为10-4和10-5,然后取稀释后不同梯度的菌悬液各1 μL,用涂布棒均匀涂布在马铃薯葡萄糖琼脂(PDA)培养基(成分见表1)上。接种后,将培养基倒置于27 ℃的生化培养箱中培养2 d并每隔4 h观察一次,挑取平板上不同形态菌株的单菌落并在PDA培养基上进行多次培养直到获得纯菌株,将纯菌株转移至PDA斜面于4 ℃保存。
实验分离纯化出三株菌株,为了挑选出有降解能力的菌株,对三株菌进行预处理实验,即在以煤炭为唯一碳源的改良PDA培养基(成分见表1)中分别培育三株菌株,观察三株菌株是否能够利用煤炭生长,发现只有菌株A-1生长,因此,挑选菌株A-1进行菌株鉴定及褐煤的降解实验。将菌株进行26S D1/D2区PCR扩增及序列测定,以Seq Forward为引物进行DNA测序,将DNA序列与NCBI数据库中的序列进行对比。
1.3 褐煤降解转化实验
在液体培养基中进行生物降解褐煤实验。将木霉菌A-1接种到PDA培养基上活化培养48 h,将0.9%生理盐水加入平板中形成菌悬液。为了便于后续取样,选择14个容量为150 mL的锥形瓶,洗净、烘干,于锥形瓶中分别加入0.5 g预处理后的原煤、50 mL改良DOX培养基(成分见表1),将瓶口包好,用高压灭菌锅于121 ℃灭菌20 min;再分别加入4 mL木霉菌悬液,于25 ℃,150 r/min摇床振荡培养2周,设计3组平行实验。降解实验结束后,过滤,收集残渣,去除降解产物中的残余菌丝体,用蒸馏水对残煤进行清洗,烘干并称重。木霉菌的生物降解率公式[7]为:

表1 培养基的成分
式中:w为生物降解率,%;m0为褐煤的初始质量,g;m1为生物增溶后残留褐煤的质量,g。
1.4 降解产物的化学分析
降解产物采用傅立叶红外光谱和气相色谱与质谱联用技术进行分析[8]。傅立叶红外光谱用于确定降解后煤样中特定的有机官能团。用去离子水清洗降解实验中残留的煤样品,去除残留煤中所有的真菌菌丝。将原始褐煤、预处理后的褐煤及降解后残留的褐煤干燥24 h,再将0.2 g的每种样品与20 g干燥的KBr混合研磨至粉末,压片[9]。使用FTIR光谱仪在4 000 cm-1~500 cm-1光波数范围内进行红外扫描。
气相色谱与质谱联用法中气相色谱(GC)用于分离生物降解产物中的化学组分,质谱(MS)用于鉴定每种成分的化学结构[10-11]。分别按照极性由低到高的顺序采用正己烷、二氯甲烷和乙酸乙酯对降解液体产物进行萃取,以10(有机溶剂)∶1(液体产物)的体积比于分液漏斗中进行多次萃取[12]。将萃取后收集到的有机相部分浓缩、定容至最终体积1 mL,用气相色谱-质谱联用仪进行分析[13-14]。
2 结果与讨论
2.1 褐煤的元素分析
山西褐煤原样、经H2O2预处理后的氧化煤样及生物降解后残余煤样的元素分析结果(每种样品测试3次后取平均值)见表2。由表2可知,山西褐煤原煤碳元素的质量分数为71.7%,属于低阶煤,该煤样煤化程度低,容易受到微生物降解。氧化煤样与原煤样相比,碳的质量分数和氢的质量分数明显减少,分别由71.7%和15.7%降低到69.7%和10.1%,而氧的质量分数由4.5%增加到12.2%,由此表明,H2O2预处理使山西褐煤发生氧化,增加了煤中的氧含量,以氧键连接芳香族团簇的形式存在,可能促进真菌对煤结构基质的降解,从而释放出多种有机物[13]。与氧化煤样相比,菌株降解后的残余煤样碳的质量分数又降低了2.2%,表明微生物对褐煤进行了降解,形成小分子化合物溶于液体产物中,从而减少了碳的含量。

表2 山西褐煤的元素分析
2.2 木霉菌A-1的分离
对菌株A-1进行PCR扩增26S D1/D2区序列,并测序。BLAST分析显示,菌株A-1扩增子序列与Trichodermacitrinoviride(MH877291.1)的同源性达到99%。目前,关于木霉属降解褐煤的研究较少,已有文献[5,15]中的木霉菌有Trichodermasp.AH和Trichodermaatroviride,但还未发现将Trichodermacitrinoviride菌株应用于煤炭的生物降解研究。由于木霉菌属能降解纤维素,山西褐煤中含有大量的类木质素结构,因此,该菌株可能具有较强的煤炭降解能力,分离出的菌株如图1a所示。

图1 从银耳种子中分离出的木霉菌株A-1及其琼脂糖凝胶电泳结果
2.3 降解率和降解时间
利用该真菌对H2O2预处理的山西褐煤样品进行降解实验,培养过程中菌株A-1的生长情况如图2所示。由图2可以看出,菌株A-1在以煤炭为唯一碳源的改良DOX培养基中生长良好,表明该菌株能够利用煤炭,从而实现对煤炭的生物降解。

图2 降解过程中菌株A-1的生长情况
表3所示为菌株A-1降解山西褐煤14 d时3组平行样的降解率。由表3可知,在第14天时,真菌对H2O2预处理褐煤的平均降解率达到22.59%,该降解率经条件优化后还会有所提高。REISS[3]的研究结果表明,经过预处理后的煤炭在2周内降解率在7%~32%。这表明,从银耳种子中分离出来的木霉菌具有较好的溶解效率,可能是由于该菌具有降解类木质素的能力,从而有利于降解褐煤。

表3 木霉菌对H2O2预处理山西褐煤的生物溶解效果(14 d)
2.4 扫描电镜分析
采用扫描电子显微镜对H2O2处理后的褐煤以及生物降解后褐煤残渣进行观察,照片如图3所示。由图3可以看出,原煤及H2O2处理后的褐煤为层状结构,表面粗糙,在一定程度上反映了褐煤的植物纤维状结构。氧化煤有较多的孔洞,这主要是由于H2O2的氧化作用使得原煤颗粒表面孔结构增多,从而更有利于微生物进入煤颗粒内发挥作用。随着微生物作用,煤炭结构发生了明显变化,有大量的孔洞出现且孔隙增大,表明微生物改变了煤炭颗粒的大分子结构。

图3 煤样的扫描电镜照片
2.5 傅立叶红外光谱分析
原煤、氧化后褐煤及生物降解后煤样的红外光谱如图4所示。由图4可以看出,溶解产物红外光谱中的主要吸收带归因于羟基拉伸(3 000 cm-1~3 450 cm-1)、羰基(1 600 cm-1)、醚键(1 300 cm-1~1 000 cm-1)和侧链芳香环(1 000 cm-1~500 cm-1)[5,16]。
由图4还可知,降解后的残余煤渣在某些波数区域内吸收强度变弱或消失,说明煤样的有机大分子通过真菌降解为小分子。—OH的观测点在3 400 cm-1左右[17],降解14 d的残余煤样中含有大量的羟基,原煤样和H2O2氧化后的煤样在3 431 cm-1处的吸收峰几乎消失,表明存在较少的羟基,这可能是由于微生物分泌的代谢物裂解了许多结构。3 000 cm-1~2 700 cm-1处主要是C—H键的伸缩振动,2 925 cm-1处为C—H键的非对称伸缩振动,微生物降解后该处的吸光度增大,表明微生物将煤样中含C—H官能团片段从煤大分子结构中降解下来。1 000 cm-1~500 cm-1处为芳香族化合物中侧链C—H和C—O键振动[18]。与H2O2预处理后的褐煤样品相比,降解后残余煤样中芳香环的侧链吸光度较大,表明生物增溶褐煤过程中芳香环等复杂结构被打开,生成了多种侧链,真菌降解了褐煤中的芳香环结构,破坏了褐煤中的交联体系,最终从复杂的褐煤结构中释放出简单的芳香结构,并释放到液体产物中。褐煤芳环侧链是褐煤降解机理中的关键结构[11]。在原煤样和氧化煤样中,3 619 cm-1处存在一种胺,而在降解后的残余煤样中几乎没有这种胺,可能是由于该菌株破坏了胺结构,进而溶解褐煤。因此,降解产物中可能有一些胺类物质和酯类物质。酯键的振动在波数范围为1 360 cm-1~1 020 cm-1处,在1 318 cm-1处降解后的残余煤样相较于原煤及氧化煤,吸光度较大,表明该菌株降解褐煤的过程中,可能有一些酯类物质被溶解到液体产物中。在1 650 cm-1~1 400 cm-1范围内,降解后的残余煤渣含有更多的含氧官能团,这可能是由该菌降解特定的官能团导致的。这与残余煤样的元素分析结果相一致,经真菌降解后的残余煤样中氧含量明显增多,可能是由于真菌破坏了氧键连接的芳香族结构,从而释放多种有机物。
2.6 液化产物的GC-MS分析
分别用正己烷、二氯甲烷和乙酸乙酯三种有机物对降解14 d后的产物进行分级萃取,对萃取后的产物进行气相色谱-质谱联用分析。图5所示为正己烷、二氯甲烷和乙酸乙酯三种有机溶剂萃取降解产物的总离子流色谱(TIC)。由图5可知,萃取后分离出的物质种类较多,将每个峰与标准图库进行对比分析,发现在萃取物中检测到17种不同的化合物,检测到的主要组分包括烷烃、醇类、酯类等脂肪族化合物和酚类有机物,部分有机化合物的化学结构见表4。由表4可知,液化产物中含有乙酸异丁酯、对乙基苯酚、十六酸、2′-十二烷基-1,1′∶3′,1″-三联环戊烷、2-甲基二十六(碳)烷、邻苯二甲酸和3,5-二叔丁基苯酚,可见降解产物中主要成分含有烷烃、酯类等脂肪族化合物和酚类有机物,其中非极性组分含量较低,极性组分含量较高,可能是由于真菌释放酶物质破坏褐煤的分子结构,然后释放出小相对分子质量的产物[19]。GC-MS结果与傅立叶红外光谱分析结果相一致,表明降解产物中含有一些胺类、酯类及芳香族结构的物质。结合GC-MS及FTIR分析结果可以推断出该菌株A-1对山西褐煤的降解效果较好,降解产物中含有大量的有机小分子物质。

图5 降解产物的总离子流色谱
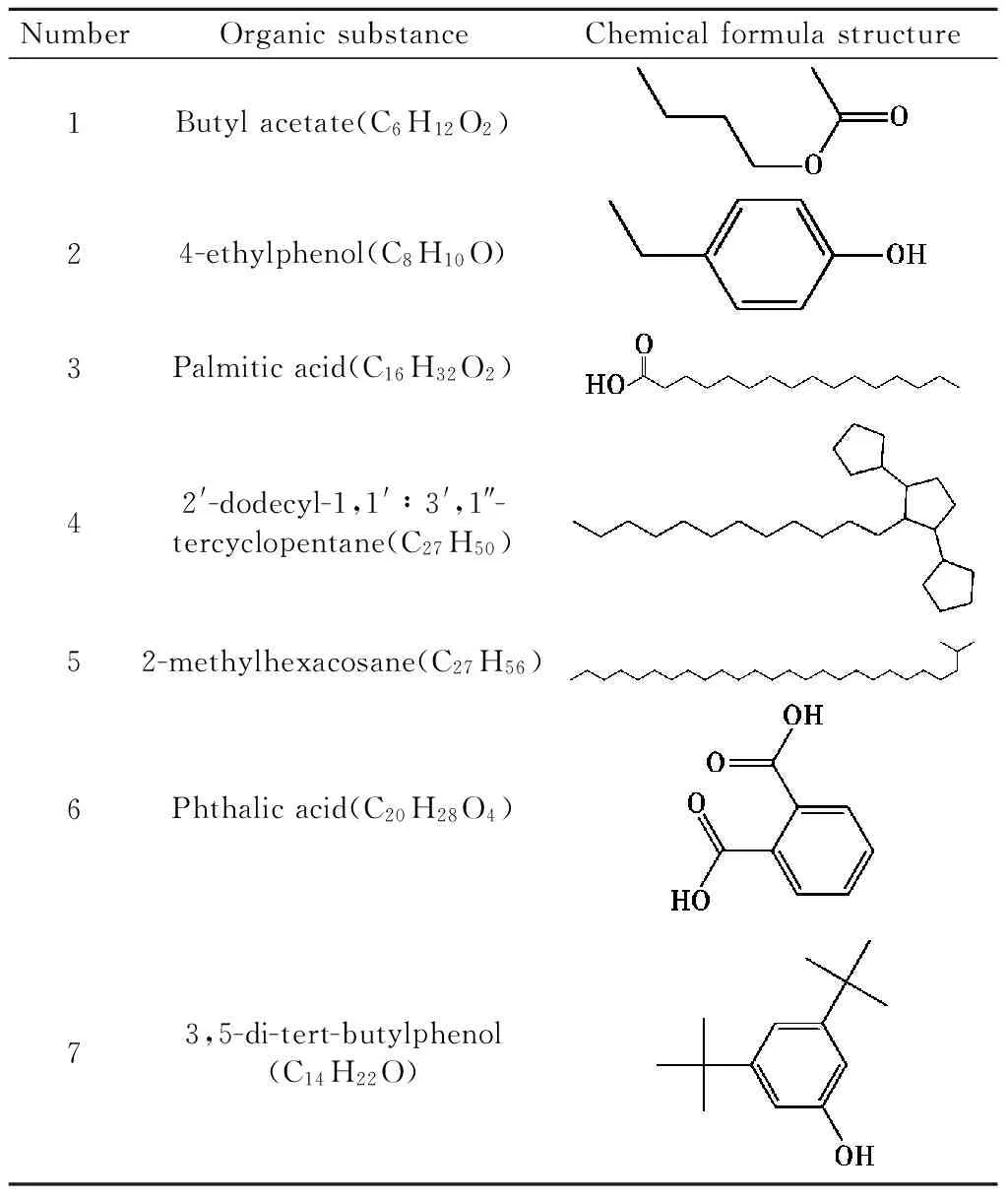
表4 正己烷和二氯甲烷及乙酸乙酯萃取的部分有机化合物
3 结 论
1)从能降解类木质素结构的银耳种子中分离到一株木霉菌(A-1),利用该菌对山西褐煤进行降解实验。结果表明,在14 d时该菌对褐煤的平均降解率达到22.59%,表明该菌对山西褐煤具有增溶解聚作用,降解效果较好。
2)对降解前后的山西褐煤进行扫描电镜分析,结果表明微生物对山西褐煤进行了降解,降解后的物质溶出,形成孔洞结构,孔隙增大。
3)对原煤、氧化后的煤及降解后的煤样分别进行红外光谱分析,结果表明该真菌A-1能将煤中芳香环等复杂结构打开,生成多种侧链,从而将大分子结构分解为小分子,降解产物中主要含有羟基、芳香环、酯类等有机官能团。
4)将降解后的液相产物分别用正己烷、二氯甲烷和乙酸乙酯分级萃取,利用GC-MS分析,发现生物降解产物中含有多种化合物,如烷烃、醇类、酯类等脂肪族化合物和酚类有机物,表明该菌株可以实现褐煤大分子结构的降解。
