基于Superpro Designer软件的单克隆抗体生产过程模拟及分析
2021-05-19
(中国医药集团联合工程公司,武汉 430000)
单克隆抗体是由单一B 细胞克隆产生的高度均一、仅针对某一特定抗原表位的抗体。通常采用杂交瘤技术来制备,杂交瘤抗体技术是在细胞融合技术的基础上,将具有分泌特异性抗体能力的致敏B 细胞和具有无限繁殖能力的骨髓瘤细胞融合为B 细胞杂交瘤。单克隆抗体是一类重要的生物技术产品,用于医疗诊断和治疗[1]。
Superpro Designer 是美国Intelligen 技术公司开发的,用于制药工程的工艺设计、产能分析、生产排班、去除生产瓶颈、环境影响评价和经济评价。Superpro Designer 是有偿在国际工程公司及概念设计公司广泛应用的软件,近些年被一些生物制药企业引进用于工艺开发及安排生产。目前国内在工程设计上的应用处于起步阶段,用于模拟单抗生产过程的报道尚未见到。本文利用Superpro Designer 模拟软件对某单抗项目的生产过程进行模拟分析。
1 项目背景
某医药集团拟新建一条3 000 L 单抗原液生产线,已知:主发酵罐内的蛋白表达量10 g/L,采用3 000 L 发酵罐生产。上游发酵为连续生产过程,生产班次为3 班,其中3 000 L 发酵罐发酵时间为9 d;下游纯化为间歇生产过程,生产班次为2 班,纯化过程共使用15 种缓冲液;要求每4 天生产一批产品。要求:分析计算生产产能、分析生产过程瓶颈、计算并优化设备选型。众所周之,单抗的生产瓶颈通常出现在发酵罐、配液罐及水系统的用量上;本文将重点分析发酵罐、配液罐及水系统选型的合理性。
2 工艺流程
图1为某单抗项目工艺流程图,主要包括上游种子培养发酵及下游纯化过程,本工艺中细胞种子经摇瓶、Wave 反应器、一、二级种子反应器培养扩增后进入发酵罐培养9 d 后经离心分离进入下游纯化过程。离心后收获的料液经亲和层析、深层过滤、阳离子层析、纳滤、超滤及除菌过滤后得到原液。在生产过程中还有培养基配制、缓冲液配制及缓冲暂存等辅助设施。主要设备为3 台3 000 L 发酵罐、离心机、层析柱及超滤器等。
3 Superpro Designer 模型的建立
3.1 生产过程的建立
准确建立生产过程是模拟计算是否准确的关键。本文根据实际生产中的操作程序为每个单元操作设备准确建立了包括SIP 及CIP 在内的生产过程,以3 000 L 发酵罐为例,如图2所示。
3.2 工艺参数
建立模型时,各单元设备工艺参数输入的准确性直接影响物料衡算及热量衡算的结果。主工艺设备的一些主要工艺参数[2-4],如表1及表2所示。
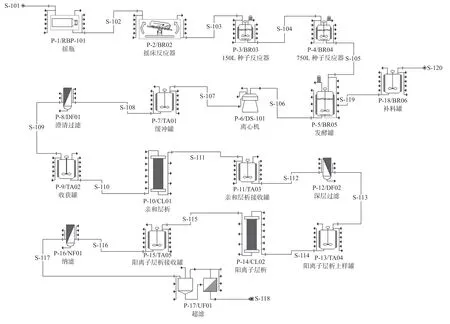
图1 工艺流程图Fig.1 Process flow diagram

图2 发酵罐生产过程Fig.2 Operation sequence for fermenter
4 模拟结果及分析
4.1 产能分析
输入以上生产过程及工艺参数后,经软件计算自动得出图3所示的结果,从摇瓶培养到原液分装总共耗时24.85 d。在单抗的生产工艺中,通常发酵罐都会成为制约产能的瓶颈,本项目在设计初期已考虑到产能的需求,采用了3 台3 000 L 发酵罐交错生产,所以每3.97 d 即可收获一批产品,满足项目实际需求。由图3还可看出,在只生产一种产品时,每年可生产77 批产品。
在图4的界面中输入产品品种数为2,经软件计算自动得出每多生产一个品种,年生产批次将减少5批。这是因为上游种子培养发酵需要彻底清场,即在一种产品上游工序生产完成后,另一种产品才能从种子培养开始,而从种子培养到发酵结束收获约为20 d;由此可知,每多生产一个品种将浪费20 d 的生产时间,此数据对于合理安排生产具有重要意义。
4.2 生产瓶颈分析
本项目下游纯化工段需在4 d 内完成生产,其中包括澄清过滤、亲和层析、深层过滤、阳离子层析、纳滤及超滤等多个单元共用到15 种缓冲液,根据生产需要缓冲液均在使用前一天配制;这样平均每天需配制4 种缓冲液。按照项目要求,配液岗位是2 班制生产,也就是说要在16 h 内完成4 种缓冲液的配制,且每次配制都要对配制罐进行SIP 及CIP。由此可以预见配液岗位的生产压力较大。

表1 上游主要设备工艺参数Tab.1 Process parameters of main equipment for upstream
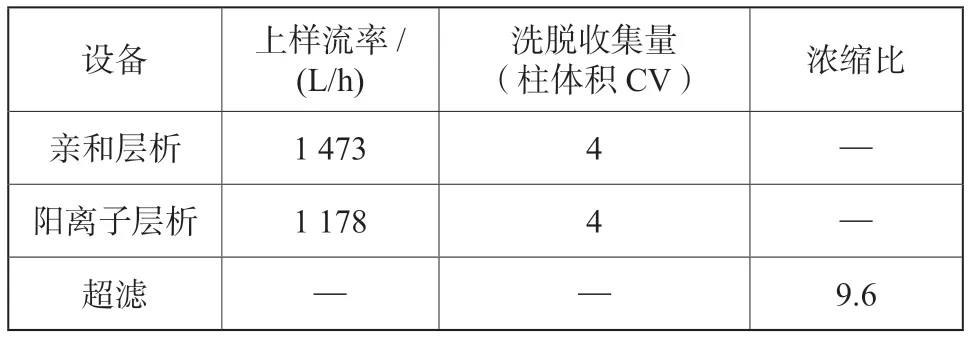
表2 下游主要设备工艺参数Tab.2 Process parameters of main equipment for downstream
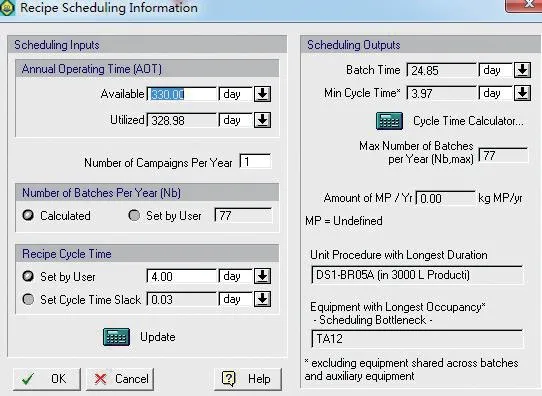
图3 单一产品产能分析Fig.3 Capacity analysis for single product
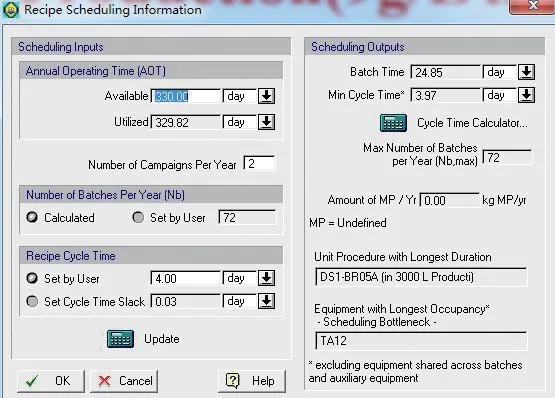
图4 多产品产能分析Fig.4 Capacity analysis for multi-product
如图3所示,正如预想的情况3 000 L 配液罐(TA12)成为生产瓶颈;因为15 种缓冲液中有7 种需要3 000 L 配液罐来完成,也就是说平均每天需要两次使用3 000 L 配液罐;所以在设计初期已设计2台3 000 L 配液罐用来建模。通常情况下可以通过增加配液罐来破除瓶颈;但因为3 000 L 的发酵罐完成发酵需9 d,4 d 作为一个生产周期是合理的;这与设计预期相符。3 000 L 配液罐在第1 d 和第4 d 均需使用,占用时间久,不需要再增加配液罐来破除瓶颈。
4.3 工艺设备利用率分析
前面提到为了满足生产需求,设计了2 台3 000 L 配液罐。下面将对这两台配液罐的时间利用率进行分析,从而验证设计的合理性。
如图5所示,3 000 L 配液罐TA13 的时间利用率为50.5%,闲置时间占比49.5%;TA12 的时间利用率为48.68%,闲置时间占比51.32%;两者的闲置时间占比达到了100.82%。理论上用一台配液罐就可以完成配液需求;但配液岗位是2 班生产制,一天工作时间只有16 h,即每批次的净生产时间为2.67 d;而两台配液罐的时间占用率为99.18%,即每批次需净生产时间3.97 d。故选择2 台3 000 L 配液罐是合理的。
4.4 CIP 站的利用率分析
如图6所示,从CIP 时间点来看,CIP 站需求峰值为3 套且峰值的工段出现在下游除病毒前、缓冲液配制及缓冲液暂存。理论上总共只需要3 套CIP站即可满足生产需求。但考虑到空间布局及操作便利行的需要,如上游含生物活细胞与下游不含生物活细胞的CIP 站需分开设置;下游纳滤除病毒前和纳滤除病毒后的CIP 站需分开设置;所以理论上至少需要4 套CIP 站才能满足生产需要。即上游1 套(CIPUPS1),下游除病毒前1 套(CIP-DSP1),培养基配制1 套(CIP-Media),下游除病毒后、缓冲液配制及缓冲液储存共用1 套CIP 站(CIP-DSP2)。
显然在生产批次时间内利用1 套CIP 站完成下游除病毒后、缓冲液配制及缓冲液储存系统共21 台储罐28 次的清洗任务的难度是非常大的。图7显示前一批设备(蓝色)还未清洗完毕,下一批设备(橘色)已开始清洗;这时CIP 站成为了生产的瓶颈,通过软件的计算将批次时间将延长到5.5 d,才不会出现设备清洗跨越批次的情况。
在实际生产中也不允许辅助设备影响产品产能的情况发生,所以增加一套CIP 站更符合实际需求。
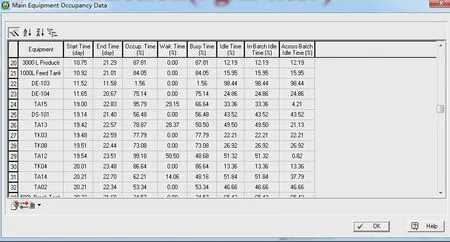
图5 工艺设备的时间利用率Fig.5 Time utilization for process equipment
4.5 注射用水系统需求分析
图8中红色曲线表示WFI 瞬时流量,绿色曲线代表每天用水累积量,蓝色曲线代表每天平均用水量。由图8可知,天峰值用水量为30 t/d 出现在第29 d;天最大平均用水量1.25 t/h 出现在第29 d;瞬时峰值用量为15 t/h 出现在第23、27 及31 d。

图6 CIP 站需求Fig.6 CIP skid requirement
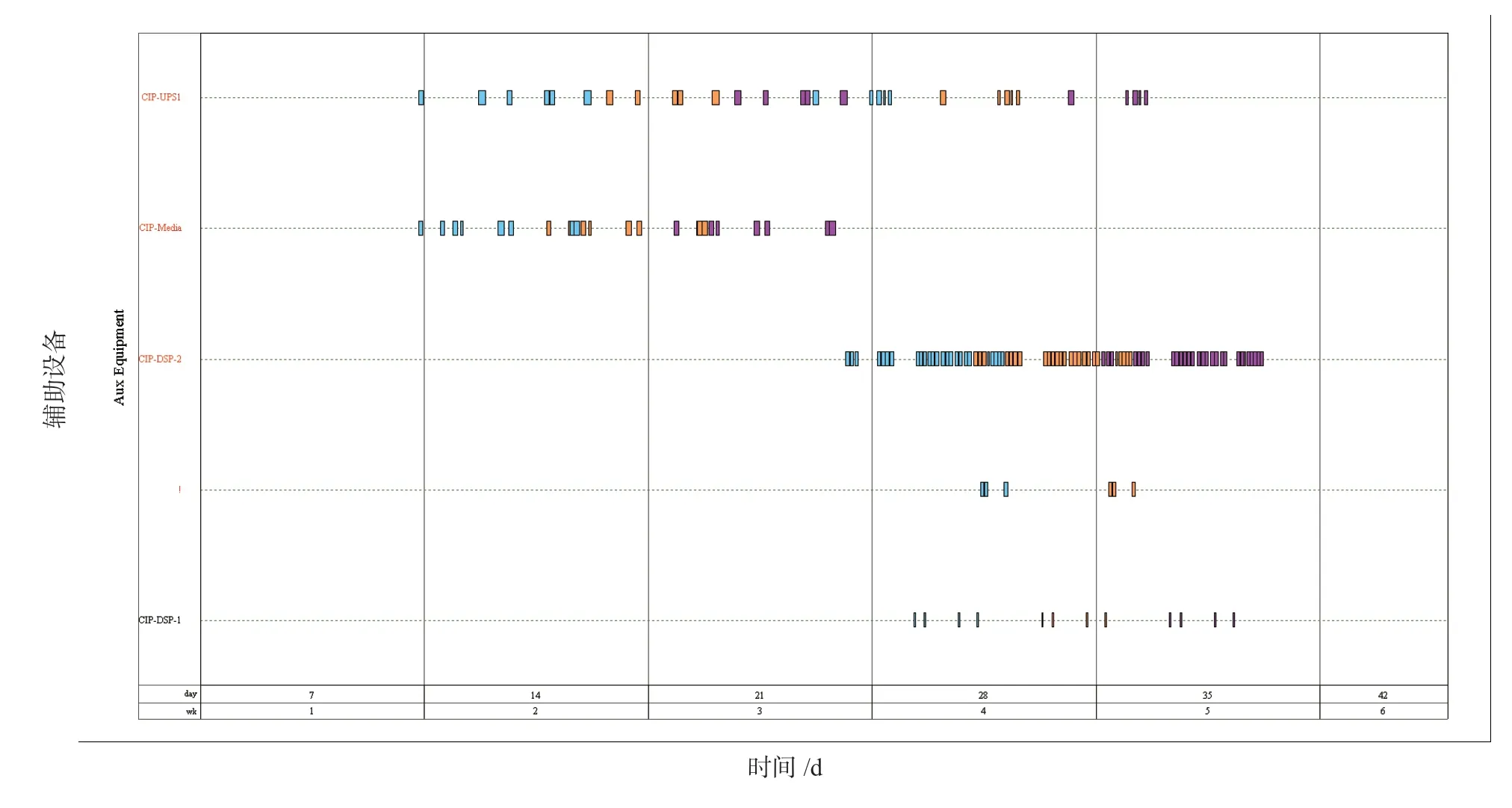
图7 CIP 站占用图Fig.7 CIP station occupancy chart

图8 注射用水消耗Fig.8 WFI consumption
由图8可知天峰值用水量30 t/d 出现在第29 d,但前5 h 就已经用了18.5 t 注射用水,平均每小时用水3.7 t;故拟选择4 t/h 蒸馏水机及15 t WFI 储罐利用模型校核蒸馏水机及WFI 储罐的选型是否合 理。
如图9所示,当选用4 t/h 蒸馏水机及15 tWFI储罐时,设置储罐液位在50%时开启水机补水,液位达85%时停止补水;可以得到WFI 储罐的最低液位为21.28%。说明蒸馏水机及WFI 储罐的选型是合理的。
5 结论
本文应用生物过程模拟软件Superpro Designer,对单抗生产过程进行模拟分析,找出生产过程的瓶颈,分析去除瓶颈的必要性及方法,分析主要设备的利用率并验证设备选型的合理性,主要结论如下:
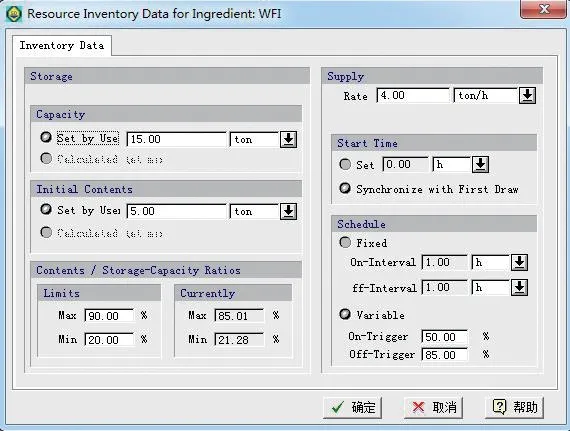
图9 蒸馏水机及注射用水储罐选型Fig.9 Selection for water distiller and WFI tank
(1)由图3及图4生产批次数据可知,一条生产线在只生产一种产品的前提下,一年可生产77 批。每多生产一种产品,年生产批次将减少5 批。
(2)由图3可知,生产的瓶颈是3 000 L 的配液罐(TA12),但其最小循环时间为3.97 d,小于批次生产时间;故不需破除此瓶颈。
(3)由图5可知,在按两班生产的前提下,一台3 000 L 配液罐无法完成配液需求,需设计两台3 000 L 配液罐。
(4)由图6、图7分析可知,考虑到空间布局、操作需要及CIP 站实际利用率的因素,设计5 套CIP站是合理的。
(5)由图8、图9可知,利用模型分析验证选用4 t/h 的蒸馏水机和15 t 的注射用水储罐是合理的。
