幽门螺杆菌感染小鼠模型的应用进展
2021-05-19马郁荃谷海瀛
朱 媚,马郁荃,谷海瀛,2*
(1.宁波大学 医学院,浙江 宁波 315211;2.宁波大学医学院附属医院,浙江 宁波 315020)
幽门螺杆菌(Helicobacter pylori,H.pylori)是一种持续定植于胃肠黏膜有鞭毛的革兰阴性微需氧致病菌[1].H.pylori感染是慢性胃炎、消化性溃疡的主要致病因素,并且与胃黏膜相关淋巴组织淋巴瘤、胃癌的发生密切相关.H.pylori感染也可能与缺铁性贫血(IDA)、特发性血小板减少性紫癜(ITP)、阿尔茨海默病(AD)等胃肠外疾病有关[2-3].H.pylori感染非常普遍,全球总感染率为44.3%,发展中国家明显高于发达国家[4].H.pylori致病机制探索、新型治疗药物筛选和疫苗制备都需要建立合适的动物感染模型.
悉生乳猪是最早成功制备H.pylori感染的动物模型,H.pylori感染的悉生乳猪只出现了淋巴细胞性胃炎,但没有出现胃溃疡或胃癌等其他典型病变[5].由于乳猪实验观察时间比较短,因此无法研究其慢性感染[6].H.pylori感染的恒河猴会出现萎缩性胃炎,但没有发展为消化性溃疡或胃癌等病变[7].研究人员可以使用胃镜连续观察恒河猴胃部病变[6],但实验观察周期较长.悉生乳猪和恒河猴的饲养条件复杂,价格昂贵,因此都难以推广.H.pylori感染的豚鼠只出现了慢性胃窦炎,没有发生萎缩性胃炎、消化性溃疡和胃癌等病变[8],因此豚鼠仅适用于建立H.pylori感染的胃炎模型.H.pylori感染的蒙古沙鼠会出现萎缩性胃炎、胃溃疡、肠上皮化生以及胃腺癌等疾病[9],但目前缺乏生产转基因沙鼠的方法,因此研究H.pylori感染过程中宿主沙鼠的作用受到了限制[10].尽管小鼠不是H.pylori感染的最适动物模型,但小鼠是研究H.pylori致病性使用最广泛的动物宿主[10].小鼠遗传背景明确、品系丰富、繁殖周期短、饲养方便、价格便宜,小鼠相关的实验试剂也较多,并且基因工程小鼠在不断增加,因此小鼠仍然是研究H.pylori的主要动物模型[9].
1 H.pylori 感染消化系统疾病的小鼠模型
早期研究表明H.pylori感染宿主的范围有限,临床分离菌株不易定植于小鼠胃黏膜.1997 年Lee等[11]首次使用H.pylori悉尼菌株(Sydney Strain,SS1)成功建立了小鼠感染模型,组织病理学和培养结果显示该菌株在C57BL/6 小鼠胃部有较好定植载量.野生型小鼠可用来制备H.pylori感染胃炎模型,还可用于测试不同H.pylori突变株的定植特性[10].在不使用基因工程小鼠或化学致癌物的情况下,单独的H.pylori感染野生型小鼠不会诱发胃癌[12].基因敲除和转基因小鼠模型还可用来制备H.pylori感染的肠上皮化生、异型增生或胃癌等模型,并可用于评估特定宿主基因在H.pylori定植感染和胃癌进展中的作用.H.pylori感染消化系统疾病小鼠模型的制备方法和结果参照表1.
1.1 活动性胃炎和萎缩性胃炎
Lee 等[11]使用H.pyloriSS1 感染不同品系的小鼠,发现菌株在C57BL/6 小鼠体内表现出现较高的定植水平.感染3.5 个月时的C57BL/6 小鼠胃窦和胃体出现了轻度胃炎,感染6 个月时的胃炎明显加重,感染8 个月时小鼠出现了慢性活动性胃炎以及胃体黏膜萎缩变化.Kim 等[13]使用H.pyloriSS1感染C57BL/6 小鼠,感染8 周时的小鼠胃底和胃窦固有层和黏膜下层均可见炎性细胞浸润;感染16周和24 周时的胃黏膜中单核细胞增多,胃底可见腺体萎缩;感染36 周时的小鼠胃壁增厚,黏膜折叠肥大;感染50 周时的胃黏膜增生达到峰值,胃腺损失更加明显;感染80 周时的胃窦出现了增生性胃炎,而胃体和胃底出现了萎缩性胃炎,但未观察到胃溃疡或胃癌.
1.2 化生、异型增生和胃癌
Kuzushita 等[14]使用H.pyloriSS1 感染p27−/−C57BL/6 小鼠模型,感染30 周和45 周时的小鼠胃部肠上皮化生发生率是40%(4/10)和67%(4/6),感染60 周时,58%(7/12)小鼠出现异型增生和胃腺癌,其胃部炎症和病变进程与人类肠型胃癌相似,而SS1 感染的野生型小鼠没有出现胃癌.他们认为p27 缺失和H.pylori定植是导致该模型形成胃癌的必要因素.该小鼠模型可用于H.pylori感染相关肠上皮化生、异型增生和胃癌的研究.Fox 等[15]使用H.pyloriSS1 感染TFF2−/−C57BL/6×Sv129 小鼠,感染6 个月和19 个月时的小鼠胃黏膜IFN-γ 水平显著提高,小鼠胃窦出现了严重的异型增生.他们认为H.pylori感染过程中,TFF2 可能通过调节IFN-γ 水平来保护胃黏膜和抑制炎症.该实验为研究H.pylori感染的异型增生提供了很好的模型[16].Nam 等[17]先给iNOS−/−C57BL/6 小鼠和野生型C57BL/6 小鼠服用N-甲基-N-亚硝基脲(MNU),再使用H.pyloriSS1 感染小鼠,实验结果显示iNOS缺乏型小鼠的胃肿瘤发生率是31.0% (9/29),而野生型小鼠是72.7% (16/22).他们还发现iNOS 缺乏能引起NO 水平下降,有助于降低H.pylori相关胃癌的发生.
2 H.pylori 感染非消化系统疾病的小鼠模型
动物模型也是研究H.pylori感染对非消化系统疾病疾影响的重要工具,目前已经用于研究H.pylori非消化系统的小鼠模型见表2.H.pylori感染还被报道可能与慢性荨麻疹、帽状息肉病、帕金森病、动脉粥样硬化和脑卒中等呈正相关,与哮喘、肥胖等疾病呈负相关,但这些相关的因果关系尚未证实[2-3],能否通过小鼠模型来证实H.pylori感染与这些疾病的关系有待研究.
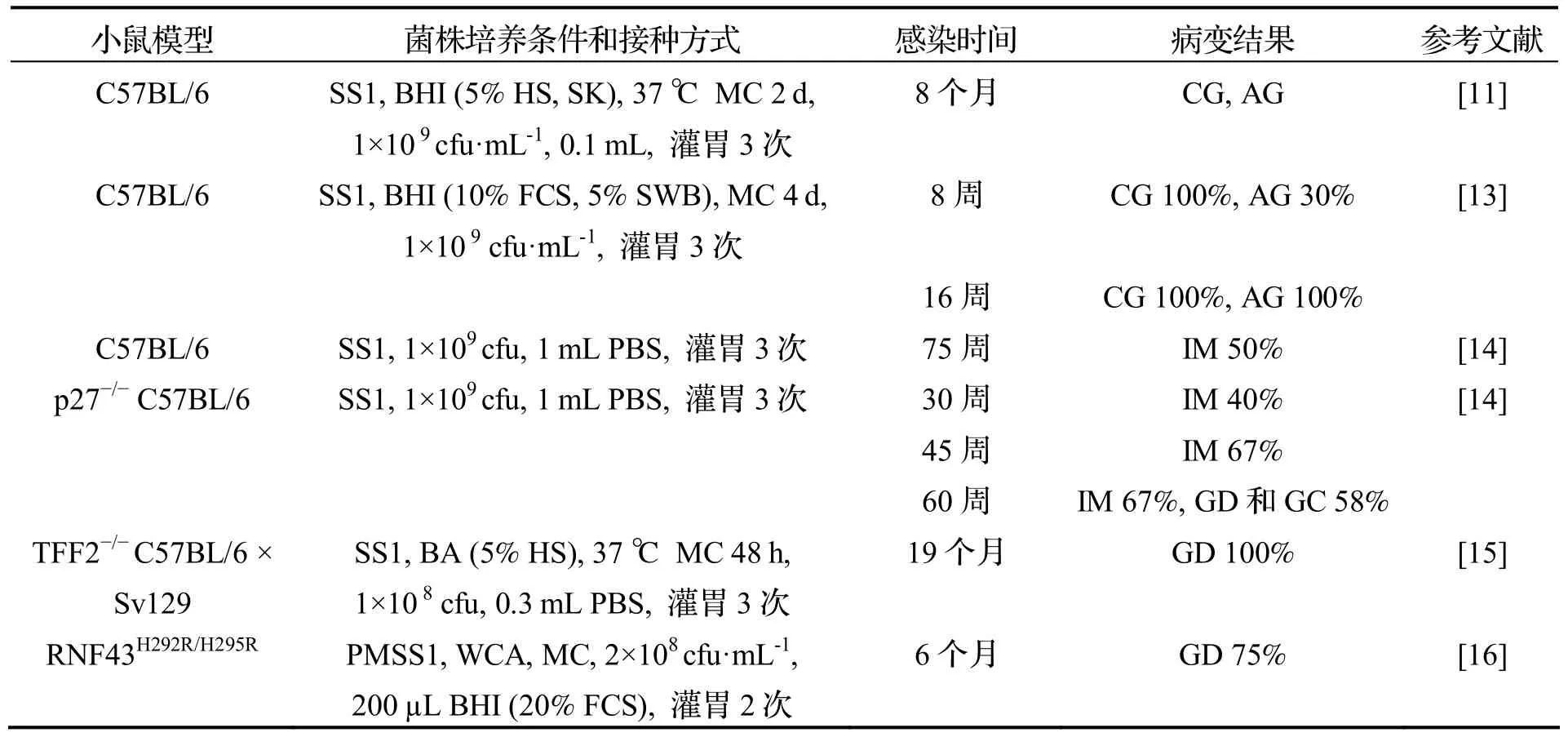
表1 H.pylori 感染小鼠模型的制备方法和结果(消化系统疾病)
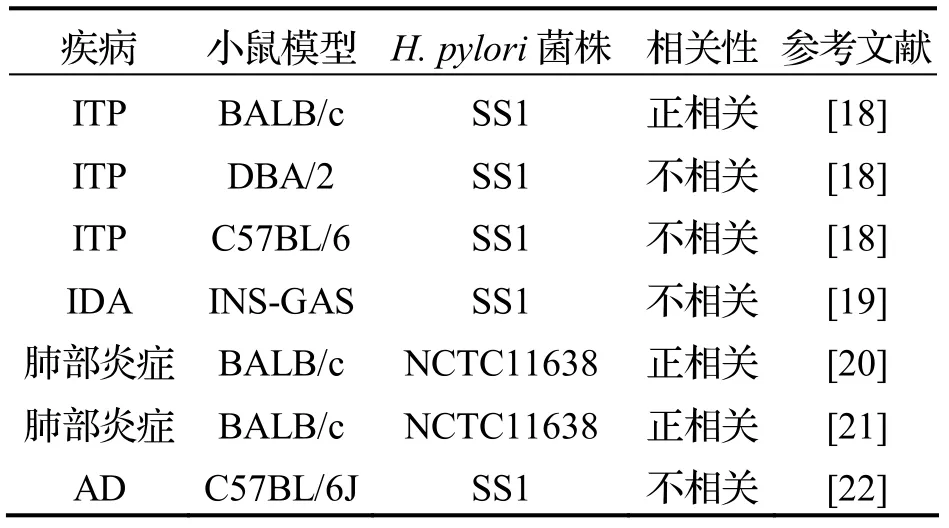
表2 H.pylori 感染小鼠模型(非消化系统疾病)
2.1 血液系统
H.pylori感染被认为可能与IDA和ITP发生有关[2].Fukuda 等[18]使用H.pyloriSS1 灌胃不同品系小鼠来研究H.pylori感染与ITP 的关系,发现BALB/c 小鼠感染后,血小板计数显著减少.结果表明H.pylori感染与ITP 呈正相关,但H.pyloriSS1 感染的DBA/2 和C57BL/6 小鼠模型与ITP 发生没有相关性.Burns 等[19]使用H.pyloriSS1 感染INS-GAS 小鼠模型,小鼠感染后的血红蛋白和红细胞计数减少,而红细胞平均体积升高.结果表明小鼠出现的贫血是再生性贫血,而不是大多数缺铁性贫血时典型的小细胞性、非再生性贫血,提示H.pylori慢性感染的INS-GAS 小鼠模型与IDA 没有相关性.这些研究均提示H.pylori感染对胃肠外疾病的影响与模型动物宿主的选择密切相关.
2.2 呼吸系统
近年来已有研究人员使用小鼠模型来探索H.pylori对肺部的影响.Arismendi 等[20]使用H.pyloriNCTC 11638 经气管感染BALB/c 小鼠,小鼠感染后肺组织H.pylori培养阳性,感染7 d 时的肺泡出现中性粒细胞浸润,感染14 d 时的炎性细胞侵润加重并出现肺纤维化,感染30 d 时的肺组织严重纤维化进而影响到肺功能.实验表明H.pylori感染导致肺组织形态学改变、炎性细胞增多和肺实质细胞退化,提示H.pylori感染与肺部炎症呈正相关.Arismendi 等[21]使用同样方法感染BALB/c 小鼠来评估H.pylori感染对肺部炎症标志物表达的影响,小鼠感染后的肺水肿指数上升,支气管肺泡灌洗上清液中活细胞百分比下降,而乳酸脱氢酶上升,小鼠肺组织染色可见典型H.pylori.实验表明,H.pylori经气管感染的小鼠出现肺部炎症反应,提示H.pylori感染与肺部炎症呈正相关.
2.3 神经系统
最近流行病学研究发现H.pylori感染可能与AD 发生有关[22],而生活条件或教育水平等因素与H.pylori感染和AD 都有关,这些共同的影响因素会导致流行病学研究结论具有局限性[23],因此有研究人员使用小鼠模型进行动物实验来探索H.pylori感染与AD 的关系.Baudron 等[22]使用H.pyloriSS1 灌胃C57BL/6J 小鼠,小鼠感染18 个月的后脑内没有出现淀粉样斑块和脑神经炎症,并且脑内也检测不到H.pyloriDNA.实验结果表明H.pyloriSS1 感染的C57BL/6J 小鼠没有发生AD,提示H.pylori感染与AD 发生没有相关性.
3 探索H.pylori 生物被膜作用与宿主因素的小鼠模型
3.1 H.pylori 生物被膜作用
既往研究表明H.pylori致病性与细胞毒素相关蛋白A、空泡毒素A、脲酶、鞭毛、黏附素和外膜蛋白等毒力因子有关[10].新的研究和观点认为生物被膜的形成在H.pylori定植过程中也扮演着重要角色[24],已有研究人员使用小鼠模型对H.pylori生物被膜形成进行初步探索.Attaran 等[25]使用胃炎患者分离株H.pylori19B和4B感染C57BL/6J 小鼠模型,利用抗H.pylori特异性免疫荧光抗体和扫描电子显微镜检测小鼠胃部H.pylori的定植和生物被膜形成能力,发现小鼠感染后的胃黏膜出现了明显的慢性炎性细胞浸润,球性H.pylori嵌套在无定形基质中,牢固地附着在鳞状上皮和腺上皮上,表明H.pylori能在小鼠胃的各个部位形成生物被膜.实验证实C57BL/6J 小鼠体内H.pylori生物被膜的形成.但目前尚不清楚体内生物被膜基质是由细菌自己产生还是由宿主衍生,生物被膜是否为H.pylori提供了更有利的定植生态位也不明确,生物被膜在增加抗生素耐药性和干扰免疫清除中的作用也不清楚[24],这些都需要更多的动物模型进一步研究.
3.2 H.pylori 感染的宿主小鼠因素
近年来,基因工程小鼠广泛用于研究H.pylori感染过程中细菌与宿主因素的相互作用.Muthupalani 等[26]使用 Muc5ac−/−小鼠模型研究黏蛋白Muc5ac 在H.pylori感染中的作用,他们发现该小鼠模型倾向于在胃窦幽门区域自发性地出现上皮增生,而H.pylori感染可以减弱其胃体黏膜上皮化生.该研究表明Muc5ac 能维持胃窦上皮细胞平衡,并抑制H.pylori定植感染.Suarez 等[27]使用C57BL/6Nod1−/−和INS-GASNod1−/−小鼠模型来研究天然免疫受体NOD1 在H.pylori定植感染中的作用,他们发现Nod1的缺乏会导致H.pylori感染,引起更严重的炎症和损伤,改变胃黏膜内趋化因子和细胞因子的表达组合,加速胃癌的发生.他们认为Nod1可能是通过改变巨噬细胞极化来发挥其限制作用,而Nod1的缺乏会有助于H.pylori逃避宿主免疫清除.Neumeyer 等[16]使用RNF43H292R/H295R小鼠模型研究H.pylori慢性感染在小鼠胃部病变进程中的作用,他们发现H.pylori感染加重了肿瘤抑制因子Rnf43突变小鼠的胃部病变,导致小鼠胃部CD44 表达增加,而NF-kB 信号过度激活.研究表明Rnf43突变与H.pylori引起的持续慢性炎症共同促进了胃部恶性肿瘤的发生,他们推测H.pylori感染激活NF-kB 会进一步上调CD44 的表达,从而导致胃部病变向更严重的方向发展.
4 总结与展望
不同动物对H.pylori感染表现出不同的宿主反应和免疫应答,没有任何一种动物感染模型能够完全复制出H.pylori感染人类引起的所有病理结果.目前尚未见H.pylori感染导致小鼠出现胃溃疡或十二指肠溃疡的报道,能否开发出H.pylori感染小鼠的消化性溃疡模型还不清楚.提高小鼠感染模型的稳定性和可复制性,使其在更短时间内更好地模拟人类感染后的病变还有待探索合适的实验条件.
