二次离子电池高比容量负极碳载体的研究进展
2021-05-17王晓一
李 旭,王晓一,孙 洁
(天津大学化工学院,天津300350)
随着便携式电子设备和电动汽车的迅速发展,对可移动储能设备的要求不断提高,因此开发更高能量密度和功率密度的二次电池尤为重要. 目前,针对二次电池的开发主要集中在碱金属离子二次电池,如最常见的锂离子电池(LIB)和钠离子电池(SIB). 目前商业化的锂离子电池负极主要使用碳材料,作为一种插层/嵌入反应机制的负极材料,其循环性能较为优异,但是比容量较低,如商业化石墨负极比容量已接近理论比容量(372 mA·h·g-1[1]),因此,一些高比容量的负极材料受到关注. 合金反应机制负极材料,如硅[2,3]、磷[4,5]、锗[6,7]及锡[8,9]等具有较高理论比容量,但是在循环过程中产生的巨大体积变化缩短了循环寿命. 沉积/溶出反应机制的负极材料,如金属锂[10,11]、金属钠[12,13]等,其理论比容量也远高于碳材料,但是在循环过程中产生体积膨胀和枝晶问题限制了实际应用. 为了解决合金反应机制与沉积/溶出反应机制高比容量负极材料的固有缺陷,设计出不同功能化的载体材料与其复合. 本文针对高比容量负极材料的电化学性能差和安全性问题,综述了载体结构设计在提升高比容量负极材料性能中的研究进展.
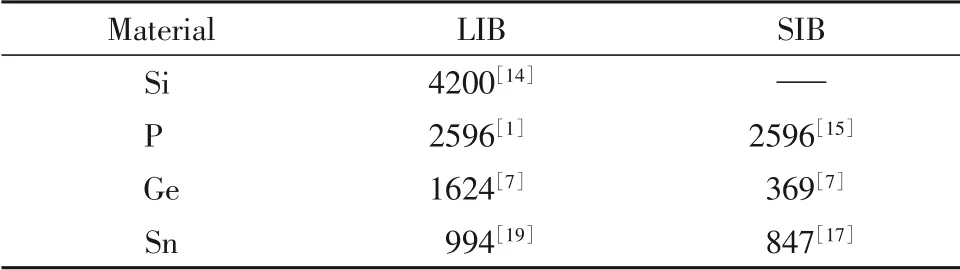
Table 1 Theoretical specific capacity(mA·h·g-1) of Si,P,Ge and Sn anodes for LIB and SIB
1 高比容量负极存在的问题
合金型负极(硅、磷、锗、锡)由于具有较高的理论比容量(表1)引起了广泛关注. 但是在循环过程中,合金型负极与金属离子形成合金相时会引起巨大的体积变化(300%~420%,硅[14]、磷[15]、锗[16]、锡[17])产生的应力使材料破裂甚至粉化,导致容量和循环性能迅速下降;其次,由于硅和磷为非金属,其电子导电性较差,不利于制备具有高倍率性能的负极. 金属锂和金属钠的理论比容量分别 为3860 mA·h·g-1[18]和1165 mA·h·g-1[13],但 是将其直接用作负极材料,充电时在金属表面易形成枝晶,严重可能刺穿隔膜而引起电池短路问题,造成极大的安全隐患;且表面形成的固体电解质界面(SEI)膜不稳定,循环过程中导致活性物质损失的同时致使容量快速衰减,缩短了电池的使用寿命.因此,高比容量负极材料很难直接作为负极使用,需要借助载体材料克服其固有缺陷来提升电化学性能[19].
碳作为生物界中含量最高的元素,碳材料由于具有来源广泛、稳定性高、导电性好及便于调控等特点,常用作二次电池负极材料的载体. 碳载体的多孔结构为活性材料在循环过程中的体积膨胀提供了充足的缓冲空间,有助于提升电极材料的稳定性;高比表面积有助于提高活性物质的负载量;高导电率通过促进电子/离子的传输以提升材料的倍率性能. 此外,通过调控碳载体的杂原子掺杂和界面特性,有助于增强载体和活性物质之间的作用力,减小界面阻抗,对于提升二次电池的循环寿命具有十分重要的意义.
2 高比容量负极载体
随着对高比容量负极材料研究的不断深入,对碳载体的要求也不断提高,根据不同负极材料的特点对碳载体进行设计和调控已成为研究热点. 本文从碳载体的孔结构、比表面积、电子导电率、离子导电率、杂原子掺杂和界面修饰的角度,探索了碳载体的不同结构性质对负载高比容量负极材料的影响规律,综述了碳载体应用于硅基、磷基、锗基、锡基负极以及金属负极的研究进展.

Fig.1 Schematic illustration of the advantages of the HHPCNSs as the host of red P(A)[20],reversible capacity of GEC-750 and GEC-850 at 0.5C(B), TEM images of GEC-750 before(C)and after(D)1000 cycles[21]
2.1 孔结构
合金型负极和金属负极在充电过程中均会造成体积膨胀问题,具有孔结构的碳载体对于缓冲上述材料的体积膨胀十分重要.
无载体的锂金属在沉积/溶解过程中体积变化大,随之产生的应力会引起锂金属表面形态的变化,生成不稳定的SEI膜,严重影响电极材料的比容量和循环寿命. Shen等[18]以二茂铁和邻二氯苯为原料利用化学气相沉积(CVD)法在铜箔上原位生长三维CNTs sponge(C-host@Cu),孔隙率高达99%,高孔隙率提供了足够的空间储存锂,并且可以缓冲其体积变化,提高循环稳定性. 与裸铜箔(Bare Cu)相比,C-host@Cu在1 mA/cm2的电流密度下循环250次,库仑效率高达99%. Liu等[20]制备出均匀分布的蜂窝状分层微孔-介孔碳纳米球(HHPCNSs)并负载红磷,孔体积可达3.258 cm3/g,超大的孔体积为磷的体积膨胀提供了足够的空间[图1(A)]. Ngo等[21]通过调控碳化温度,制备出2种不同孔体积的锗碳负极材料GEC-750 和GEC-850,根据N2吸附-脱附测试结果,GEC-750 的孔体积达到0.321 cm3/g,而GEC-850的孔体积只有0.016 cm3/g. GEC-750和GEC-850的孔体积相差近20倍,因此导致在0.5C倍率下,GEC-750 的比容量接近GEC-850 的2 倍[图1(B)],即使循环1000 次后,GEC-750 的形貌在循环前后也未发生明显变化[图1(C,D)]. 锗在循环过程中体积膨胀率高,易造成材料的粉化而影响比容量,而碳载体上的孔为锗的体积变化提供了缓冲空间;此外,碳载体也可作为缓冲层来减小膨胀所带来的应力变化.
除了活性物质沉积在碳载体之外,碳载体还可通过包覆的方式负载活性物质,通过优化设计碳载体与活性物质之间空体积尺寸,使合金型负极和金属负极在循环过程中的体积膨胀恰好充满整个空隙,实现对空间的高效利用,有助于提升电极材料的比容量和循环性能. Wang等[22]制备了一种由间苯二酚-甲醛树脂包覆的硅纳米颗粒,碳化后形成硅碳负极材料. 在保证间苯二酚和甲醛比例不变的条件下,通过改变反应溶液中二者的含量,可以直接控制空体积的大小. 根据空体积由小到大分别制备出Si@void@C-s,Si@void@C-m和Si@void@C-l 3种负极材料[图2(A)~(C)],对其进行循环性能测试发现,Si@void@C-s和Si@void@C-l循环稳定性较差,Si@void@C-m循环性能最为优异[图2(D)]. 由于空体积较大,在循环过程中硅纳米颗粒移动会导致其与碳壳之间接触不良,降低了电子导电率和离子导电率. 较小的空体积不能完全容纳硅纳米颗粒的体积膨胀,引起碳壳破裂从而影响循环稳定性.
碳载体的孔容不仅为合金型负极和金属负极的体积膨胀提供了缓冲空间,孔径大小对于活性材料的负载量及电化学性能也有一定影响. 大孔径碳载体虽可提升活性材料的负载量,但孔径过大时会引起活性物质负载厚度的增加,不仅延长了离子和电子的传输路径导致材料的倍率性能下降,还会造成循环过程中活性物质脱落,导致容量衰减和循环稳定性下降. 因此,适当缩小孔径十分必要. Li等[23]以ZIF-8为碳源,通过酸刻蚀法制备出一种孔径小于1 nm的微孔碳载体(N-MPC)[图2(E)],微孔结构在循环过程中阻止活性物质颗粒团聚因而可提高循环稳定性. 以N-MPC为载体通过蒸发-冷凝法制备的磷碳负极(P@N-MPC)在1 A/g电流密度下循环1000次后容量仍保持在450 mA·h·g-1.
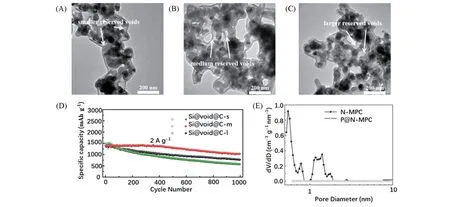
Fig.2 TEM images of Si@void@C-s(A), Si@void@C-m(B) and Si@void@C-l(C), cycling performance of Si@void@C-s,Si@void@C-m and Si@void@C-l(D)[22],pore size distribution curves of N-MPC and P@N-MPC(E)[23]
2.2 比表面积
碳载体的高比表面积有助于提高金属负极与合金型负极的负载量和循环稳定性. 金属锂负极初始成核阶段对于其沉积形态非常重要,提高碳载体比表面积可有效降低局部电流密度,缩小锂的成核尺寸以抑制锂枝晶的形成,提高金属锂负极的循环稳定性. Liu等[24]以聚丙烯腈为碳源,经KOH活化后制备出一种比表面积高达2396 m2/g的碳载体并用于负载锂金属,在20 mA/cm2超高电流密度下能稳定循环130次.
高比表面积的碳载体可增加活性物质的负载量,从而提升负极材料的比容量. Sun等[25]报道了一种以椰子壳为碳源,经KOH活化后的生物质多孔碳,其比表面积达1445 m2/g,以此为碳载体通过蒸发-冷凝法制备出P/C 负极材料. 碳载体高比表面积为磷的沉积提供了更多活性位点,磷的负载量可达50%,P/C 负极比容量达2173 mA·h·g-1. Wu 等[26]将石墨烯和MOF-5 复合制得比表面积高达1313.05 m2/g的碳载体(C-GO/MOF-5)[图3(A)],通过蒸发-冷凝法使红磷的负载量达到44.5%. Sun等[27]以聚丙烯腈为碳源,通过静电纺丝法制备了一种多孔多通道的碳纤维(PMCNFs),其比表面积达1796.4 m2/g,通过蒸发-冷凝法制备的磷碳负极(P@PMCNFs)中磷的负载量为60%,高活性物质负载量使其在2 A/g的电流密度下循环920次后比容量保持在700 mA·h·g-1.
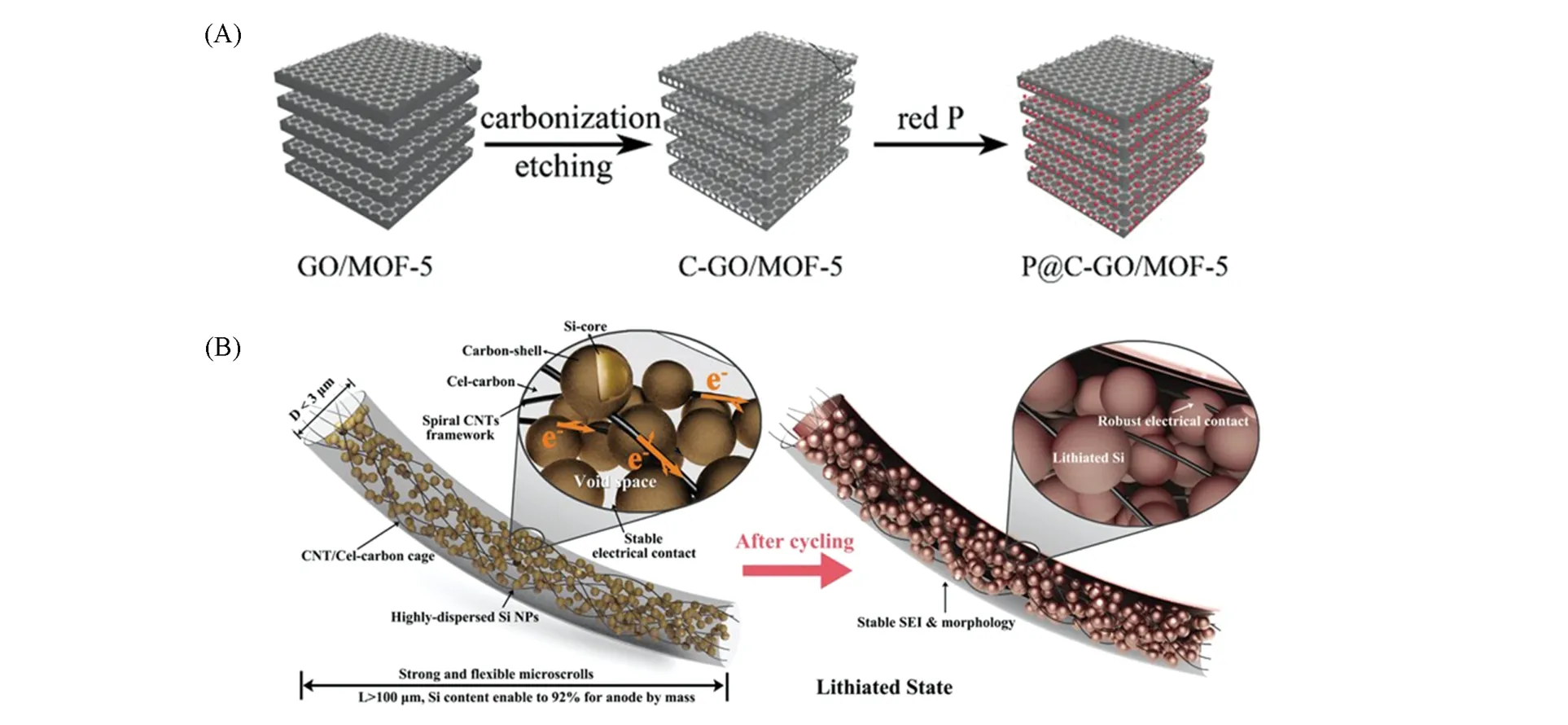
Fig.3 Schematic illustration of the encapsulation of red P into the C-GO/MOF-5 porous carbon(A)[26]and the schematic illustration of Si@CNTs/C(B)[29]
碳载体的高比表面积可通过减小合金型负极与电解液的接触面积来提高电极的比容量和稳定性.Yi等[28]以Ni作为催化剂,在多孔的硅微球中原位生长CNTs,制备Si/CNTs负极. 纯硅微球的比表面积为78.2 m2/g,引入CNTs 载体后材料的比表面积降至13.5 m2/g,活性物质比表面积的降低可防止电解液渗透到内部,仅在硅微球外表面形成稳定的SEI膜,提高了电极材料的循环稳定性. 在1 A/g电流密度下循环400次容量可达715.5 mA·h·g-1.
2.3 电子导电率
硅和磷的电子导电率较低,不利于电子在电极内部的快速传输. 碳是电子良导体,构筑三维高导电性碳作为载体能有效提升其倍率性能. 红磷的电子导电率为10-14S/cm[15],Sun等[25]报道了一种椰子壳为前体的三维导电碳载体,与红磷复合制备出P/C负极. 交联的三维导电碳网为电子的快速传输提供路径,P/C 负极的电子导电率提升至2.3 S/cm,在6C 倍率下比容量高达1829 mA·h·g-1,相当于在10 min内充满84%的电量,为制备快充型负极提供了基础. CNTs由于具有较高导电性,常用来构建三维导电网络,提升电极材料的导电性. Wang等[29]以纤维素纳米片、CNTs 及硅纳米颗粒为原料制备了一种电子导电率可调控的硅碳负极(Si@CNTs/C)[图3(B)],当CNTs含量为1.8%~21%,其电子导电率为31.6~421 S/cm,比纯硅电子导电率(10-3S/cm[30])高4~5个数量级. 其中电子导电率为211 S/cm的样品在5 A/g大电流密度下比容量达到1016 mA·h·g-1,且循环后可形成稳定的SEI膜.
对于金属负极,通过调控碳载体的电子导电率可以诱导金属均匀沉积,提高负极的循环稳定性.Lu等[31]以甲烷为碳源,通过介孔等离子体化学气相沉积(MPCVD)法,在三维碳纸(CP)上生长出一层海绵状碳(SC),将其整体(SCCP)作为碳载体负载金属锂. 经电阻测试,SCCP整体截面电阻近似为CP的100倍,说明SC的电子导电率远低于CP,锂离子会优先在CP的多孔空间中进行沉积,而SC作为物理屏障,可通过机械作用阻止枝晶向电解液方向生长,提高了电池的安全性.
2.4 离子导电率
电子导电率影响电荷转移控制步骤动力学,离子导电率影响扩散控制步骤动力学,因此提升材料的离子导电率也有利于制备高倍率性能的负极材料. 对碳载体的合理设计可缩短离子的传输距离,提高材料的离子扩散系数. Wang等[22]制备了一种碳包覆的硅负极材料M-Si@void@C,经恒电流间歇滴定技术(GITT)测试发现其在嵌锂/脱锂过程中锂离子扩散系数均高于Bare Si[图4(A)~(C)],在10 A/g电流密度下比容量保持在799.4 mA·h·g-1. Wang等[32]采用聚苯乙烯胶体纳米球为模板,通过原位法将锗量子点均匀包覆在三维多孔碳载体骨架内制备3DOP Ge@N-C负极[图4(D)]. 多孔结构可以扩大电解液与负极之间的有效接触面积,缩短锂离子传输距离. 在充放电过程中,与不采用模板法制备的Ge/N-C 相比,3DOP Ge@N-C 的离子扩散系数为其两倍[图4(E)和(F)],在5 A/g 大电流密度下循环1200次后容量保持率为90%.
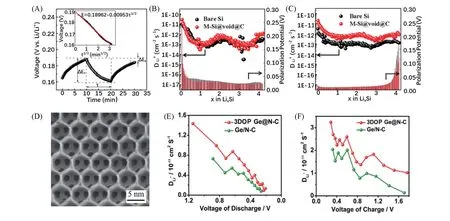
Fig.4 Schematic illustration for a single step of a GITT titration(A), Li+ diffusion coefficients of M-Si@void@C and bare Si anodes calculated from GITT during the lithiation(B) and delithiation(C) processes[22], SEM image of the 3DOP Ge@N-C(D), Li+ diffusion coefficients calculated from the GITT curves of the 3DOP Ge@N-C anode and Ge/N-C anode during discharge(E)and charge(F)processes[32]
2.5 杂原子掺杂
在碳载体中掺杂杂原子取代石墨化碳中一部分碳原子,产生的缺陷可提升离子在载体中的传输特性,也可通过调控界面特性改善载体与活性材料之间的界面相容性,提升负极材料的电化学性能和安全性.
氮是一种常见的掺杂元素,分为吡啶氮,吡咯氮和石墨化氮. Liu等[15]以聚乙烯吡咯烷酮(PVP)为碳源和氮源,通过静电纺丝法制备出一种氮掺杂碳纳米纤维(N-CNFs),氮物种中吡啶氮和吡咯氮的含量分别为27.4%和14.7%,高吡啶氮和吡咯氮掺杂量使碳载体产生缺陷,为离子扩散和插层提供更多通道和活性位点,提升材料的倍率性能. 将N-CNFs 作为碳载体与磷复合制备的P@N-CNFs 负极在5 A/g电流密度下获得637 mA·h·g-1的高比容量. 锂金属负极具有成核不均匀的问题,由此产生锂枝晶造成了严重的安全问题. Liu等[33]通过原位氮掺杂制备出石墨化碳泡沫(NGCFs)三维集流体,与铜箔对比,证实了含氮官能团诱导锂核均匀生长[图5(A)],在高达10 mA/cm2的电流密度下过电位仅为62 mV[图5(B)].
化学气相沉积(CVD)法可使氮原子掺杂到碳层中,增强石墨化碳层上孔缺陷分布的均匀程度.Zhou等[14]以N,N-二甲基甲酰胺(DMF)为氮源和碳源,通过CVD法将氮掺杂的石墨化碳包覆在硅球表面(Si@NG). 根据理论计算,硅球在嵌锂过程中由体积膨胀引起的应力将会在缺陷处积累,而缺陷均匀分布的石墨化碳层会诱导应力分散,从而形成整体稳定的硅基材料. Si@NG在2100 mA/g的电流密度下循环100次后,比容量保持在1321 mA·h·g-1.
可利用多种杂原子掺杂之间的协同效应改善碳载体的性质,达到制备高比容量负极的目的.Li 等[34]以吡咯和硫脲分别为氮源和硫源,经电泳法使其沉积至碳纸(CP)上,然后将CP 热解制备出一种氮、硫共掺杂的碳纸(NS-CP)并浸润熔融锂制备出锂负极(Li-NS-CP),与用相同方法制备只掺杂一种元素的Li-S-CP 和Li-N-CP 相比. 在不同电流密度下,Li-NS-CP 电极的过电势均小于Li-S-CP,Li-N-CP 和Bare Li 的,说明氮、硫共掺杂可提高碳载体的亲锂性. 通过密度泛函理论(DFT)计算,发现锂与氮、硫共掺杂石墨烯的结合能高于锂与氮掺杂石墨烯、锂与硫掺杂石墨烯和未掺杂的石墨烯的结合能,说明氮和硫共掺杂的协同效应提高了碳载体与锂的相互作用,有助于制备稳定的锂金属负极.
掺杂杂原子除了可在碳载体中引入缺陷和提高亲锂性外,还可引入活性官能团增强负极材料与碳载体的相互作用,从而提升电极材料的循环稳定性. Oh等[35]以LiFePO4为模板和磷源,制备一种磷掺杂的石墨烯-多孔碳载体,并将其与熔融锡复合(G-HCF-Sn). X射线光电子能谱(XPS)证实Sn在熔融扩散过程中能与碳表面的含磷官能团相互作用形成P—O—Sn键[图5(C)和(D)],提高了电极材料的循环稳定性,在1 A/g电流密度下,G-HCF-Sn循环1000次后比容量保持在1048 mA·h·g-1.
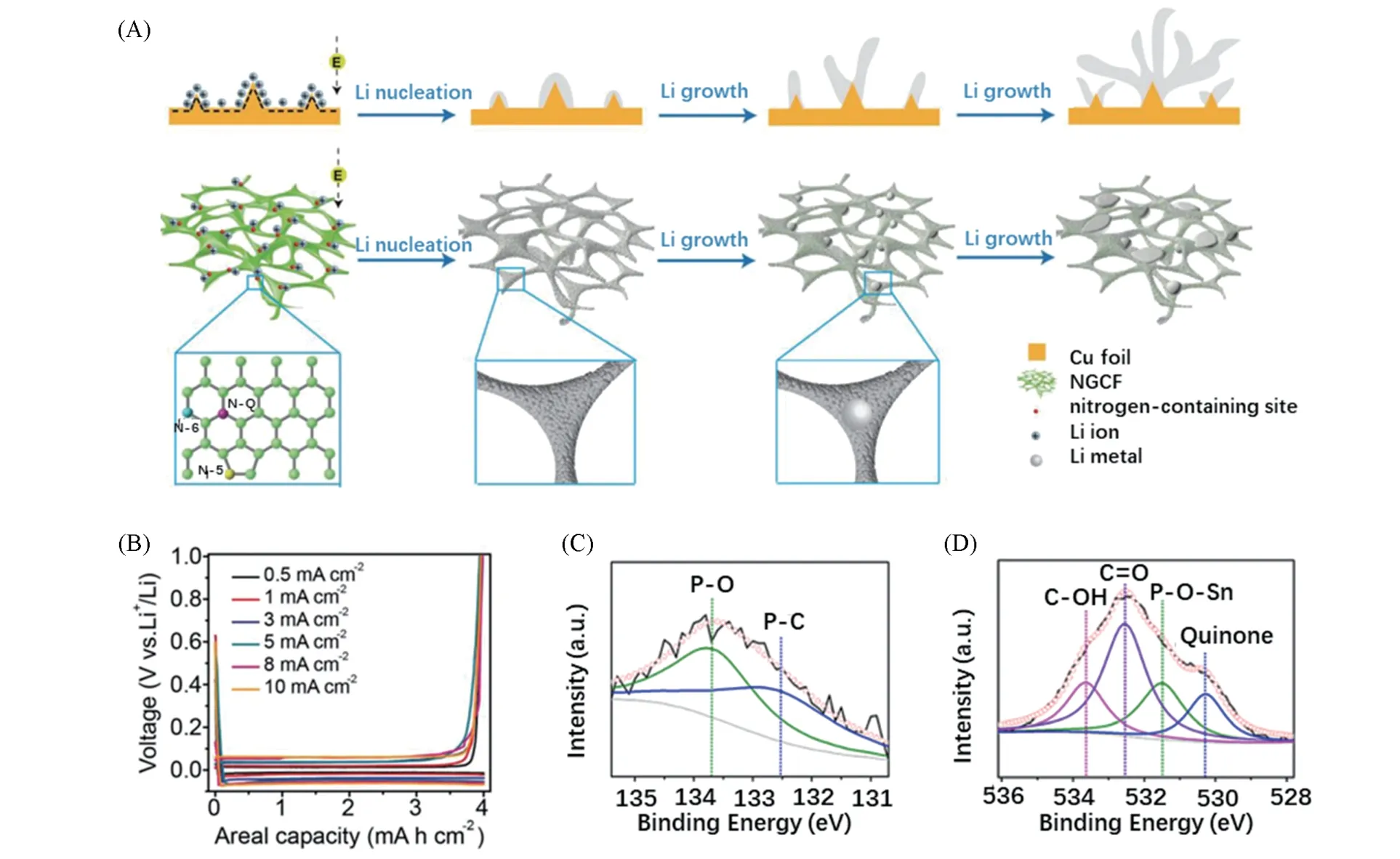
Fig.5 Schematic diagrams showing the Li nucleation and growth process on the Cu foil and NGCF(A),comparison of voltage profiles of the Li plating/stripping on/from the NGCF electrode at a series of different current densities ranging from 0.5 mA/cm2 to 10 mA/cm2 with the same areal capacity of 4 mA·h·cm-2(B)[33],XPS spectra of the G-HCF-Sn composite of P2p(C)and O1s(D)[35]
2.6 界面修饰
在碳载体界面上引入与活性物质亲和力强的官能团,有助于加强二者之间的相互作用,改善异质界面相容性,提升材料整体电化学性能.
对于合金型负极材料来说,通过界面修饰后的碳载体与活性物质形成化学键,可提升碳载体中活性物质含量以提高材料整体的比容量. Zhang 等[1]以水合肼为氮源,制备出氮掺杂的CNTs 作为碳载体,与尿素和黑磷(BP)在超声和磁力搅拌处理下制备磷碳负极(BP@CNTs). 尿素分解出的NH4+对CNTs 进行活化,活化后CNTs 表面的氧/氮官能团与BP 通过化学键相结合[图6(A)],XPS 谱图表明BP@CNTs 中含有P—C,P—N—C 和P—O—C[图6(B,C)],这种强相互作用使BP 的负载量高达约60%,在0.1 A/g电流密度下比容量达到1088 mA·h·g-1.
对于金属负极而言,锂/钠对碳载体的亲和力较弱,会导致不稳定的沉积过程,影响负极的循环稳定性. 含氧官能团对锂/钠的亲和力较强,可诱导锂/钠均质成核和稳定沉积. 因此可对碳载体采用碱活化或酸活化法进行界面修饰,提高其对金属的亲和性. Liu等[24]以聚丙烯腈为碳源和氮源,通过聚丙烯酸和KOH的活化作用掺杂氧. 氧、氮共掺杂的碳载体在2 mA/cm2的电流密度和2 mA·h·cm-2的锂容量下,循环350次后库仑效率大于99%,提高了锂金属负极的循环稳定性. Chu等[13]通过对CNTs进行硫酸和硝酸酸化,在其表面引入含氧官能团O—C=O,C—OH,C=O. 将酸化后的CNTs 作为碳载体用于钠金属负极,通过理论计算发现含氧官能团与钠结合的键能均高于CNTs(C=C)与钠结合的键能,说明引入含氧官能团能有效提升CNTs表面对钠的亲和性,有利于钠的存储.
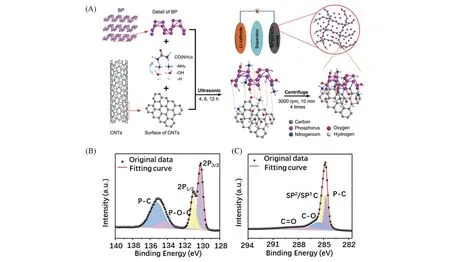
Fig.6 Schematic diagram of synthesis of BP@CNTs and its application in Li ion batteries(A),XPS spectra of BP@CNTs of P2p(B)and C1s(C)[1]
3 总结与展望
碳材料由于其含量丰富,安全环保,易于调控被广泛用作硅、磷、锗、锡、锂和钠等高比容量负极的载体,对于缓解这些活性材料循环过程中的体积膨胀,提高电极材料的电子导电率和离子导电率十分重要. 虽然通过对碳载体的修饰和调控已有效提升了高比容量负极的电化学性能,但是碳载体的发展仍面临着许多问题和挑战.(1)二次电池的发展趋势是高致密储能,但现在对碳载体孔容利用率的研究较少,保证缓解体积膨胀的同时实现孔容的最大化利用是一个值得深入研究的方向.(2)电子、离子在碳载体和活性物质中的传输和扩散路径尚未明确,对于如何设计碳载体以实现负极材料的高倍率性能至关重要.(3)碳载体的界面性质直接影响活性物质的负载量,目前对于增强碳载体界面与活性物质之间相互作用还需进行深入系统的研究.(4)碳载体的比表面积大虽然可以提高活性物质载量,但同时由于增大了活性材料与电解液的接触面积致使二者之间副反应增加,导致材料在首次循环过程中库仑效率较低,对此通过补锂添加剂或对负极材料表面构筑人工SEI的方式来改进. 随着对碳载体研究的不断深入,可进一步提高商业化合金型负极和金属负极的比容量以及循环稳定性,使其在储能领域具有更加广阔的应用前景.
