非洲猪瘟病毒的形态结构特征
2021-05-17谢春芳于瑞嵩董世娟陈冰清
谢春芳,于瑞嵩,董世娟,陈冰清
(1.上海市农业科学院畜牧兽医研究所,上海 201106;2.上海市农业遗传育种重点实验室动物遗传工程实验室,上海 201106)
非洲猪瘟病毒(African Swine Fever Virus,ASFV) 是一种双链大DNA 病毒,目前是非洲猪瘟病毒科(Asfarviridae) 唯一的成员。非洲猪瘟病毒粒子直径为250 nm~300 nm,基因组长度为170 kb~194 kb;细胞内ASFV 粒子直径约200 nm,病毒基因组与核蛋白聚集成病毒核心,核心外包裹有蛋白核壳,核壳外包裹着脂质内膜,脂质内膜外是二十面体蛋白衣壳,最后通过出胞获得病毒外膜,成为一个成熟完整的ASFV 粒子[1-5](图1)。
ASFV 在环境中非常稳定,在4 ℃血液中可保存一年以上,在肉制品中可保存数周。ASFV 可在蜱类和猪中高效复制,并在两者之间循环传播[6]。
ASFV 通过脱壳侵入细胞,病毒脱壳需要酸性环境破坏病毒的外膜和蛋白衣壳。在细胞的内泡小体内,病毒的外膜和二十面体蛋白衣壳被破坏,暴露出病毒内膜,病毒内膜与细胞膜融合,病毒核质得以进入细胞质内,感染宿主细胞。ASFV 感染细胞后,在细胞质内质网附近的“病毒工厂(Viral Factories,VFs)”中进行复制[7]。
在早期核内复制阶段,ASFV 会导致细胞核膜破裂并募集细胞S 期特异性翻译因子——真核翻译起始因子4E/4G(eukaryotic translation Initiation Factor 4E/4G,eIF4E/4G) 和真核翻译起始因子4E-结合蛋白1(eukaryotic translation initiation factor 4E-Binding Protein 1,4E-BP1)到病毒工厂,以增强病毒复制能力,然后在细胞质内进行病毒DNA 复制和包装[8-10]。
1 病毒核心
ASFV 粒子基因组和核蛋白形成病毒核心部分,ASFV pA104R 是组蛋白样蛋白,属于核蛋白,对染色体的扭曲、弯曲、折叠等拓扑修饰发挥重要的结构和调节功能,以增加核稳定性。在ASFV 复制周期,pA104R 与DNA 的相互作用并结合非常重要。二苯乙烯衍生物(Stilbene Derivatives,SD)1 和SD4 能 破 坏pA104R 与DNA 的结合;pA104R 的β 链DNA 结合区(DNA Binding Region,DBR) 的碱基突变也会消除pA104R 与DNA 的结合,pA104R 未与DNA 结合的ASFV 不会进行病毒基因组的复制[11-16]。
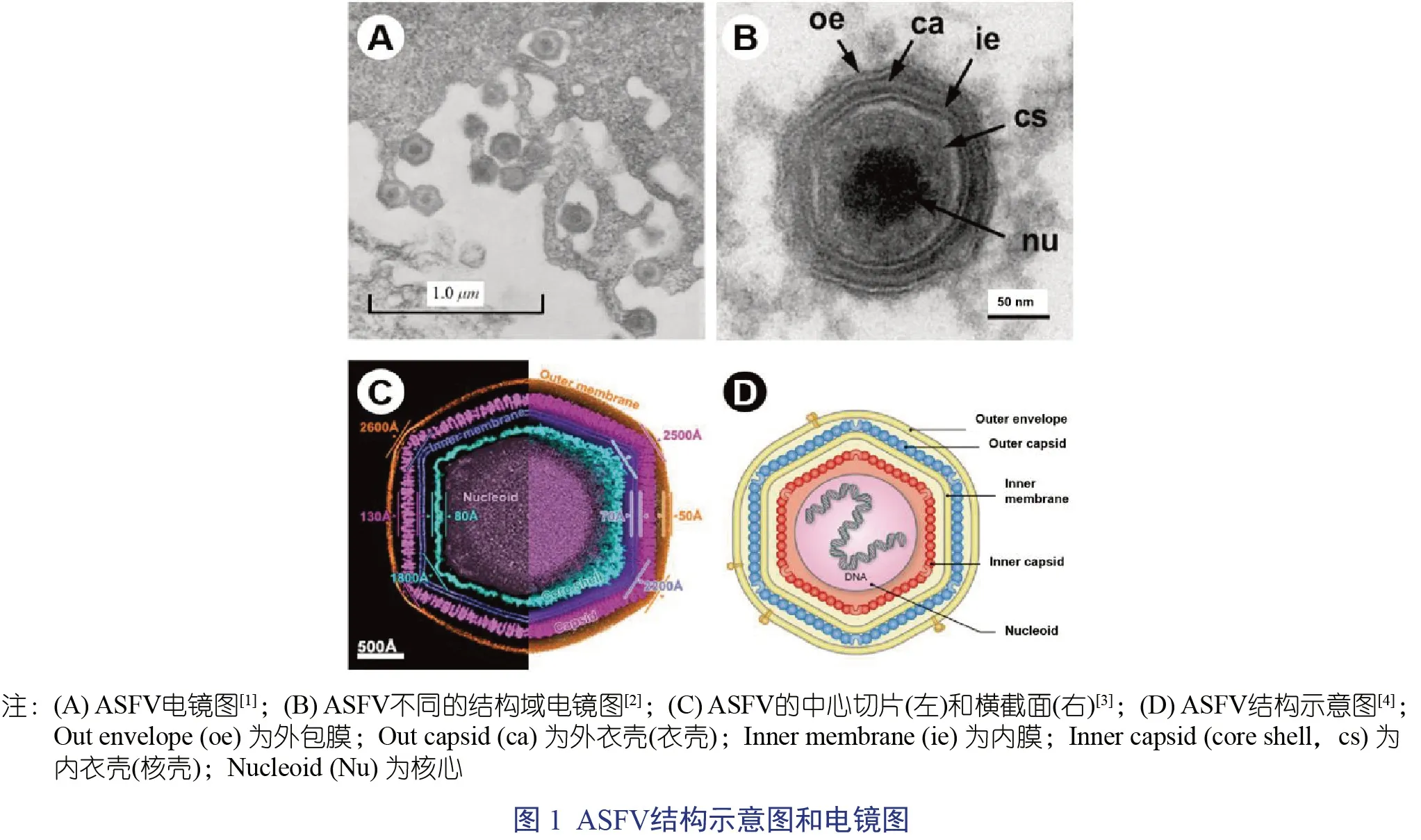
病猪组织细胞中存在无病毒核心的ASFV粒子,说明ASFV 粒子先完成病毒内膜、衣壳的装配,然后形成病毒核心基因组与核蛋白完成装配[17-18]。
2 核壳
核壳位于含DNA 的核仁和内膜之间,是一个类似基质的结构域,包裹着核心。ASFV 核壳是一层30 nm 厚的蛋白层,主要由多聚蛋白pp220 和pp62 的加工产物构成。pp220 和pp62 的加工都依赖于主要衣壳蛋白p72 的表达,pp62 的加工还需要pp220 前体的表达,pp220 和pp62 能够相互作用形成核壳状结构,这几乎占病毒总质量的三分之一。多聚蛋白加工是一个成熟的过程,伴随着核心组装,多聚蛋白pp220 和pp62 被S273R基因编码的半胱氨酸蛋白酶催化,通过共有基序Gly-Gly-X 有序水解成蛋白,pp220 水解产生p150、p37、p34 和p14,pp62 的主要水解产物是p35 和p15。p150、p37、p34、p14、p35 和p15 形 成ASFV 粒子的几个主要成分,构成病毒核壳[19-23]。
3 内膜
ASFV 内膜从细胞内质网膜衍生而来,依赖病毒p54,细胞内质网膜是病毒内膜的前体,内膜凸面上逐渐形成二十面体衣壳,内膜凹面上同时形成核壳[7]。
pE248R 是ASFV 内膜上的跨膜肽,在病毒外膜和蛋白衣壳破坏后,pE248R 与细胞膜融合,病毒核质得以进入细胞质内,感染宿主细胞[2]。
在几种病毒感染中,脂质是形成VFs 的基础,病毒利用膜接触位点(Membrane Contact Sites,MCSs) 确保脂质转移到VFs,MCSs具有提供能量转移其他脂类的功能,如磷脂酰肌醇-4-磷酸(Phosphatidylinostol-4-Phosphate,PI4P)。PI4P 在哺乳动物内质网(Endoplasmic Reticulum,ER)-高尔基体MCSs 中由磷脂酰肌醇-4-磷酸-激酶Ⅳβ 与一些同功酶如磷脂酰肌醇-4-激酶β(Phosphatidylinostol-4-Kinasesβ,PI4Kβ) 或磷脂酰肌醇-4-激 酶 Ⅱβ(Phosphatidylinostol-4-Kinases Ⅱβ,PI4K Ⅱβ) 局部产生。PI4P 负责脂质结合/ 转移蛋白氧化淄醇蛋白(Oxysterol Binding Protein,OSBP) 与 高尔基体对接。MCSs 中的驻留分子允许细胞器之间的非囊泡脂质和离子交换,OSBP 将胆固醇从内质网转运到高尔基体,在高尔基体中聚集,然后再转运PI4P。内质网中PI4P 的水解为这一过程提供能量。一些研究表明,MCSs机制和PI4P 依赖的固醇穿梭蛋白参与了病毒复制。病毒会招募一个宿主PI4P 激酶在其复制细胞器中富集PI4P。在所有的情况下,PI4P脂质都会促使OSBP 进入VFs,导致ER 和VFs之间形成MCSs,在该MCSs 中,胆固醇/PI4P交换驱动胆固醇在复制位点的积聚[24-26]。
ASFV pE199L 是一种富含半胱氨酸的结构多肽,定位于病毒的内膜,具有细胞溶质分子内二硫键。pE248R 是ASFV 内膜上的另一个跨膜肽,pE248R 和pE199LR 与细胞膜融合,病毒核质得以进入细胞质内,形成ASFV 进入细胞的一种融合机制,感染宿主细胞[7,27]。
p17 是由三个连续α 螺旋组成的蛇形结构,p17 与外衣壳蛋白p72 结合,紧密连接ASFV 病毒内膜与外衣壳,稳定病毒的外衣壳结构与形成[28]。
4 衣壳
ASFV 粒子呈二十面体结构,由50 多种衣壳蛋白组装完成,二十面体结构在被感染的巨噬细胞细胞质内接近核附近微管组织中心(microtubule organization center)的VFs区域内组装形成。p72 是主要的结构蛋白,属病毒晚期表达的蛋白,完成一个病毒粒子的衣壳装配需要8 280 多个p72,此外还需p17、M1249L、p49 和H240R,其均为辅助蛋白[3,28]。
p72 以同源三聚体连接,每个单体呈双胶卷形态,使p72 三聚体看起来像一个六聚体,称为“伪六聚体”(pseudo-heameric capsomers),每一个卷含有8个反向平行的β 链结构,并有4 个暴露在外的环D1E1、D2E2、F1G1 和H1I1 暴露域(Exposed Regions,ERs)。这些ERs 与N-端结构域(N-terminal Domain,NTD) 决定了病毒不同型之间的特异性差异,这与许多病毒衣壳蛋白相似。辅助蛋白p17 是一种非常重要且非常丰富的蛋白,是内膜蛋白也是衣壳蛋白,是病毒衣壳组装和二十面体形成必需的蛋白。p17 的胞外域与p72 的残基结构域紧密结合,将p72帽状体牢固地锚定在内膜上。5 个penton 蛋白组成一个五聚体,骨架蛋白M1249L 黏附到五聚体核心,将帽状体连接在一起,不仅形成了一个五边体,而且连接了两个相邻的五边体形成骨架,使五聚体核心与p17 可以在内膜上移动,并与其他衣壳蛋白形成广泛的分子间网络,从而推动衣壳框架的形成。M1249L 长100 nm,作为衣壳对称三边体的边连接2 个对称的五边体,衣壳蛋白p49(B438L)是形成衣壳顶点所必需的。p49 是一种完整的膜蛋白,它不参与病毒粒子从病毒组装点到质膜的运输。p72 三聚体、penton 五聚体在p17、p49与M1249L 的作用下形成衣壳的对称三边体和五边体,20 个对称三边体和12 个对称五边体构成了病毒的外衣壳[3,28-33]。
H240R 有240 个残基,富含β 链,不同于p72,但与p72 同源,具体结构还不清楚;在外衣壳的内膜面,还有许许多多未知的小衣壳蛋白[3,28,33]。
衣壳组装依赖于衣壳蛋白p72 和p49(B438L) 的表达以及病毒伴侣蛋白B602L的表达。静电力在病毒衣壳的组装过程中起着重要的作用,引导着衣壳小体在合适的距离和方向上相互作用,维持稳定的组装。组装外衣壳蛋白的ASFV 粒子直径约200 nm[34]。
5 外包膜
ASFV 粒子在细胞质的VFs 中没有外包膜,只形成四层结构,即病毒核心、核壳、内膜和衣壳。VFs 中形成的ASFV 粒子在出芽时通过细胞质膜获得病毒外膜,从而成为一个成熟的病毒,其直径为250 nm~300 nm。当ASFV粒子移动到酸性环境时,病毒通过质膜发芽获得的外膜就消失了[2,3,35-36]。
6 小结
非洲猪瘟从发现至今已有近100 年的历史,给养猪业及人类社会的公共环境带来了非常严重的危害,对ASFV 的研究越深入,根除ASF 的目标就越近,通过各种电镜和分析技术,我们正在逐渐剥开ASFV 包裹着的一层又一层膜和蛋白,相信无ASFV 的这一天一定会到来。
