尼古丁对口腔细菌单独或混合培养时菌群数目调控的研究
2021-05-17李诗佳陈秋宇邹静黄睿洁
李诗佳 陈秋宇 邹静 黄睿洁
口腔疾病研究国家重点实验室 国家口腔疾病临床医学研究中心
四川大学华西口腔医院儿童口腔科 成都610041
尼古丁是一种存在于烟草中的生物碱,约占烟草干重的0.6%~3.0%。尼古丁可以侵入人体的多种系统,导致心血管疾病、癌症和其他系统性疾病[1]。同时,尼古丁也可促进口腔疾病,如口腔癌、牙周病和龋齿[2]的发生。健康口腔具有高度的多样性和特异性,具有独特的口腔核心微生物群[3]。2005年,Aas等[3]检测口腔正常菌群,结果发现:正常口腔中有700多种细菌或系统类型,其中大多数细菌于人类而言是友好的共生菌,是维持健康重要的组成部分。一些学者[4]曾提出:有益菌和致病菌之间的竞争导致了人类的健康或疾病状态。Ebersole等[5]发现:吸烟者菌群变化较大,如链球菌属、嗜酸性细菌属、口杆菌属和真细菌属明显增多,而纤细菌门和螺旋体菌门的数量明显减少。Shiloah等[6]还发现:吸烟的量会影响口腔致病菌的定植量。在常见口腔细菌的体外实验中,尼古丁对变异链球菌的研究较多。前期研究[7-8]发现:尼古丁可以促进变异链球菌和格氏链球菌生物膜的形成和生物膜的代谢活性。当血链球菌和变异链球菌单独培养时,尼古丁可以同时促进2种菌的生长;而2种菌混合培养时,随尼古丁质量浓度的增加,变异链球菌的相对数量增加而血链球菌的数目下降,提示尼古丁的质量浓度和其他细菌的存在均可影响细菌的生长[9]。除了尼古丁会对细菌数量产生影响,在混合菌种情况下,细菌相互之间也存在竞争关系。Kreth等[10]发现:变异链球菌对格氏链球菌、缓症链球菌、血链球菌的抑制活性显著,对口腔链球菌的抑制活性中等;同样,血链球菌、格氏链球菌、口腔链球菌也可抑制变异链球菌的生长,但抑制原理和抑制强度有所不同,血链球菌和格氏链球菌通过产生过氧化氢抑制变异链球菌的生长[11],而口腔链球菌则通过更快的繁殖速度与变异链球菌竞争[12]。
由于口腔细菌种类繁多,相互作用复杂,在多菌群环境中尼古丁是否会改变菌群平衡,是否依然可以促进变异链球菌的生长不详。本研究拟采用混合模型模拟口腔菌群状态,研究尼古丁对包括变异链球菌在内的细菌的影响。由于口腔细菌种类繁多,本研究主要纳入口腔常见共生菌细菌(格氏链球菌、缓症链球菌、口腔链球菌、血链球菌、唾液链球菌)、口腔龋病及牙髓病细菌(变异链球菌、干酪乳杆菌、粪肠球菌)和口腔内检出率较低的却具备潜在致病能力的细菌(金黄色葡萄球菌、表皮葡萄球菌)。
1 材料和方法
1.1 菌株和培养基
1.1.1 实验菌株 变异链球菌(ATCC 700610/UA159)、格氏链球菌(ATCC 35105)、缓症链球菌(ATCC 49456)、口腔链球菌(ATCC 35037)、唾液链球菌(ATCC 27975)、血链球菌(SK36)、金黄色葡萄球菌(COL)、粪肠球菌(ATCC 29212)、干酪乳杆菌(ATCC 393)、表皮葡萄球菌(PR62A)。
1.1.2 培养条件 细菌解冻前,在25%的甘油中冻存于-80 ℃。细菌复苏于心脑浸液(brain heart in‐fusion,BHI)加0.5%酵母提取物(yeast extract,YE)并含5%羊血的平板上。如无特殊说明,细菌的培养及浮游细菌的检测使用BHI+5%YE培养基。在细菌的生物膜培养中,使用BHI+YE+1%蔗糖培养基。在厌氧培养箱中进行培养,气体环境为5%CO2、85%N2、10%H2,37 ℃。
1.2 方法
1.2.1 确定尼古丁分别对10 种单独培养细菌浮游细 胞 的 影 响 1×107CFU·mL-1[CFU (colonyforming units)为菌落形成单位]细菌在含0、2、4 mg·mL-1尼古丁的BHI+5%YE培养基中,于96孔板中培养24 h,气体环境为5% CO2、85% N2、10%H2,37 ℃。后利用Molecular Devices Spectra‐Max 190酶标仪测细菌每孔的光密度(optical den‐sity,OD)(OD595nm),每个质量浓度平行重复3次。
1.2.2 确定尼古丁分别对10 种混合培养细菌浮游细胞的影响 各自密度为1×106CFU·mL-1的10种细菌混合后(混合后总菌液密度为1×107CFU·mL-1),在含0、2、4 mg·mL-1尼古丁的BHI+5%YE培养基中,于96孔板中培养24 h,气体环境为5% CO2、85%N2、10%H2,37 ℃。每个质量浓度平行重复3次。参考Huang等[13]设计的10种细菌的特异性引物(表1)来扩增特异性序列。24 h培养结束后,离心并收集细菌,磷酸盐缓冲液(phosphate buffer saline,PBS)洗涤3次。每个样品加入DNeasy 96 Blood&Tissue Kit(QIAGEN公司,美国)的Buf‐fer AL,然后超声震荡10 s(52%振幅,声波分解器,模式500),在冰上重复5次。其余DNA提取步骤按照制造商的指示进行。使用NanoDrop 2000(Thermo Fisher Scientific公司,美国)检测DNA的数量和质量。使用特异性引物(0.25 μmol·mL-1)和TaKaRa Taq 聚 合 酶(Chemicon International 公司,美国)扩增每个菌株的总DNA(100 ng)。初始化步骤为94 ℃、5 min,扩增步骤为30个循环,94 ℃、30 s,55 ℃、30 s,72 ℃、30 s,最终延伸步骤为72 ℃、10 min。扩增产物经琼脂糖凝胶电泳确认、证明。细菌定量前,参考Huang等[13]的报道绘制Ct-CFU标准曲线[13],后根据Ct值计算混合菌群中各菌数量。

表1 10种细菌的特异性引物Tab 1 Specific primers for ten bacteria species
1.2.3 确定尼古丁分别对10 种单独培养细菌生物膜的影响 1×107CFU·mL-1细菌在含0、2、4 mg·mL-1尼古丁的BHI+YE+1%蔗糖培养基中,于96孔板中培养24 h,气体环境为5%CO2、85%N2、10%H2,37 ℃,每个质量浓度平行重复3次。培养结束后,弃去上清液,保留孔板底部生物膜。PBS轻轻洗涤生物膜2次,4%甲醇固定生物膜30 min,PBS轻轻洗涤清除甲醇,用1%结晶紫溶液染色20 min,PBS轻轻洗涤3次,以去除尽未黏附的结晶紫,室温晾干后加入无水乙醇静置20 min,然后将含有从生物膜中萃取结晶紫的乙醇溶液转移到新的96孔板中,于酶标仪上检测其光密度(OD490nm)。
1.2.4 确定尼古丁分别对10 种混合培养细菌生物膜的影响 各自密度为1×106CFU·mL-1的10种细菌混合后(混合后总菌液密度为1×107CFU·mL-1),在含0、2、4 mg·mL-1尼古丁的BHI+YE+1%蔗糖培养基中,于96孔板中培养24 h,气体环境为5%CO2、85% N2、10% H2,37 ℃,每个质量浓度平行重复3次。培养结束后,弃去上清液,保留孔板底部生物膜,PBS轻轻洗涤生物膜2次,如1.2.2提取总DNA,行实时荧光定量聚合酶链式反应(quantitative real-time polymerase chain reaction,qRT-PCR)扩增,并计算混合菌群中各菌数量。
1.3 统计学处理
每项实验都独立重复3次以上,统计方法应用SPSS 17.0统计学软件进行单因素的方差分析,使用post-hoc进行组间比较,P<0.05为差异有统计学意义。
2 结果
2.1 单独培养浮游细胞的情况
实验的10种菌其浮游细胞生长情况多表现为尼古丁依赖。其中,在尼古丁存在的情况下,格氏链球菌、缓症链球菌、口腔链球菌、粪肠球菌和干酪乳杆菌浮游细胞的生长明显受到促进,且尼古丁的质量浓度为0~4 mg·mL-1,浮游细胞的数量与尼古丁质量浓度呈正相关。变异链球菌、唾液链球菌和表皮葡萄球菌浮游细胞的数量在尼古丁存在时变化不明显,金黄色葡萄球菌数量显著下降。血链球菌浮游细胞数量在尼古丁质量浓度为2 mg·mL-1时明显增加,在尼古丁质量浓度为4 mg·mL-1时则呈下降趋势(图1)。
2.2 混合培养浮游细胞的情况
混合培养浮游细胞时,在尼古丁存在的情况下,格氏链球菌、缓症链球菌、唾液链球菌、表皮葡萄球菌的浮游细胞数量明显增加,且格氏链球菌、唾液链球菌、表皮葡萄球菌浮游细胞数量与尼古丁质量浓度呈正相关(0~4 mg·mL-1)。干酪乳杆菌浮游细胞数量在尼古丁存在的情况下明显减少,且与尼古丁质量浓度呈负相关。变异链球菌、口腔链球菌、粪肠球菌数量无显著改变。血链球菌、金黄色葡萄球菌浮游细胞的数量在尼古丁质量浓度为2 mg·mL-1时无显著变化,在尼古丁质量浓度为4 mg·mL-1时增加(图2)。
在混合培养的10种浮游细胞中,表皮葡萄球菌数量极低。粪肠球菌和口腔链球菌浮游细胞数量最多,在各种尼古丁质量浓度下约占浮游细胞总量的80%,且随尼古丁质量浓度增加,其占比略微下降。干酪乳杆菌、变异链球菌和血链球菌数量最少,这3种细菌浮游细胞数量之和在各种尼古丁质量浓度下占浮游细胞总量不足5%,且随尼古丁质量浓度增加,其占比略微升高。变异链球在各尼古丁质量浓度组均为1%左右。格氏链球菌、唾液链球菌的占比随尼古丁质量浓度增加而增高。缓症链球菌的占比在尼古丁质量浓度为2 mg·mL-1时增高,在尼古丁质量浓度为4 mg·mL-1时降低(图2、3)。

图 1 10种细菌单独浮游培养24 h后的生长情况Fig 1 Growth of 10 species of bacteria after individual planktonic culture for 24 h
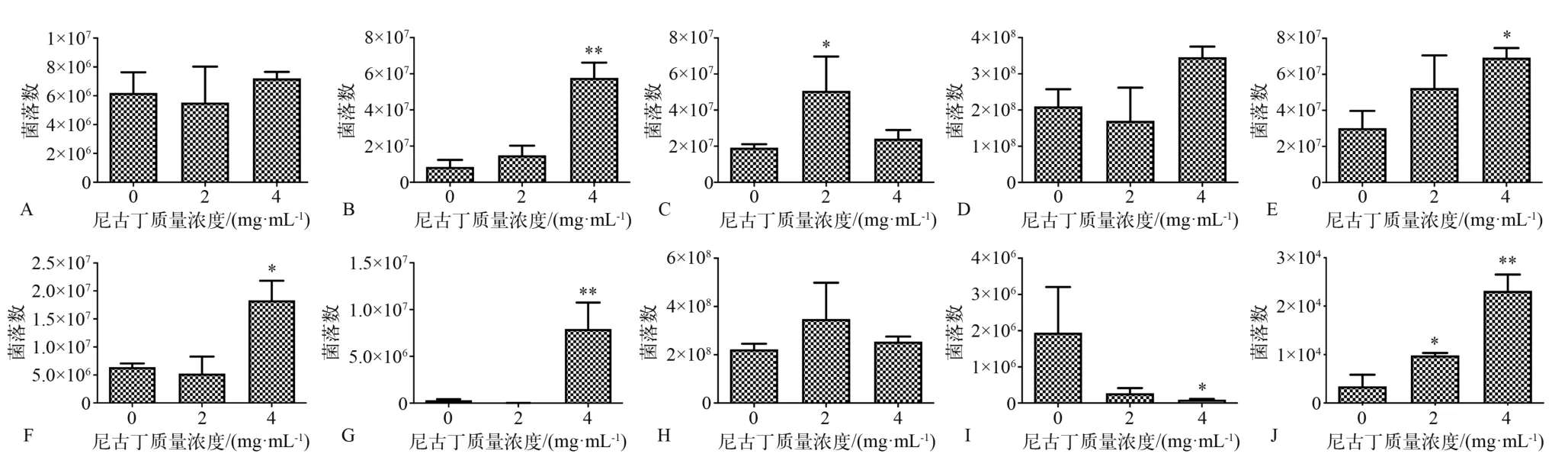
图 2 10种细菌混合浮游培养24 h后的生长情况Fig 2 Growth of 10 species of bacteria after mixed planktonic culture for 24 h
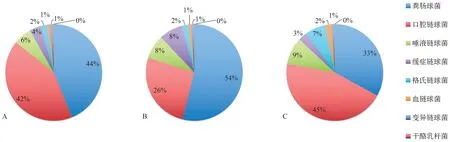
图 3 经不同质量浓度尼古丁处理的10种细菌混合浮游细胞培养24 h后数量的占比情况Fig 3 Proportion of 10 species of bacteria after mixed planktonic culture for 24 h with different concentrations of nicotine
2.3 单独培养生物膜细胞的情况
与细菌单独培养浮游细胞的情况相似,实验的10种细菌其生物膜形成情况多表现为尼古丁依赖。变异链球菌、格氏链球菌、口腔链球菌、唾液链球菌、血链球菌、干酪乳杆菌、表皮葡萄球菌生物膜形成情况在尼古丁存在时明显受到促进,且其促进作用与尼古丁质量浓度呈正相关。缓症链球菌生物膜形成在尼古丁质量浓度为2 mg·mL-1时无显著改变,在尼古丁质量浓度为4 mg·mL-1时有抑制趋势(差异无统计学意义)。金黄色葡萄球菌生物膜形成情况在尼古丁存在时明显受到抑制。粪肠球菌生物膜形成情况与尼古丁无明显相关(图4)。
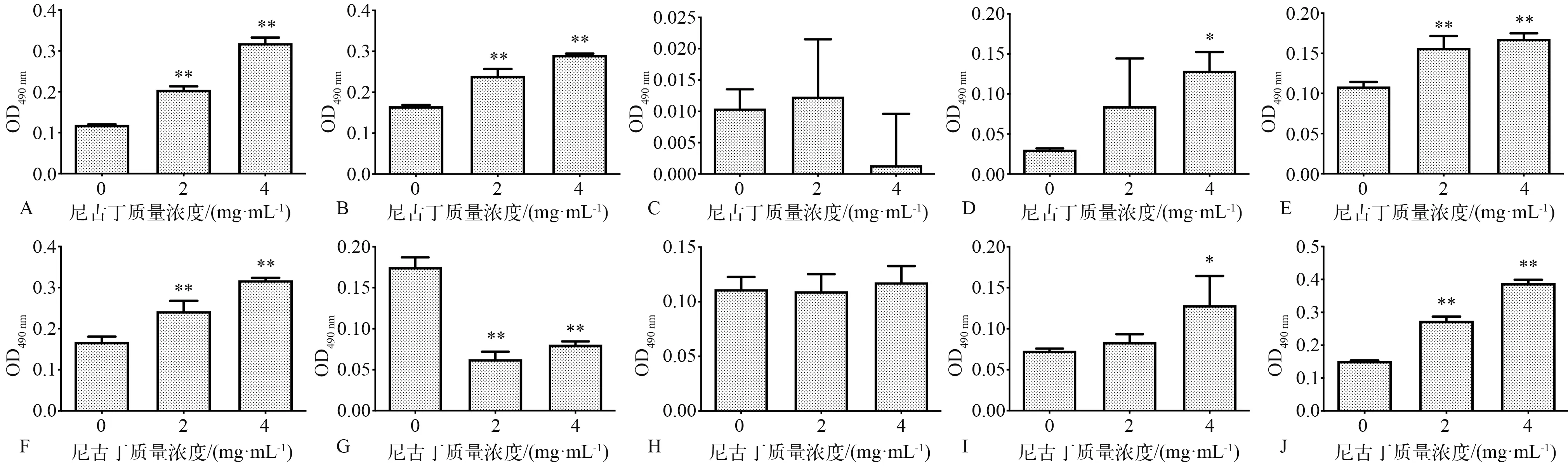
图 4 10种细菌单独培养24 h后生物膜的形成情况Fig 4 Biofilm formation of 10 species of bacteria after individual culture for 24 h
2.4 混合培养生物膜细胞的情况
混合培养生物膜细胞时,变异链球菌、格氏链球菌、口腔链球菌、唾液链球菌、血链球菌、粪肠球菌、表皮葡萄球菌的生物膜细胞数量在尼古丁存在的情况下明显增加,且变异链球菌、格氏链球菌、口腔链球菌、粪肠球菌、表皮葡萄球菌生物膜细胞数量与尼古丁质量浓度呈正相关(0~4 mg·mL-1)。在尼古丁存在时,缓症链球菌、金黄色葡萄球菌生物膜细胞数量呈减少趋势,干酪乳杆菌生物膜细胞数量显著减少,且这3种菌都与尼古丁质量浓度呈负相关(图5)。
在混合培养的10种生物膜细胞中,表皮葡萄球菌数量极低。口腔链球菌和粪肠球菌生物膜细胞数量最多,在各种尼古丁质量浓度下占生物膜细胞总量超过80%。口腔链球菌最多,随尼古丁质量浓度增加,其占比下降;其次为粪肠球菌,随尼古丁质量浓度增加,其占比升高。唾液链球菌在无尼古丁存在的情况下占生物膜细胞总量的9%,其占比在尼古丁质量浓度为2 mg·mL-1时轻微增高,在尼古丁质量浓度为4 mg·mL-1时轻微降低。变异链球菌、血链球菌、干酪乳杆菌、格氏链球菌、缓症链球菌数量最少,这5种细菌生物膜细胞数量之和在各种尼古丁质量浓度下占生物膜细胞总量不超过6%(图5、6)。

图 5 10种细菌混合培养24 h后生物膜的形成情况Fig 5 Biofilm formation of 10 species of bacteria after mixed culture for 24 h

图 6 经不同质量浓度尼古丁处理的10种细菌混合培养24 h后生物膜的占比情况Fig 6 Proportion of biofilm of 10 species of bacteria after mixed culture for 24 h with different concentrations of nicotine
3 讨论
现代口腔生物学认为,龋病在本质上是口腔菌群生态失衡导致的。在外来致病因素的影响下,牙菌斑内致龋菌的比例将会异常升高,而有益菌的比例则会随之下调[14]。吸烟是导致龋病的重要原因之一,作为烟草的主要成分,尼古丁在龋病发生、发展过程中有其独特的病理作用,其机制可能是尼古丁刺激变异链球菌浮游细胞葡糖基转移酶(glucosyltransferase,Gtf)和葡聚糖结合蛋白(glucan-binding protein,Gbp)的表达,导致更多的浮游细胞附着在牙齿生物膜上,从而促进龋病的发展[15]。口腔微环境十分复杂,与龋病相关的病原菌多种多样,细菌之间也存在竞争、共生等密切的相互作用[16],因此,研究尼古丁对混合菌群的作用是非常重要的。本实验选取10种口腔中具有代表性的细菌种类进行研究,对以往实验进行了有力的拓展与补充。
如上所述,细菌在口腔中有浮游细胞和生物膜细胞2种形式,两者蛋白质表达不尽相同,代谢活动也有所差异[17]。在真实的口腔环境中,生物膜是大多数细菌的首选生长形式,因此,研究尼古丁对口腔致龋菌生物膜的影响是十分必要的。结果显示:在尼古丁培养时,变异链球菌、格氏链球菌、口腔链球菌、唾液链球菌、血链球菌、干酪乳杆菌、表皮葡萄球菌生物膜形成情况明显受到促进,其中变异链球菌、干酪乳杆菌等致龋菌的活跃可能在一定程度上解释了吸烟者患龋的风险更高。相比之下,尼古丁诱导浮游细胞生长上调的能力似乎不那么显著。变异链球菌、唾液链球菌和表皮葡萄球菌浮游细胞的数量在尼古丁存在的情况下变化并不明显。可以看出,尼古丁增强生物膜细胞生长的能力更显著和普遍。
在混合菌群的培养中,口腔链球菌和粪肠球菌生物膜细胞数量最多,在各种尼古丁质量浓度下占生物膜细胞总量超过80%,其中口腔链球菌最多,这可能是因为口腔链球菌的传代时间较短,在相同的时间内繁殖的代数多,有利于其与其他菌种的竞争。变异链球菌、格氏链球菌、口腔链球菌、粪肠球菌的生物膜细胞数量在尼古丁存在的情况下明显增加,且与尼古丁质量浓度呈正相关,这说明在混合菌群中,尼古丁依然能使变异链球菌等致龋菌的数量上调,这比单独培养更能体现尼古丁在复杂口腔环境中的作用。这些菌在混合菌群中的相互作用值得关注,Kreth等[10]的研究显示:在营养丰富的生长条件下,如蔗糖环境,血链球菌和变异链球菌之间没有抑制作用。混合培养中格氏链球菌的绝对细胞数量也因尼古丁的作用而增加,这些增加的格氏链球菌细胞既能产生更多的过氧化氢抑制变异链球菌的生长,也能为变异链球菌的附着提供更多的结合位点[10]。值得一提的是,作为龋病的重要病原菌,干酪乳杆菌在浮游和生物膜混合培养中,数量均显著减少,这意味着尼古丁的存在对干酪乳杆菌的生长不利,但具体的机制还待进一步探索。
总结和比较本实验和国内外关于细菌种类细胞数量变化的研究。总的来说,尼古丁对大部分的菌都有促进作用,但促进程度不同,当混合培养时,尼古丁在促进细菌的同时也会调节菌群各种之间的比例,因而尼古丁对各菌的作用在混合培养及单独培养中是不同的。其中,尼古丁对变异链球菌、格氏链球菌、口腔链球菌3种菌的促进作用最明显,在单独培养和混合培养情况下,其浮游细胞和生物膜细胞数量均增加,而对其他细菌的促进作用受细菌状态影响较大。因此,尼古丁导致口腔菌群朝利于致龋菌群生长的方向发展,进而增加了吸烟者的龋风险。当然,由于本研究中纳入的细菌同种类数量与人类口腔微生物组相差甚远,目前的研究只是一个多物种研究的试点研究,进一步的研究会包括更多的细菌种类和优化生长条件。
利益冲突声明:作者声明本文无利益冲突。
