肝硬化合并糖尿病患者胰岛素抵抗与肝功能关系研究
2021-05-17莫石柯
莫石柯
肝硬化合并糖尿病患者主要临床特征为糖负荷后血糖异常升高伴有高胰岛素血症,其主要临床表现为胰岛素抵抗,可损伤肝脏,增加肝硬化各种并发症的发生风险,不利于患者的预后。老年肝硬化患者免疫功能明显降低,使得糖代谢异常风险增加,且因疾病时间长,肝细胞功能受损严重,血糖稳定性差,对临床治疗造成了极大的困难。本研究通过收集本院治疗的老年肝硬化及肝硬化合并糖尿病患者进行分析,明确患者胰岛素抵抗、肝功能与患者预后的关系,以期为临床治疗提供参考依据。
1 资料与方法
1.1 一般资料 随机选取2018年1 月~2020年12 月本院收治的肝硬化患者100 例,依据是否合并糖尿病分为对照组(未合并糖尿病患者,40 例)和观察组(合并糖尿病患者,60 例);同时观察组患者依据病情不同分为肝源性糖尿病组(35 例)和肝硬化并2 型糖尿病组(25 例)。对照组患者中男21 例,女19 例;年龄59~84 岁,平均年龄(71.6±11.1)岁;肝硬化原发性疾病:慢性乙肝16 例,慢性丙肝5 例,酒精性脂肪肝11 例、乙肝合并酒精性脂肪肝5 例、隐源性肝硬化3 例。观察组中男32 例,女28 例;年龄59~84 岁,平均年龄(73.6±10.7)岁;肝硬化原发性疾病:慢性乙肝19 例,慢性丙肝7 例,酒精性脂肪肝10 例、乙肝合并酒精性脂肪肝12 例、隐源性肝硬化6 例,原发性胆汁肝硬化6 例。对照组和观察组患者性别、年龄等一般资料对比差异无统计学意义(P>0.05),具有可比性。
1.2 诊断标准 肝硬化诊断以西安第10 次全国病毒性肝炎学术会议修订诊断标准为依据[1];糖尿病诊断采用《中国2 型糖尿病防治指南》(2013年版)为依 据[2],即FPG≥7.0 mmol/L 和(或) 餐 后2 h 血 糖(2 h PG)≥11.1 mmol/L。
1.3 纳入及排除标准 纳入标准:确诊为肝硬化和存在明确的肝功能损伤表现;肝硬化合并糖尿病前存在≥5年的肝硬化病史。排除标准:垂体、胰腺、肾等器官或组织病变所引起的继发性疾病;使用药物导致的糖代谢异常;糖尿病为原发性疾病者。
1.4 研究方法 所有研究对象空腹抽取外周静脉血,离心取上清,测定FPG、FINS,随后计算HOMA-IR;计算肝功能Child-Pugh 评分,将肝功能分为A、B、C 级。
1.5 观察指标 对比对照组和观察组患者FPG、FINS、HOMA-IR 及肝功能Child-Pugh 评分分级,并对比肝源性糖尿病组和肝硬化并2 型糖尿病组患者FPG、FINS、HOMA-IR 及肝功能Child-Pugh 评分分级。
1.6 统计学方法 采用SPSS20.0 统计学软件对数据进行处理。计量资料以均数±标准差()表示,采用t 检验;计数资料以率(%)表示,采用χ2检验。P<0.05 表示差异有统计学意义。
2 结果
2.1 对照组和观察组患者FPG、FINS、HOMA-IR 对比 对照组患者的FPG、FINS 与HOMA-IR 均低于观察组,差异具有统计学意义(P<0.05)。见表1。
2.2 肝源性糖尿病组和肝硬化并2 型糖尿病组患者FPG、FINS、HOMA-IR 对比 肝源性糖尿病组和肝硬化并2 型糖尿病组患者的FPG、FINS 与HOMA-IR 对比差异均无统计学意义(P>0.05)。见表2。
2.3 对照组和观察组患者肝功能Child-Pugh 评分分级对比 观察组患者肝功能Child-Pugh 评分B 级和C 级占比均高于对照组,差异具有统计学意义(P<0.05);两组患者肝功能Child-Pugh 评分A 级对比差异无统计学意义(P>0.05)。见表3。
2.4 肝源性糖尿病组和肝硬化并2 型糖尿病组患者肝功能Child-Pugh 评分分级对比 肝源性糖尿病组和肝硬化并2 型糖尿病组患者肝功能Child-Pugh 评分分级对比差异无统计学意义(P>0.05)。见表4。
表1 对照组和观察组患者FPG、FINS、HOMA-IR 对比()
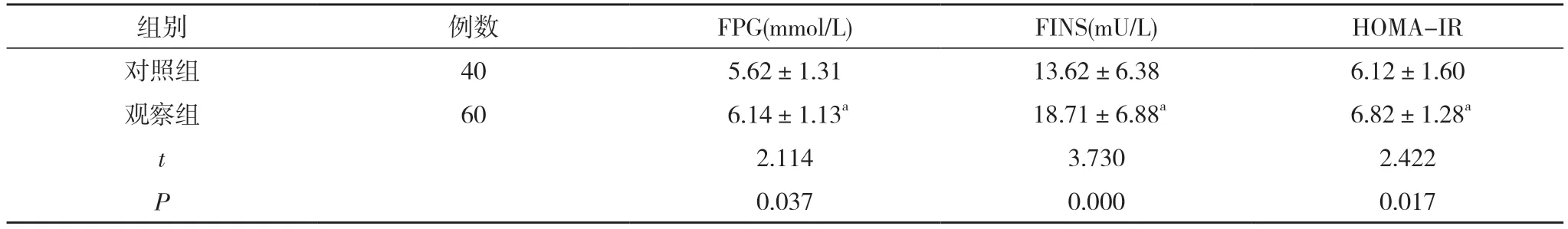
表1 对照组和观察组患者FPG、FINS、HOMA-IR 对比()
注:与对照组对比,aP<0.05
表2 肝源性糖尿病组和肝硬化并2 型糖尿病组患者FPG、FINS、HOMA-IR 对比()
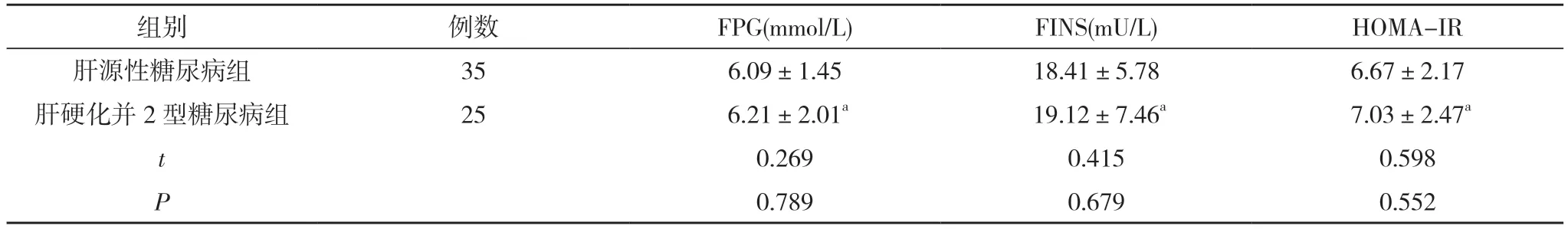
表2 肝源性糖尿病组和肝硬化并2 型糖尿病组患者FPG、FINS、HOMA-IR 对比()
注:与肝源性糖尿病组对比,aP>0.05

表3 对照组和观察组患者肝功能Child-Pugh 评分分级对比[n(%)]
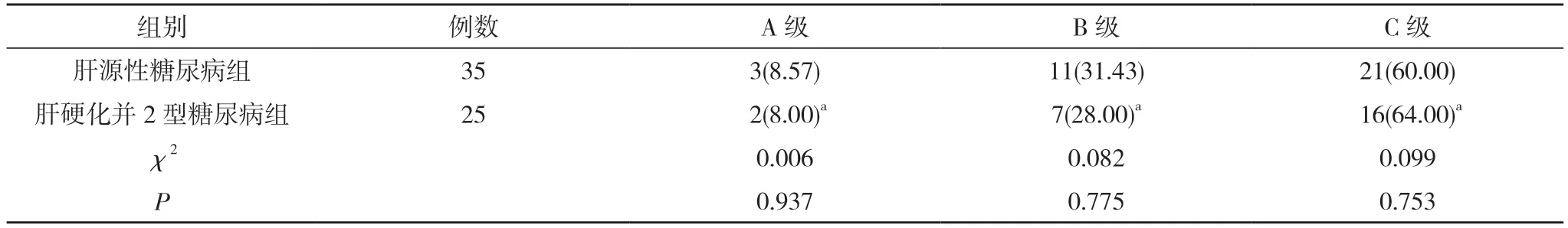
表4 肝源性糖尿病组和肝硬化并2 型糖尿病组患者肝功能Child-Pugh 评分分级对比[n(%)]
3 讨论
有研究表明,慢性肝病患者中约50%~80%伴有糖耐量异常,而合并糖尿病者高达20%~30%,但健康人群糖尿病发病率仅为10%[3]。肝硬化并发糖尿病目前临床治疗难度较高,需要同时注意血糖控制和肝功能保护,但临床效果往往较差,已成为肝硬化患者预后的危险因素之一。因此,分析研究肝硬化并发糖尿病的相关危险因素并给予临床对症治疗,目前已成为临床医务工作者关注的热点。肝硬化并发糖尿病的发病机制较为复杂,可能与胰岛素抵抗、胰岛素分泌代谢异常、胰高血糖激素分泌增多、各种病毒性肝炎以及其免疫复合物的毒性作用等多种因素密切相关,肌肉、肝脏、脂肪组织的胰岛素抵抗以及高胰岛素血症是肝硬化并发糖尿病的病理生理基础[4],与肝实质细胞损伤、门体分流等密切相关。肝硬化时肝实质细胞损伤可引起肝功能异常,门体分流可导致门脉系统流经肝脏的血流减少,胰高血糖素、生长激素等胰岛素拮抗物含量因灭活作用减弱而不断升高,并且由于外周组织细胞上胰岛素受体数量减少,引起外周组织胰岛素抵抗。除此之外,肝炎病毒及其免疫复合物或毒物均可直接对胰岛β 细胞造成损伤,从而使其胰岛素分泌功能降低。
肝脏是脂肪、糖类和蛋白质的主要代谢转化器官,肝硬化可引起细胞受损,从而使静息能量消耗降低,并表现为糖类物质氧化异常,而糖尿病则可增加静息能量消耗的代谢性疾病,因此,肝硬化并发糖尿病使得机体能量代谢显得更加紊乱。葡萄糖氧化主要发生在肝脏,肝细胞功能损伤导致的肝功能障碍,可引起糖类物质代谢紊乱,约80%的肝硬化患者可出现糖耐量异常,其中约20%~30%的患者最终可进展为肝源性糖尿病[5]。肝硬化合并糖尿病患者的高胰岛素血症与胰岛素抵抗则表现更加明显,会进一步降低对胰岛素的敏感性。肝硬化合并糖尿病患者与单纯2 型糖尿病患者相比基础C 肽值明显升高,在治疗上除了口服短效黄胶类药物之外,胰岛素也是治疗的主要药物,并且其使用量也较大,则提示肝硬化合并糖尿病患者存在更为严重的胰岛素抵抗现象[6]。而老年人群由于糖代谢异常,从而导致糖耐量受损比例较高,并且病情也较为严重,一旦进展为肝硬化并发糖尿病,不但可促进肝硬化的病情进展,严重者甚至可导致肝细胞的癌变[7]。老年肝硬化合并糖尿病患者的临床病情较为复杂,易出现多种并发症,并且在临床治疗过程中相互矛盾。本研究结果表明:对照组患者的FPG、FINS 与HOMA-IR 均低于观察组,差异具有统计学意义(P<0.05)。肝源性糖尿病组和肝硬化并2 型糖尿病组患者的FPG、FINS 与HOMA-IR 对比差异均无统计学意义(P>0.05)。观察组与对照组患者肝功能Child-Pugh 评分B 级和C 级对比差异具有统计学意义(52.50% VS 30.00%,40.00% VS 61.67%,P<0.05);两组患者肝功能Child-Pugh 评分A 级对比差异无统计学意义(P>0.05)。肝源性糖尿病组和肝硬化并2 型糖尿病组患者肝功能Child-Pugh 评分分级对比差异无统计学意义(P>0.05)。
综上所述,肝硬化患者体内存在高胰岛素血症与胰岛素抵抗,合并糖尿病时更加明显;且合并2 型糖尿病的肝硬化患者较肝源性糖尿病患者肝功能状态更差。
