同位素稀释技术在土壤微量元素地球化学活性分析中的应用①
2021-05-16毛凌晨刘力菠严南峡
毛凌晨,刘力菠,孔 惠,严南峡,叶 华
(1 上海理工大学环境与建筑学院,上海 200093;2 上海纺织建筑设计研究院有限公司,上海 200082)
土壤中的微量元素指那些含量通常低于100 mg/kg的元素,其来源分为自然来源 (如成土母质) 和人为来源 (如肥料施用)[1],它们主要吸附于颗粒表面,或与铁锰氧化物等结合,封存于其晶格结构中以矿物形式存在。在1970—1998年间,对土壤微量元素的研究工作主要集中在对生物所必需的微量营养元素,如Cu、Zn、Fe、Cr等(FAO/WHO,1995)的生物可利用性和迁移性的分析[2-3]。由于生物体对这些元素所需量极少,但当摄取含量过高,则会对生命活动过程产生负面作用[4]。例如,营养学家建议成人Se的摄入量应为50 μg/d,但当剂量超过400 μg/d便会对人体产生危害[5]。此外,Hg、Cd、Pb、As等元素毒性极高,在低剂量时,也对动植物和人体有害。近年来,由于环境中有毒微量元素(如重金属)污染严重,加上土壤对于大部分微量元素具有累积作用,越来越多的研究开始通过衡量微量元素在土壤中的地球化学活性来判断其生物可利用性与生物累积性[6-7]。
土壤中微量元素的地球化学活性分析方法通常有化学提取法(包括单级和多级提取)、透膜法和同位素稀释技术等。其中同位素稀释技术自21世纪以来应用越来越广泛。根据可查到的文献资料,该技术最早由1970年Wasik和Tsang[8]将同位素稀释与气相色谱结合用于测定水中痕量污染物,随后3年同位素稀释技术开始应用于土壤/岩土中微量金属元素的测定[9]。图1为应用同位素稀释技术分析土壤微量元素的文献数量逐年统计图(搜索引擎Wed of Science,搜索关键词trace element,soil,isotope dilution)。
同位素稀释技术是在土壤样品固液平衡体系中加入待测元素的某一富集同位素,其浓度已知。加入的外源同位素与样品中原有的元素均匀混合,使同位素离子在固液两相进行再分配。通过测定添加前后样品的同位素比值,即可确定待测元素中活性组分的浓度[10]。因为该技术对固/液交换过程造成的扰动极小,被众多研究人员认为是分析土壤微量元素地球化学活性最有效、最合理的方法[10-11]。同位素稀释技术通过引入E值(E-value, mg/kg)来量化再分配过程样品中微量元素的同位素可交换量,即样品微量元素总量中的活性含量[10]。本质上,同位素稀释技术可以在微量元素与土壤固相交换动力学的基础上,区分可交换态和不可交换态的微量元素。同位素稀释技术所得结果不但能预测微量元素的生物可利用性,还可以为了解影响生物可利用性的各种土壤过程提供更丰富的信息。
1 同位素稀释法的基本原理
微量元素的地球化学活性(geochemical lability,简称“活性”)是土壤固/液相中元素离子交换、迁移或被生物利用的决定性因素,通常取决于元素的化学性质、来源和土壤本身的理化性质[12]。按照微量元素的地球化学活性,可将土壤中的元素含量分为两类,如图2所示:①非活性组分(non-labile):指被原生矿物裹挟、与次生矿物共沉淀或者被有机质严密包裹的微量元素,该组分不会被植物吸收,与外界环境几乎不发生交换;以及以极缓慢的速度(以年或月计)与溶解态同类元素发生动态交换的组分,这部分通常以很强化学结合态存在于土壤固相或胶体颗粒上;②活性组分(labile):指以溶解态、部分络合态或吸附态存在的微量金属元素,这部分元素可以在短时间内(数秒至几天)通过吸附/解吸、沉淀/溶解等化学反应与溶液中金属阳离子交换,因此极有可能被生物吸收[12-13]。
利用同位素稀释技术分析微量元素的地球化学活性的基本原理与对应的操作流程如图3所示。在样品固液平衡体系中加入已知量的待测元素的某一富集同位素试剂,由于同种元素的同位素离子间具有相同的化学性质,进入土壤溶液中的同位素离子随即和重金属的活性部分发生交换,在经过一定时间的离子交换反应后,可在土壤固-液相间达到反应平衡,从而改变样品中待测元素在两相的同位素丰度[10]。通过测定混合前后样品上清液(液相)的同位素丰度变化,可确定样品中元素的有效浓度值即同位素可交换量(E值)。
2 同位素稀释法的方法建立
建立有效的同位素稀释法,需在整个过程中达到以下几个要求:①在加入外源同位素前,以及在固液分离前,整个体系应达到化学平衡;②体系中对平衡有影响的物质均对外源同位素有相同的反应活性;③外源同位素与溶液中的稳定同位素性质一致。因此,在操作前,应对实验目的、目标元素、样品理化性质、检测手段与分析仪器等有全面的认识,从而建立最恰当的实验方法。
2.1 外源同位素的选择
早期受限于分析仪器检测性能,研究者通常只能选择放射性的外源同位素进行实验[10,14-15]。由于部分放射性同位素半衰期很短,且存在安全隐患,大大限制了同位素稀释法的使用,如64Cu同位素的半衰期仅为12.4 h[16];而63Ni虽然半衰期为100.1 a,但实验完成后,涉及实验废料难处理的问题[10]。
随着高精密分析技术的发展,电感耦合等离子体质谱仪(Inductively Coupled Plasma Mass Spectrometer,ICP-MS) 被越来越多地投入到科学研究中。该仪器具有灵敏度高、分析速度快、支持多元素同时测定等优点,能够较准确地测定元素稳定同位素的比值(isotope ratio, IR)[17]。从而使稳定同位素稀释技术(stable isotope dilution)得以成为目前复杂体系中微/痕量成分检测常用的方法之一,被广泛应用于土壤微/痕量元素的地球化学性质的研究中[18-19]。
外源稳定同位素选择通常遵循以下原则:①尽可能选择天然丰度低的同位素作为外源富集同位素,丰度高的作为参比同位素。对于富集同位素来说,较少的外加量即可明显引起含量变化,因此能减少试剂损耗;而参比元素含量较高,在仪器检测时,有利于信号保持稳定。②避免同量异位素重叠。如 Pd、In 和Sn 会对 Cd 的测量造成干扰。表1为能通过四级杆ICP-MS测定同位素比值的稳定同位素[19]。许多推荐外源同位素和参考同位素受到潜在干扰多原子(分子)物种(40Ar16OH:amu=57)的影响,越来越多的问题通过使用新型的ICP-MS仪器和碰撞/反应堆单元技术(最典型的是氦气碰撞模式)来解决。
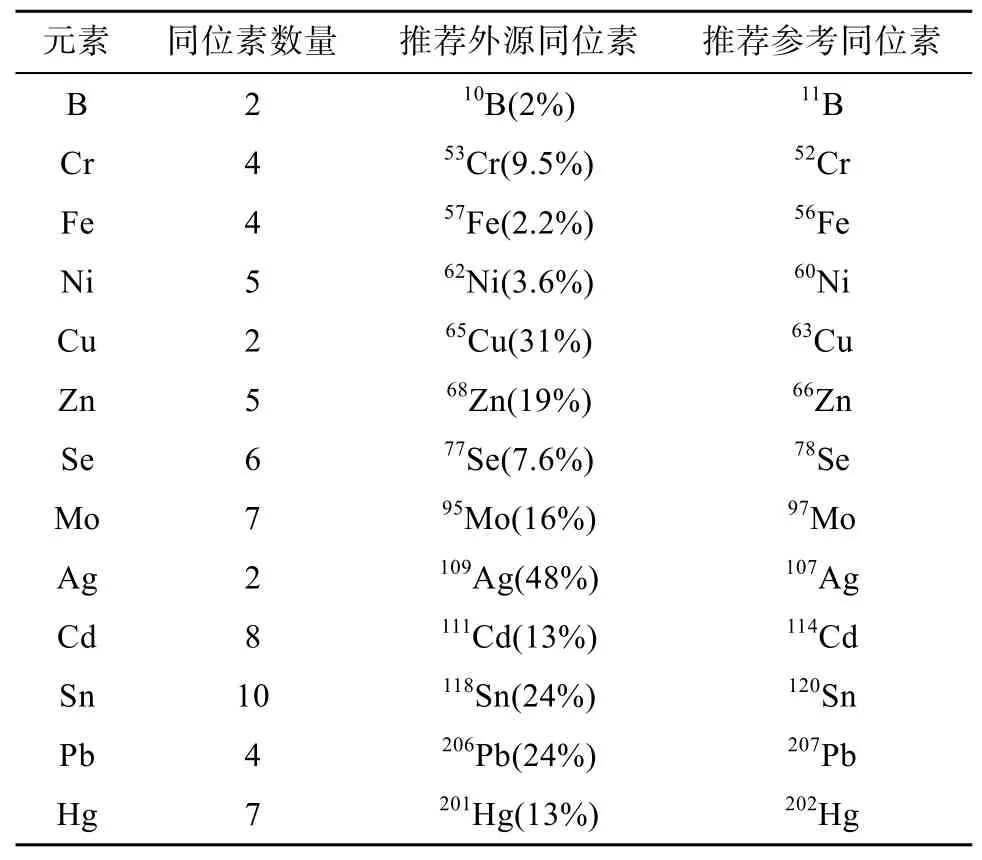
表1 四级杆ICP-MS可测定同位素比值的稳定同位素Table 1 Stable isotopes for determining isotope ratios by quadrupole ICP-MS
2.2 外源同位素的添加量
使用稳定同位素稀释技术时,外源富集同位素试剂的添加量必须满足:①足以引起液相中目标元素的同位素比值产生明显改变,从而使ICP-MS能准确检测[20];②添加量也不宜过大,以免破坏体系中微量元素离子在固液两相中的平衡。同位素的天然丰度是决定使用何种同位素和添加外源同位素添加量的一个参考因素。与其他同位素的天然丰度相比,若某元素的天然丰度较低,外源同位素添加量也必须控制在相对较低的范围内[18-24]。Nolan等[22]采用了63Cu/65Cu测量值的标准偏差以及IRsp(isotopic ratio of spike,富集同位素试剂中的同位素比值)与IRmeas(isotopic ratio of nature, 天然同位素比值)之间的差值进行重复测量,以评估外源同位素中65Cu 添加量的范围误差。实验结果表明,当外源同位素添加量等于E值的5% 时,所得E值的误差值最小(<5%)。Degryse等[24]和Atkinson 等[25]在测定土壤中 Pb 活性的实验中发现,当加入204Pb(IAnature=1.4%)和208Pb(IAnature=52.4%)(isotopic abundance of nature,天然同位素丰度)分别是其含量的 2.7 倍和 4 倍时,会高估土壤中Pb的化学活性。Ahnstrom和Parker[23]、Nolan等[22]以111Cd和65Cu为例,提出添加量应参考土壤样品中该元素总量,约1% 左右为宜。然而,Gray等人[20]仅加入了总量的0.1% 便得到了可靠的结果。
在通常情况下,检测前E值是未知的,因此可以从元素总量或单级化学提取法中目标元素的含量来估算外源稳定同位素的添加量。Young 等人[10]用1 mol/L CaCl2提取液中Cd的浓度来计算添加量;又如Gabler 等人[26]在实验中添加了相当于EDTA (乙二胺四乙酸)可提取的金属(Cd、Cu、Ni、Pb和Zn)总量1/3的外源同位素。
2.3 固液两相平衡介质的选择
平衡介质的选择会影响重金属离子在溶液中的溶解度,常用的去离子水[10]、EDTA[25]、CaCl2[18]和Ca(NO3)2[27]作为同位素平衡介质。
H2O是最常用的溶剂。水作为平衡介质能溶解水溶离子态重金属、可溶态有机质及少量其他组分结合的离子[28],其优势在于不会引入多余的离子导致目标元素(特别是重金属元素)沉淀,继而低估了E值。然而,使用水会增加胶体的分散性,可能导致E值被高估[16]。
由于水的提取能力较弱,通常只能提取最活泼的游离态金属离子。当液相目标元素含量过低时,为避免仪器检测时信号过弱,可以采用一些稀释盐溶液,如0.1 mol/L或0.01 mol/L CaCl2[19]和0.01 mol/L Ca(NO3)2[27],这些稀释的二价阳离子盐溶液可降低溶液中胶体含量,促进样品的过滤并减少胶体干扰的可能性。同时,可以大大提高目标同位素在液相的浓度(溶解度)。在对污染土壤As的研究中,Tye等[15]使用5×10–3mol/L (NH4)H2PO4及De Brouwere等[29]使用5×10–3mol/L Ca(NO3)2作为平衡介质。Young等[10]推荐采用0.01 mol/L 的CaCl2,一方面可以用于模拟土壤溶液中的Ca浓度;另一方面通过与Cl–1的络合作用,待测元素Cd在液相的浓度有显著提高。但同时该研究也指出,Cl–1会与H2O、Ar、N等结合,形成多原子离子干扰,影响ICP-MS对As的测定。此外,由于Ag可能会与CaCl2反应生成AgCl或不溶钙盐的沉淀,因此,在分析As、Ag等元素时,0.01 mol/L Ca(NO3)2是更佳的选择[27]。
EDTA等螯合剂作为平衡介质的优势在于与金属阳离子的结合能力更强,适用于目标元素溶解度较低的土壤样品。Atkinson等人[25]在实验中使用5×10–4mol/L EDTA与0.01 mol/L Ca(NO3)2作为平衡介质分别研究了4种污染土壤中的金属Pb活性,5×10–4mol/L EDTA能提取几乎所有的不稳定态Pb,但不可避免地释放一些非活性的Pb;0.01 mol/L Ca(NO3)2在低污染土壤中能提取与EDTA相似浓度的不稳定态Pb,但在重度污染的土壤(如污灌土)中,0.01 mol/L Ca(NO3)2提取的溶解性Pb含量不准确,甚至与5× 10–4mol/L EDTA提取的浓度范围相差两个数量级,可能是悬浮的亚微米胶体造成的误差。若将EDTA浓度降低至1×10–5mol/L,则可基本避免对不稳定态元素的影响,且保证上清液中的离子浓度达到ICP-MS的检测下限[30]。
土壤溶液胶体中的金属虽不容易被生物利用,但迁移性极强[16]。树脂纯化技术不但可以解决去离子水或稀释盐溶液提取Cd和Zn等元素时产生的胶体干扰[25],还可以被用于量化胶体中不具有同位素可交换性的元素含量[16,27]。树脂纯化是在固液分离以后,在上清液中加入螯合树脂,平衡2 h后,用纯水冲洗以去除胶体颗粒。然后用稀HNO3从树脂中洗脱金属阳离子,测量的同位素比值用于计算不稳定态金属的含量[16]。树脂纯化的另一个优点是它能将金属和同位素富集,当滤液中的金属浓度和同位素活动接近检测极限时,可以更可靠地测定E值。
综上所述,在添加外源同位素之前,应确保平衡介质不会引起待测元素的沉淀,液相中待测元素的浓度需能被仪器准确检测,排除平衡介质中阴离子对仪器的干扰。若土壤溶液中出现大量土壤胶体,应考虑采用树脂纯化来避免E值被高估。
2.4 平衡时间
在同位素稀释法实际应用过程中,需要考虑样品的振荡时间。首先,在富集同位素加入之前,需要保证微量元素在固液两相间的分配已经达到动态平衡。Young 等[10]发现同位素平衡48 h后Cd 的E值几乎不再发生变化,建议将2 d作为平衡时间的最低值。Hamon等[21]认为,振荡 24 ~ 72 h 后,外源Cd111能够在土壤–溶液体系中达到平衡。实验证明,2 ~ 3 d的振荡平衡时长也适用于其他微量元素[3,30]。
3 E值的意义及应用
3.1 E值的定义及计算
同位素稀释法通过引入E值来量化再分配过程样品中微量元素有效浓度值,即样品元素总量中的活性部分[10]。
计算稳定同位素测量E值需要确定3个数值:①同位素的天然比值(IRnature);②外源同位素富集液相中同位素的比值(IRsp);③在添加外源富集同位素后液相的同位素比值(IRmeas)。利用以下公式来计算E值[11,32]:
式中:Am:天然丰度(Mnat)和富集同位素试剂(Msp)中元素的平均相对原子量;W:土壤样品干重(kg);Csp,Vsp:富集同位素试剂元素浓度(mg/L)和体积(L);spIRsp,bgIRsp:富集同位素(如204Pb)和参比同位素(如208Pb)在富集同位素试剂中的丰度;spIRnat,bgIRnat:富集同位素和参比同位素在土壤样品中的丰度;Rss:富集同位素、参比同位素测定值,如204Pb/208Pb。此处要注意的是,虽然长久以来,大部分元素的天然同位素比值都被认为是恒定的(除Pb、B等),但近年来越来越多的研究证实,微量元素在地球化学过程中有同位素分馏现象。因此建议在实验中测量样品中每一种元素天然同位素比值(即bgIRnat),并使用测量值来计算E值。
3.2 E值的应用
E值结果主要被用于以下4个方面:①评估金属元素生物可利用性;②结合其他检测方法,如连续提取法,评估微量元素的环境风险;③作为土壤特性的函数,预测土壤中污染元素的溶解度和离子活性,以及环境变化对其的影响;④结合同位素交换动力学(IEK)研究微量元素在土壤中的老化过程。
3.2.1 评估生物可利用性 基于元素的地球化学活性与生物可利用性之间的共性,E值通常被用来评估预测生物可利用性[33]。Shetaya等[34]比较了159个埃及土壤样品中Pb的E值与水果/植物中的Pb含量认为,植物更倾向于吸收土壤中活性的Pb。Hammer等[7]利用同位素稀释技术研究超累积植物天蓝遏蓝菜对Cd和Zn累积特征发现,这些植物也只能吸收土壤中的活性组分。
同位素稀释技术还可以研究动态环境下元素的生物可利用性。Izquierdo等[2]分析了淹水/落干条件下稻田土中Zn的E值,发现在淹水的第5天,生物可利用态的Zn迅速降低。可能是因为在厌氧条件下,活性的Zn被沉淀成为矿物质。次年,Izquierdo等[3]将E值与Tessier五步提取法结合,探究了淹水土壤中多元素(Cd、Zn、Pb、Fe)在淹水土壤中的化学行为,研究认为淹水所引起的土壤pH变化是这些元素生物可利用性改变的重要原因。
3.2.2 E值与化学提取法的比较及方法评估 1)E值与单级提取法的对比。单级化学提取是分析微量元素地球化学活性最经典常用的方法。最常采用的提取剂有中性盐(CaCl2、MgCl2等)、稀酸(HNO3、乙酸等)以及络合剂(EDTA与DTPA)。化学提取法具有操作简单的优势,但在分析过程中破坏了固液两相的平衡,导致结果不准确。同位素稀释技术可以被用于衡量提取剂在分析各元素在不同土壤中的适用性。Garforth 等[35]评价了4种常用提取剂对地球化学活性的预测结果认为:1 mol/L CaCl2一般情况下会低估Ni、Cu、Zn和Pb的活性;而0.43 mol/L HNO3则会高估元素的活性。相较而言0.43 mol/L乙酸与0.05 mol/L EDTA的结果最理想。Gäbler等[26]将E值(Cd、Cu、Ni、Pb 和Zn)与EDTA提取量进行了对比分析,结果证明两者得出的活性含量基本接近。但是,对于个别元素,如Cr,由于EDTA与其络合能力较差,所以用EDTA提取结果并不准确。土壤本身的理化性质也能影响化学提取法结果的准确性。在碱性土壤中,ISO认证的0.43 mol/L稀硝酸提取法[31]所提取的Ni、Cu、Zn、Cd和Pb浓度要远高于E值。这是因为土壤中与碳酸盐结合的非活性的重金属被酸溶解,因而高估了目标元素的活性。而在酸性土壤中,稀酸提取与E值的结果非常接近[27,30]。
此外,在预测土壤中金属元素的溶解度时,通常会使用元素的地球化学活性作为模型输入值,多方研究结果证明E值作为模型输入值比单级提取法作为输入值所预测的溶解度更符合实测值[26-27,32]。Ren等[36]通过同位素稀释技术与0.43 mol/L HNO3单级提取的结果对比证明,E值更适用于模拟研究土壤中Pb和Zn同位素交换组分中可溶的部分,单级提取的结果不能代替同位素稀释法作为输入值来评估土壤中不稳定态的Pb和Zn的含量。因此,可以从侧面证实使用同位素稀释法所测得的地球化学活性更为准确。
2)E值结合连续提取法的地球化学分析研究。连续化学提取,是指根据化学结合能力,采用组合的化学提取剂连续地将土壤、沉积物、污泥等样品中不同组分结合的无机物质分离出来的过程,Tessier五步法[37]及BCR四步法[38]是使用最广泛的两种连续提取法。将E值与元素形态结果进行比较可以推测某一形态的地球化学活性,并探讨元素形态在复杂环境中的转化机制,做出更准确的生态风险评估。
研究发现土壤中离子交换态、酸可提取态(碳酸盐结合态)以及可氧化态(有机结合态)中元素含量的总和通常与E值极为接近,均为活性元素[23,39]。而可还原态(铁锰氧化物结合态)与残渣态中的元素与土壤矿物结合较强,主要以非活性的形式存在。但在有机质含量极低、氧化性较强的土壤中,碳酸盐结合态的Pb也可能是非活性的[25]。通过比较氧化还原电位变化的土壤中E值与连续提取法形态结果,Izquierdo等[3]与Marzouk[40]的研究发现,在还原状态下,随着铁锰氧化物被还原溶解,土壤中Cd、Pb和Zn的E值增加,也证实了铁锰氧化物结合态的金属在氧化条件下主要以非活性的形式存在。
3.2.3 模拟预测土壤溶液中微量元素的含量 利用地球化学模型,如WHAM、Visual-Minteq等,预测金属元素的溶解度时,需将土壤中的活性元素含量以及理化条件(如pH、铁氧化物、腐殖酸、碳酸盐等)作为参考值输入模型。获得结果可以用于解释控制土壤中微量元素反应活性的潜在机制,为土壤中微量元素的化学活动提供合理预测。
Marzouk等人[27]利用同位素稀释法测定了英国矿区246个土壤样品中Pb、Cd和Zn的E值,结合WHAM地球化学形成模型预测了金属溶解度,发现用E值模拟所得的结果与实测值非常接近。Pb在土壤溶液中的含量范围很大,从10–3mol/L到10–10mol/L,受土壤固相以及pH影响很大;相较而言,Cd在土壤中的总量虽然很低(平均值仅为Pb的千分之一),但溶解度不低且范围较小(10–6~ 10–8mol/L)。其在土壤溶液中的含量主要受腐殖质影响。在另一个研究中,Mao等[41]证实,腐殖质还能影响土壤中Cu的活性及溶解度。
3.2.4 利用E值研究土壤重金属老化过程及影响因素 污染元素进入到土壤中后,通过吸附、沉淀等一系列化学反应由活性转为非活性的过程称为元素在土壤中的稳定化/老化过程。研究者们采用实验室污染培养法,结合E值,可以分析讨论污染物在土壤中老化-累积的过程。这些研究发现土壤中的矿物质(如沸石)和有机质(如胡敏酸)通过吸附、沉淀等化学反应对微量元素的老化过程有着重要影响[42-43]。Tye等[15]在一项为期818 d的实验中发现,Cd和Pb所形成的碳酸盐以及磷酸盐沉淀是其活性(E值)随时间推移降低的主要原因。碱性土壤中Cd和Pb的老化尤为明显。
4 总结与展望
同位素稀释技术是通过在固液平衡的土壤体系中加入外源富集同位素,用ICP-MS测定混合前后样品液相中的同位素丰度变化,来确定元素在土壤中的地球化学活性。同位素稀释法结果可以反映元素在一定时间内的潜在反应形态,也可以用于评估有毒微量元素的生物可利用性,结合地球化学模型或多级化学提取法分析其在土壤各相的浓度分布。该方法可以被用于土壤重金属污染的环境风险评估与预测,也可以用于研究微量营养元素的生物可利用性。
建立有效的同位素稀释方法前,应对目标元素、样品的理化性质有较全面的认识。在建立方法时,需要特别注意外源同位素的选择要准确、浓度应适中、振荡时系统应保持不变,平衡时间应在2 ~ 3 d之内,必要时可用树脂纯化方法排除液相中胶体的干扰。土壤中元素的总量或单一化学提取含量可以用于确定外源同位素的浓度。
在建立同位素稀释法的过程中,研究者可以根据具体情况对实验条件进行调整,扩大了技术的使用范围。特别适用于分析碱性土壤、受咸潮影响的沉积物等重金属迁移性、生物可利用性的研究。此外,同位素稀释技术在环境变化的系统中也有很大的优势,如淹水/落干的潮滩沉积物、水稻田、石油污染场地、回填土等。开发基于同位素稀释法的原位监测技术,不但可以更深入地了解环境中微量元素的地球化学反应与过程,还能进行更准确的环境评价与预测。
