儿茶素对巨噬-脂肪细胞共培养体系中细胞因子基因表达及AMPK/SIRT1磷酸化水平的影响
2021-05-15程安玮张梦迪王厚伟孙金月王新坤
程安玮,张梦迪,王厚伟,孙金月,王新坤,刘 超,王 青,郭 溆
(1 湖南农业大学食品科学技术学院 长沙410128 2 山东省农业科学院农产品研究所 农业农村部新食品资源加工重点实验室山东省农产品精深加工技术重点实验室 济南250100 3山东中医药大学药学院 济南250355)
炎症的发生、发展是由众多受体、信号转导通路及转录因子共同参与的复杂反应。炎症介质的生成是高耗能的过程,细胞的能量代谢状态与炎症的发生、发展密切相关[1]。脂肪组织不仅是能量储存的器官,还是重要的内分泌器官。脂肪细胞可分泌多种炎性因子和脂肪因子,这些炎性与脂肪因子的异常分泌将对机体机能产生很大影响。代谢性炎症是由脂肪组织的脂肪细胞和巨噬细胞共同发起和调控的,两者协同的应激反应为炎症的发生和发展提供了一个衔接口。
研究证明多酚类成分具有明显的抗炎活性,而儿茶素是茶多酚中的主要功效成分,占总量的70%以上。炎性脂肪细胞模型的构建,需要一定剂量的肿瘤坏死因子-α(TNF-α)作为诱导剂。巨噬细胞分泌的TNF-α 可作为炎性脂肪细胞的诱导剂,是否与通过直接添加TNF-α 的作用效果一致? 本文通过建立巨噬-脂肪细胞共培养体系,基于腺苷酸活化蛋白激酶/组蛋白去乙酰化酶(AMPK/SIRT1)信号通路,研究儿茶素对不同处理组中炎症标志物白介素(IL)与炎性酶基因表达水平的影响,以及对AMPK/SIRT1 磷酸化水平的影响,初步阐明儿茶素的抗炎作用机制。
1 材料与方法
1.1 材料与试剂
小鼠3T3-L1 前脂肪细胞 (GDC180)、小鼠RAW264.7 巨噬细胞(No.GDC143),中国典型培养物保藏中心(武汉大学)。儿茶素标品(纯度≥98%)、胰岛素(Inslulin)、甲基亚砜(DMSO),Solarbio 公司(北京);小牛血清(FCS),Gibco 公司;胎牛血清(FBS)、DMEM 高糖培养基、青链霉素、胰蛋白酶、地塞米松(DEX)、3-异丁基-1-甲基黄嘌呤(IBMX)、TNF-α,Sigma 公司(美国);PBS 缓冲液,Hyclone 公司(美国);EASYspin Plus 组织/细胞RNA 快速提取试剂盒,昊鑫生物公司;第一链cDNA 合成试剂盒、定量PCR 试剂(Rox),南京Vazyme 公司;RIPA 裂解液,碧云天公司;BCA 蛋白定量试剂盒,艾德莱公司;AMPK(Thr172)抗体、AMPKα 抗体、Sirt 1(Ser27)抗体、Sirt1 抗体,美国Abconal 公司。
1.2 仪器和设备
CO2培养箱(CCL-170A-8),ESCO 公司;倒置相差显微镜(CKX41),Olympus 公司;洁净工作台(SW-CJ-1FD),苏净安泰;低速台式大容量离心机(TDL-5),上海安亭科学仪器厂;台式高速离心机(Centrifuge 5417),Eppendorf 公司;荧光定量PCR仪7500(ABI Stepone plus)、双垂直电泳槽(DYCZ-24DN)、迷你双转印电泳槽(DYCZ-40D)、转移电泳仪(DYY-7C)、多用脱色摇床(WD-9405B),北京六一仪器厂;凝胶成像系统(JD801),江苏省捷达科技发展有限公司。
1.3 试验方法
1.3.1 巨噬细胞的培养 用完全培养基(含10%FCS,1%青链霉素)调整巨噬细胞密度为1×106个/mL,将细胞接种于25 cm2培养瓶中,一组为纯培养基,另一组培养基含终质量浓度1 μg/mL LPS,放置于CO2培养箱(5%CO2,37 ℃)培养24 h 后,弃去培养液,PBS 缓冲液冲洗2 次。
1.3.2 3 T3-L1 脂肪细胞的诱导分化 用完全培养基(含10%FCS,1%青链霉素),调整脂肪细胞密度为5×105个/mL 置于六孔培养板中,接触抑制培养2 d 后(即诱导分化第0 天),每孔加入含0.5 mmol/L IBMX、1 μmol/L DEX 和10 μg/mL Inslulin 的培养基诱导分化。分化到第2 天吸出1 mL 培养液,再加入1 mL 含有10 μg/mL Inslulin的FBS,第3 天重复1 次。以后每48 h 换液1 次,第10 天分化为成熟的脂肪细胞备用。
1.3.3 分组处理 共设4 个处理组,处理方式:1)N 组:脂肪细胞分化成熟后,培养基中分别加入含有终质量浓度0,50,100 μg/mL 的儿茶素,标记为N0、N50 和N100;2)T 组:成熟脂肪细胞用10 ng/mL TNF-α 诱导24 h 后,分别添加终质量浓度为0,50,100 μg/mL 儿茶素,标记为T0、T50 和T100;3)R 组:将成熟脂肪细胞与未经LPS 诱导的巨噬细胞于Transwell 培养板中共同培养24 h 后,分别添加终质量浓度为0,50,100 μg/mL 儿茶素,标记为R0、R50 和R100;4)L 组:将分化成熟的脂肪细胞与经LPS 诱导的巨噬细胞于Transwell 培养板中共同培养24 h 后,分别添加终质量浓度为0,50,100 μg/mL 儿茶素,标记为L0、L50 和L100。Transwell 培养板上层为巨噬细胞,下层为脂肪细胞,以上处理培养48 h,收集脂肪细胞备用。
1.3.4 荧光定量PCR 测定细胞因子基因的表达完全吸弃Transwell 板中的培养液,PBS 冲洗1次,收集脂肪细胞,RNA 提取按昊鑫生物公司试剂盒说明书操作。RNA 反转录按南京Vazyme 公司试剂盒说明书操作。逆转录反应体系:反应管中加入XμL RNA、2 μL 5×HiScriptRII qRT Super-Mix II,轻混匀,然后25 ℃10 min,50 ℃30 min,85 ℃10 min,终止反应后cDNA 保存于-20 ℃。利用合成的相应基因的引物(序列见表1)进行荧光定量PCR 检测,反应体系见表2。首先95 ℃预变性2 min,然后95 ℃变性10 s,60 ℃退火,延伸40 s,共40 个循环。GAPDH 为内参基因,对照组(N0)的2-(ΔΔCt)定义为1。

表1 定量PCR 的引物序列Table 1 The sequence of primers used for quantitative PCR

(续表1)

表2 定量PCR 反应体系Table 2 Reaction system of fluorescent quantitative PCR
1.4 Western blotting 测定AMPK/SIRT1 的磷酸化水平
收集的各处理细胞用冷PBS 溶液洗涤2 次,然后每孔加入200 μL PIPA 裂解液及2 μL 蛋白酶抑制剂,进行蛋白提取。用BCA 试剂盒测定蛋白浓度,用12%SDS-PAGE 分离胶、5%浓缩胶分离蛋白,然后转移到硝酸纤维素膜上,5%BSA 封闭1.5 h,加入1∶1 000 稀释的一抗p-AMPK 和p-SIRT1,4 ℃孵育过夜,室温下TBST 洗3 次,每次10 min,加入二抗稀释液(1∶1 000)并与膜接触,孵育1 h 后,TBST 再洗3 次,ECL 发光显色试剂盒显影成像。用凝胶图象处理系统和ImageJ2 软件分析目的条带的净光密度值。
1.5 统计分析
2 结果与分析
2.1 儿茶素对巨噬-脂肪细胞共培养体系中促炎性因子基因表达的影响
分别对不同处理组中IL-1α、IL-1β、IL-6、IL-12 等促炎性因子基因的表达水平进行了分析(图1)。N 组中,儿茶素对IL-1α、IL-1β、IL-6 和IL-12 4 个因子的表达水平没有明显的影响,这是因为脂肪细胞没有经过TNF-α 的诱导分化,没表现为炎性状态,因此炎性因子的分泌量和基因表达水平较低。T 组中,脂肪细胞经过TNF-α 诱导分化后呈炎性状态,炎性因子的分泌及表达水平明显上升,添加儿茶素后各因子的表达水平明显被抑制,并且随着添加质量浓度的增加,抑制效果越明显,呈剂量依赖关系。R 和L 组为巨噬-脂肪细胞共培养组,R 组中巨噬细胞未经LPS 诱导,然而分泌量的少量TNF-α 可将脂肪细胞诱导成炎性状态,加入儿茶素后各因子变化趋势同T 组。L 组中的巨噬细胞经LPS 诱导TNF-α 的分泌量更高,加入儿茶素后变化趋势同T 和R 组。比较R 和L 2个共培养体系,经LPS 和未经LPS 诱导的巨噬细胞TNF-α 的分泌量完全可将共培养体系中脂肪细胞诱导成炎性状态,促使IL-1α、IL-1β、IL-6 和IL-12 促炎性因子的大量分泌和基因表达。
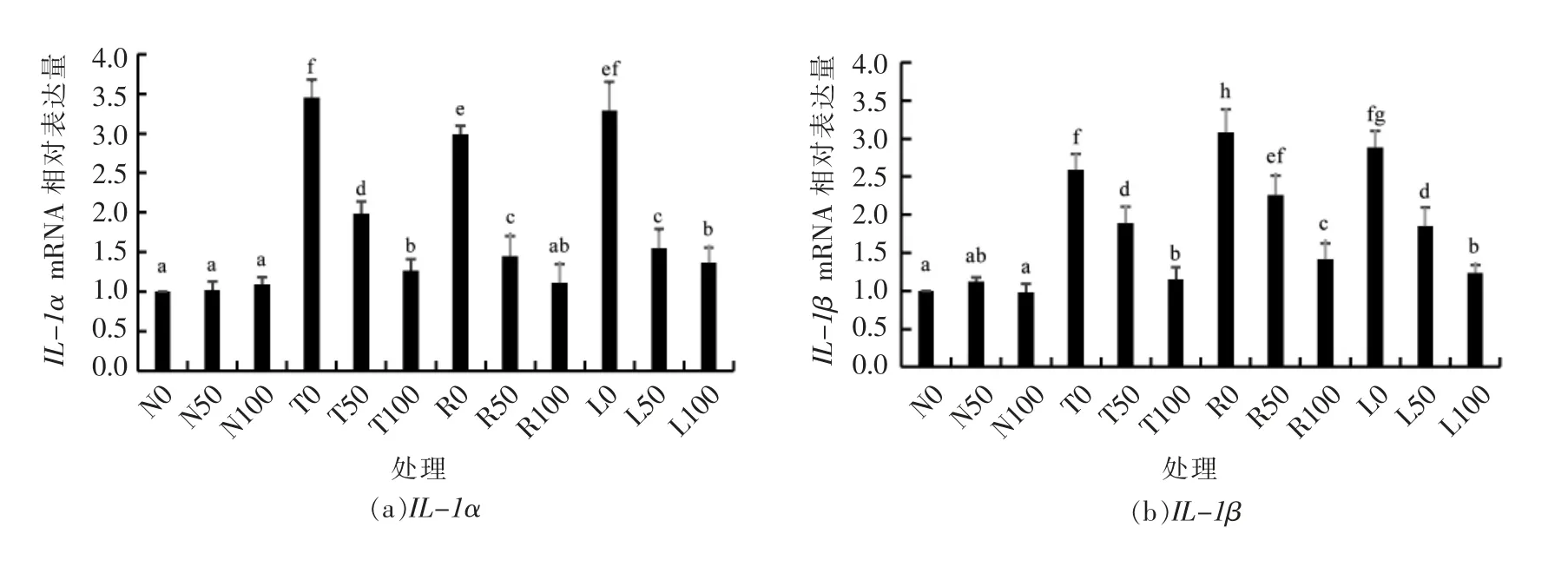

图1 儿茶素对巨噬-脂肪细胞共培养体系中促炎性因子基因表达的影响Fig.1 Effects of catechin on the gene expression of pro-inflammatory factors in macrophage and adipocyte co-culture system
2.2 儿茶素对巨噬-脂肪细胞共培养体系中抗炎性因子基因表达的影响
进一步分析了儿茶素对不同处理组中抗炎性因子IL-4 和IL-10 基因表达水平的影响(图2)。不同处理组中,儿茶素对抗炎性因子影响的变化趋势与促炎性因子的变化趋势相反。N 组中,抗炎性因子的基因表达量最高,然而差异不明显。T、R和L 组中,脂肪细胞经过外源添加TNF-α 或者共培养体系中巨噬细胞分泌TNF-α 的诱导作用,抗炎性因子的基因表达量明显降低;添加儿茶素后,随着添加量的增加,抗炎性因子的表达量也明显上升,呈剂量依赖关系。

图2 儿茶素对巨噬-脂肪细胞共培养体系中抗炎性因子基因表达的影响Fig.2 Effects of catechins on the gene expression of anti-inflammatory factors in macrophage and adipocyte co-culture system
2.3 儿茶素对巨噬-脂肪细胞共培养体系中炎性酶基因表达的影响
测定了不同处理组中儿茶素对炎性酶iNOS、COX-2 基因表达水平的影响,结果见图3。各处理组中儿茶素对炎性酶影响的变化趋势同促炎性因子一致。不添加儿茶素的4 个处理组中,与N0 相比,TNF-α 诱导的T0、R0、L0 处理中iNOS、COX-2 炎性酶基因的表达水平明显上升。添加儿茶素后,炎性酶基因的表达明显受到抑制,并且随着儿茶素质量浓度的增加,抑制效果更加明显。

图3 儿茶素对巨噬-脂肪细胞共培养体系中炎性酶基因表达的影响Fig.3 Effects of catechins on the gene expression of inflammatory enzymes in macrophage and adipocyte co-culture system
2.4 儿茶素对巨噬-脂肪细胞共培养体系中AMPK/SIRT1 磷酸化水平的影响
由图4结果表明,随着儿茶素处理质量浓度的增加,不同处理组中AMPK/SIRT1 的磷酸化水平明显上升。共培养R 组、L 组同T 组相比,磷酸化水平更高,然而R 和L 两组之间差异不明显。从结果来看,儿茶素对AMPK 和SIRT1 磷酸化水平的影响变化趋势基本一致,两者呈协同作用。
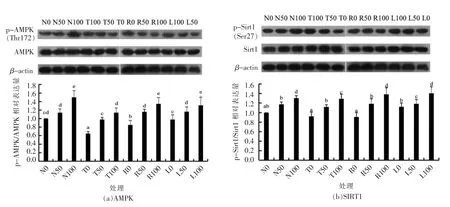
图4 儿茶素对巨噬-脂肪细胞共培养体系中AMPK/SIRT1 磷酸化水平的影响Fig.4 Effects of catechins on the AMPK/SIRT1 signal pathway enzymes in macrophage and adipocyte co-culture system
3 讨论与结论
3T3-L1 细胞属于小鼠源的成纤维细胞系,为前脂肪细胞,经特殊的诱导分化剂作用后,可以分化为成熟的脂肪细胞。该脂肪细胞在预防代谢综合征方面具有重要作用,慢性炎症与肥胖、高血脂、糖尿病等代谢性疾病的相关性已经逐渐成为学术界的共识。
3.1 炎性因子与炎症反应
炎性细胞因子是一类主要由免疫系统细胞生成的具有多种生物学效应的内源性多肽,可介导多种免疫反应,在传递信息、激活与调节免疫及炎症反应中起着重要作用。IL 是炎性细胞因子的重要一大类,IL-1、IL-6、IL-12 作为促炎性因子能够激活炎症反应,是炎性反应的促发剂,IL-4 和IL-10 作为抗炎性因子下调炎症反应,能够抑制前炎症细胞因子产生。iNOS 和COX-2 作为细胞中的炎性酶,在细胞受到刺激而被激活发挥着重要功效。褚武菁等[2]以3T3-L1 细胞为模型,证明胡柚乙醇提取物能明显降低细胞中IL-6 的分泌量。本试验的结果表明,共培养体系中,巨噬细胞分泌的TNF-α 可作为脂肪细胞的诱导剂,儿茶素能明显抑制促炎性因子IL-1、IL-6、IL-12 的基因表达,对炎性酶iNOS 和COX-2 的基因表达也呈抑制作用,然而对IL-4 和IL-10 的基因表达呈增加趋势,都表现出剂量依赖关系。
3.2 AMPK/SIRT1 与炎症反应
AMPK 作为机体重要的能量代谢感受器,主要在糖、脂肪和蛋白质代谢方面发挥着重要的调节作用[3]。SIRT1 为沉默信息调节因子基因家族成员之一[4]。体内外实验显示,AMPK 被激活后可显著减轻炎症介质的表达和组织的炎症损伤,成为抗炎调节的一个新靶点[5-7],若抑制AMPK 的活性,炎症反应增加;SIRT1 可通过减少炎性因子的产生及减轻炎性因子作用后的病理损伤来抑制炎症反应[5]。Sirt1 可去乙酰化并激活肝激酶B1,后者通过磷酸化AMPK (Thr172) 并抑制磷酸化酶对AMPK 的去磷酸化作用从而使其激活[8]。Lee 等[9]研究证明,从大麦中分离的多酚可以激活AMPK 通路,进而抑制促炎性因子TNF-α 及IL-6 的血浆水平;红茶中的茶黄素-3,3’-二肉桂酸酯(theaflavin-3,3’-digallate) 通过AMPK 途径抑制由脂肪-巨噬细胞交互引起的炎症反应[7]。多酚类物质,如槲皮素、儿茶酚等通过激活SITR1 调控炎症反应[10-11]。本文的研究结果表明,儿茶素可激活不同处理组中AMPK 和SITR1 的磷酸化表达水平,并与剂量呈正相关。相同添加质量浓度,共培养体系R 组和L 组细胞中AMPK 和SITR1 的磷酸化表达水平超过T 组。AMPK 和SIRT1 均对机体的能量状态代谢敏感,两者常常发挥协同效应,AMPK 的抗炎效应依赖SIRT1,AMPK 活性的改变影响到SIRT1 的含量及活性,两者具有正相关性[5,12]。本试验的研究结论支持AMPK 和SIRT1 在抗炎作用中发挥着协同作用,并对AMPK 和SITR1 激活效应呈量效关系。
通过巨噬-脂肪细胞共培养体系研究证明,儿茶素作为多酚中的一种重要成分,可经由AMPK/SIRT1 信号途径,通过抑制促炎性因子和炎性酶的基因表达,促进抗炎性因子的基因表达发挥明显的抗炎作用,这对预防和治疗代谢综合征等方面具有重要作用。
