STAT3及其下游miR-92a/KLF4/PI3K/Akt轴在先天性巨结肠病变组织中的表达
2021-05-14季春宜尹强袁妙贤陈立健谢惟心
季春宜,尹强,袁妙贤,陈立健,谢惟心
(湖南省儿童医院 普外一科,湖南 长沙 410007)
先天性巨结肠(hirschsprung disease,HD)是一种以肠道神经系统先天性缺陷为主要病理特征的复杂遗传性消化道异常病变,其病变机制与多种易感基因的异常表达密切相关,进而介导结肠神经异常发育,肠管失去正常蠕动发生痉挛、便秘和腹胀等多种临床症状[1-3]。临床上手术切除术仍是针对HD患者的有效治疗手段,而关于HD患者肠管动力障碍的病理生理机制尚不明确。近年来,有关HD 患者的结肠动力障碍机制的研究主要以结肠炎性病变为焦点[4-5]。研究[6-8]报道,信号传导与转录激活因子(signal transducer and activator of transcription,STAT)蛋白家族在多种遗传性疾病中异常表达,进而介导G蛋白偶联受体、Toll样受体、IL-6受体等信号通路被激活,持续性的STAT3活化导致下游信号基因及信号通路的转录失调和异常表达,从而促进多种疾病的发生发展。此外,研究[9]表明STAT3作为特异性炎症调控因子,既能维持疾病进展所需炎性环境,同时发挥较强的机体抗炎免疫应答。然而,STAT3在HD进程中的表达及意义尚未见报道。因此,本文探讨HD患者结肠病变组织中STAT3及其下游miR-92a/KLF4/PI3K/Akt信号通路中主要蛋白表达的变化,以期为揭示临床HD患者结肠动力障碍作用机制提供新视角和治疗靶点。
1 材料与方法
1.1 材料与试剂
先天性巨结肠患儿病变及正常结肠组织源自湖南省儿童医院;S-P免疫组化检测试剂盒购自美国Zymed生物公司;PCR引物由上海吉玛生物公司合成;实时荧光定量聚合酶链反应(qRT-PCR)试剂购自日本Takara生物公司;STAT3、KLF4、PI3K、p-PI3K、Akt、p-Akt和GAPDH一抗分别购自英国Abcam和美国Cell Signaling Technology生物公司;辣根过氧化物酶(HPR)标记的二抗购自武汉博士德生物科技有限公司;ECL化学发光液购自上海碧云天生物科技有限公司。
1.2 方法
1.2.1 S-P 免疫组化染色检测STAT3 组织阳性表达及定位将上述HD 患者的结肠病变和正常组织经石蜡切片为4~5 μm 组织薄片后脱蜡,滴加3%甲醇双氧水室温静止10 min 以封闭内源性过氧化物酶;采用0.01 mol/L(pH7.2)的PBS 缓冲液室温清洗3 次,5 min/次。随后滴加0.01 mol/L(pH6.0)的柠檬酸缓冲液于微波炉中煮沸2 次以进行组织抗原修复。取出薄片待自然冷却后采用PBS 清洗后加入二抗同源动物非免疫血清室温封闭10 min,随后滴加适度比例稀释的STAT3 一抗4 ℃过夜;次日,取出薄片采用PBS 室温清洗3 次,5 min/ 次,滴加生物素标记的二抗室温孵育10 min,PBS 洗PBS 室温清洗3 次,5 min/ 次;滴加链亲和素- 过氧化物酶室温静置10 min,PBS 洗PBS 室温清洗 3 次,5 min/ 次。最后采用新鲜配制的DAB 溶液室温显色并密切观察组织染色情况,自来水洗后,采用苏木素浅染细胞核,分化;最后用自来水冲洗、梯度酒精脱水、二甲苯透明后用中性树胶封片,显微观察上述分子的组织表达及分布情况并统计阳性细胞数和拍照记录。染色结果根据细胞着色程度差异分级表示,(-)表示阴性细胞,(+)表示淡棕黄色细胞,(++)表示处于淡棕黄色和深棕黄色之间的细胞,(+++)表示深棕黄色[10]。
1.2.2 qRT-PCR 检测RNA 表达采用TRIzol 裂解液提取上述收集HD 患者结肠病变组织和正常组织总RNA,采用Takara 公司5×PrimeScript RT Master Mix 反转录试剂盒获得cDNA,qRT-PCR严格按照Takara 公司2×SYBR Premix Ex Taq II说明书进行。采用仪器自带软件进行分析,基因相对表达量根据2-ΔΔCT法进行计算,以GAPDH 作为内参基因,检测组织样本中STAT3、miR-92a、KLF4、PI3K 和Akt 的RNA 表达水平,qRT-PCR引物序列如表1。

表1 qRT-PCR 引物序列
1.2.3 Western blot 检测蛋白表达采用适量PIPA+PMSF 组织裂解液裂解上述收集HD 患者结肠病变组织和正常组织总蛋白,室温静置5 min,4 ℃离心机12 000r/min 离心15 min,取上清置于新的1.5 mL 的EP 管中,记录蛋白总体积。采用BCA 法检测蛋白初始浓度并计算30 μg 蛋白上样体积,采用SDS-PAGE 蛋白凝胶进行电泳和转膜,5% 脱脂牛奶封闭后,采用适当比例稀释的STAT3、KLF4、PI3K、p-PI3K、Akt、p-Akt 和GAPDH 一抗稀释液4 ℃过夜孵育;次日,弃一抗,采用TBST 室温清洗后与1:3 000 比例稀释的山羊抗兔二抗室温孵育1 h,采用TBST 室温清洗后,采用ECL 发光仪和Bio-Rad 凝胶成像系统检测并记录蛋白表达量并进行灰度扫描分析,每组样品重复3 次。
1.3 统计学处理
数据分析采用SPSS 24.0和GraphPad Prism 7软件。组间计量资料比较采用t检验,以均数±标准差(±s)表示;采用Spearman进行相关分析,P<0.05为差异有统计学意义。
2 结 果
2.1 S-P 免疫组化检测STAT3 的组织阳性表达及定位情况
S-P 免疫组化检测H D 患者结肠病变组织中STAT3的阳性表达及定位结果见图1。结果表明,HD患者病变结肠组织中STAT3的阳性细胞数明显高于正常结肠组织[(28.35±2.45)个vs.(14.24±3.67)个,P<0.05]。
2.2 qRT-PCR 检测STAT3 及其下游miR-92a/KLF4/PI3K/Akt 信号轴分子RNA 表达
qRT-PCR检测HD患者结肠病变组织中STAT3及其下游miR-92a/KLF4/PI3K/Akt信号轴分子RNA表达,结果表明,H D 患者病变结肠组织中STAT3、miR-92a和KLF4/PI3K/Akt信号通路标志分子RNA表达较正常组织均明显上调(均P<0.05)(图2)。

图1 S-P 免疫组化检测HD 患者结肠组织中STAT3 的表达与分布情况(×40)
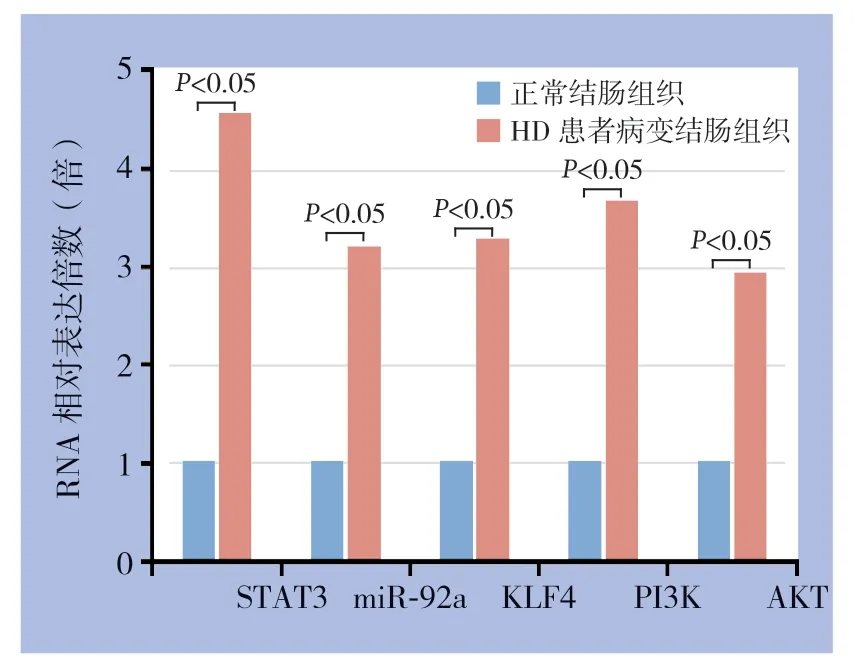
图2 qRT-PCR 检测STAT3 及其下游miR-92a/KLF4/PI3K/Akt 信号轴分子RNA 表达
2.3 Western blot 检测检测STAT3及其下游miR-92a/KLF4/PI3K/Akt 信号轴分子蛋白表达
Westernblot检测HD患者结肠病变组织中STAT3及其下游miR-92a/KLF4/PI3K/Akt信号轴分子蛋白表达,结果表明,HD患者病变结肠组织中STAT3、KLF4、p-PI3K和p-Akt蛋白表达较正常组织均明显上调(均P<0.05),而PI3K和Akt表达量两者之间差异均无统计学意义(均P>0.05)(图3)。
2.4 HD 患者结肠病变组织中STAT3 和miR-92a的相关性
相关性分析结果表明,HD患者病变结肠组织中STAT3 和miR-92a的表达呈明显正相关(r=0.992,P=0.003)。

图3 Western blot 检测STAT3 及其下游miR-92a/KLF4/PI3K/Akt 信号轴分子蛋白表达
3 讨 论
HD是临床小儿高发的肠道疾病,其诱因和发病机制目前尚未阐明明确。研究发现多种因素包括机体近端肠管机械性扩张、肠道感染、肠黏膜机械障碍、黏膜神经内分泌细胞减少以及基因表达异常均与HD的发生发展有关,上述因素均可导致患者肠管扩张产生腹胀、爆发行水样泻、发热等非典型症状。严重者肠神经元的缺失导致病变节段的紧张性收缩,导致功能性胃肠道梗阻[11-12]。临床上针对HD的治疗方法是手术切除术肠管并进行结肠肛管吻合术[13]。然而,结肠受累程度不仅影响患者临床表现,而且影响预后和可用的治疗方案。尽管手术治疗对患者具有一定临床效果,但全结肠和小肠/广泛的梗阻患者较高的病死率以及患者术后较高的大小便失禁和便秘发生率大大降低临床疗效与满意度[14]。因此,寻找有效的治疗手段或治疗靶点成为临床HD患者治疗的重要难题。
目前关于HD的发病机制尚未完全明确,研究表明可能与基因多态性、肠黏膜屏障受损、慢性持续性炎症等因素有关[15]。炎性信号转导因子STAT3及家族成员在多种炎性病变组织内呈异常过表达,且与患者的病变程度密切相关。STAT3作为细胞内重要的信号传导和转录因子,能够调控下游多种细胞因子的表达和信号通路活性,参与机体多种生理病理进程[16]。近年来大量研究证实STAT3炎性信号通路在多种恶性肿瘤中异常活化并能够促进恶性肿瘤的炎-癌转化,靶向STAT3信号有望为临床抗肿瘤治疗提供新靶点[17-18]。STAT3是最常见的炎症标志物,可能参与HD的发病过程。本研究采用免疫组化染色结果发现,HD患者病变结肠组织中STAT3的阳性表达较正常结肠组织显著升高,提示STAT3介导的炎症反应在诱发HD进程中发挥重要作用。
miR-92a是一种细胞内广泛分布的较小的非编码RNA,能够参与体内基因表达的调控继而参与调节机体多种生物学信号通路[19]。最新研究发现,miR-92a的突变或异常表达与多种人类炎性反应以及恶性肿瘤进程密切相关[20]。研究表明多种机体炎性疾病中miR-92a表达上调,进而抑制机体抗炎能力,促进炎症反应的持续以及肿瘤的炎-癌转化进程,在临床慢性致炎疾病的诊疗中发挥重要作用。相关研究报道致炎因子STAT3的异常表达能够上调miR-92a的表达,继而参与调控炎症进展,然而HD患者病理进程中两者之间的相互作用及对对疾病影响尚无明确报道[21-22]。本研究结果发现,HD患者病变组织中STAT过表达能够显著上调miR-92a的转录水平,提示STAT3和miR-92a的相互作用在促进HD患者病变进程中发挥协同作用。
KLF4/PI3K/Akt信号通路是哺乳动物体内广泛存在的经典信号通路,在介导细胞分化、增殖、自噬、凋亡等多种进程中发挥重要作用[23-24]。研究[25]显示,KLF4/PI3K/Akt信号通路异常活化能够诱导溃疡性结肠炎的发生和进展。另外,在持续炎症环境下,活化的Akt还可以激活NF-κB,提高病变组织内TNF-α、IL-6等促炎性因子的转录水平,扩大炎症反应,加重组织损伤[26]。本研究通过对比HD患者结肠病变及正常组织中KLF4/PI3K/Akt信号通路标志分子活性,结果显示HD患者病变结肠组织中KLF4/PI3K/Akt信号通路标志分子的总RNA和蛋白表达水平均显著高于正常结肠组织。此外,相关性分析结果表明HD患者病变结肠组织中STAT3和miR-92a的表达呈明显正相关(r=0.992,P=0.003)。综上所述,致炎信号传导与转录因子STAT3通过上调miR-92a的转录水平,介导KLF4/PI3K/Akt信号通路活化,诱导先天性巨结肠的发生发展,靶向STAT3及其下游miR-92a/KLF4/PI3K/Akt信号轴,有望为临床先天性巨结肠的预防及诊疗提供新治疗靶点和理论依据。
