化纤胶囊2号通过调控氧化应激缓解脓毒症诱导的大鼠心肌损伤
2021-05-13吴丽丽梁群
吴丽丽,梁群
(1.黑龙江中医药大学,黑龙江 哈尔滨 150040;2.黑龙江中医药大学附属第一医院,黑龙江 哈尔滨 150040)
脓毒症是机体感染后炎症反应失控,出现过强、过激的多器官功损伤[1],经充分补液与治疗仍旧存在难治循环障碍的脓毒症休克,病死率高达30%~40%[2],而此时循环障碍多由心脏泵功能衰竭引起[3]。脓毒症诱导心肌损伤时冠脉血流的充盈并没有减少,反而随着脓毒症的病情加重,冠脉血流有增加,这意味着心肌存在实质损伤[4]。脓毒症过程中细菌产生的毒素,尤其内毒素——脂多糖,可以激活前哨巨噬细胞及肥大细胞释放炎性细胞因子白介素-1前体(IL-1β)、肿瘤坏死因子-α(TNF-α)[5],激活机体免疫反应及吞噬作用[6]。其中嗜中性粒细胞是最主要的杀伤细胞,嗜中性粒细胞由血中游走到感染组织后进一步被激活成为吞噬细菌,在胞内形成吞噬溶酶体,通过强大的呼吸暴发作用杀灭细菌。呼吸暴发为激活的中性粒细胞增加耗氧量产生大量氧自由基,氧自由基可破坏多糖、氧化蛋白质、氧化不饱和脂肪酸,但杀伤细菌的同时还可通过脂质过氧化损伤机体的细胞膜及细胞器[7]。脓毒症通过增强炎症反应、自由基的产生、氧化应激和细胞凋亡诱导心肌损伤[8]。内源性抗氧化剂谷胱甘肽过氧化物酶(GPx)和超氧化物歧化酶(SOD)能加速氧自由基的清除,其活性的降低可进一步加重心肌损伤[9]。本研究从氧化应激的角度探讨化纤胶囊2号对脓毒症后心肌的保护作用,为寻找中医药防治脓毒症心功能障碍提供参考依据。
1 材料与方法
1.1 实验动物
雄性SD大鼠,体质量200~230 g,购自黑龙江中医药大学实验动物中心,饲养条件为湿度(60±5)%,温度(24±3)℃,光、暗循环12 h。本研究的所有方案均经黑龙江中医药大学动物伦理委员会批准。大鼠适应性喂养3 d后进行实验。
1.2 实验分组
取大鼠随机分为对照组8只;脓毒症组(CLP组)16只,其中12、24 h每组各8只;脓毒症+化纤胶囊2号组(CLP+化纤胶囊2号组)16只,其中12、24 h每组各8只。
1.3 实验造模
使用CLP方法诱导脓毒症大鼠模型,腹腔注射水合氯醛350 mg/kg麻醉大鼠,腹中线切开2~3 cm暴露盲肠,用4-0丝在盲肠中部结扎,随后用18号针在结扎下方穿孔2次,使粪便从穿孔中流出,确保穿刺效果,将盲肠缝合于腹腔内位置后闭合腹部。对照组进行手术,不结扎、不穿刺盲肠。连续1周。观察大鼠的一般状态,记录大鼠体温、呼吸等生命体征;绘制生存曲线建立脓毒症心肌损伤模型。
1.4 实验药品
化纤胶囊2号方组成如下:黄芪、 红花、桃仁、制附子制、丹参、当归、赤芍、熟大黄、茯苓、白术、党参、川芎、生地黄、北沙参、麦冬、白芍、蛤蚧粉和炙甘草等。
药物制备:取上述中药,参照《中华人民共和国药典》(2005版)中药胶囊剂制作方法,由黑龙江中医药大学附属第一医院制剂室制备化纤胶囊,规格为0.75 g/粒。具体制备过程为:称取所有中药饮片(生药量105 g),加入14倍量的蒸馏水,煎煮3次。每次煮沸后再文火煎煮1 h,后用纱布过滤,将得到的3次药液合并,加压浓缩为稠膏状,再制成冻干粉,灌装胶囊。实验时用无菌蒸馏水将化纤胶囊2号内容物稀释,至浓度为20 mg/mL。
1.5 给药方式
对照组:按照对照组造模方法处理后灌肠给予0.9%生理盐水10 mL/kg。
脓毒症组(CLP组):造模后灌肠给予0.9%生理盐水10 mL/kg。
脓毒症+化纤胶囊2号组:造模后给予灌肠给药(0.9%生理盐水+化纤胶囊2号10 mL/kg)。
1.6 观测指标
模型制备后于12 h、24 h各时间,取血进行各项检测。取静脉血注入试管中立即离心(3 000 r/min),收集血清存放于-70 ℃冰柜内待检,检测炎症肌心肌酶学指标。24 h后处死进行心肌组织匀浆,提取蛋白以备用,观测氧化应激指标。
1.6.1 炎症因子的测定
采用ELISA试剂盒,根据试剂盒生产厂家说明,测定心肌损伤大鼠血清中IL-1β、TNF-α的水平。
1.6.2 心肌酶的测定
每只大鼠取血后,血液3 500 r/min离心30 min。分别用不同的试剂盒测定血清中LDH和CK-MB的水平。
1.6.3 氧化应激标志物的评估
通过ELISA试剂盒测定丙二醛(MDA)水平、谷胱甘肽过氧化物酶(GPx)和超氧化物歧化酶(SOD)活性等心肌组织中氧化应激水平。
1.7 统计学处理
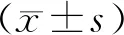
2 结果
2.1 各组大鼠炎症因子IL-1β、TNF-α水平比较
与对照组相比,CLP组大鼠血清炎症因子水平明显升高(P<0.01);与CLP组相比,CLP+化纤胶囊2号组中炎症因子IL-1β、TNF-α的水平显著降低(P<0.01)。结果见表1。
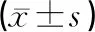
表1 各组大鼠炎症因子IL-1β、TNF-α的水平比较
2.2 各组大鼠心肌酶血清中LDH和CK-MB的水平比较
与对照组相比,CLP组LDH和CK-MB水平明显提高(P<0.01),而化纤胶囊2号治疗逆转了脓毒症心肌损伤大鼠血清心肌酶的水平(P<0.01)。结果见表2。
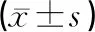
表2 各组大鼠心肌酶血清中LDH和CK-MB的水平比较
2.3 各组大鼠氧化应激损伤指标丙二醛(MDA)水平比较
与对照组相比,CLP组心肌组织中MDA水平明显升高(P<0.01);而化纤胶囊2号可抑制脓毒症致心肌损伤大鼠心肌组织中MDA水平升高(P<0.01)。结果见表3。
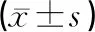
表3 各组大鼠氧化应激损伤指标丙二醛(MDA)水平比较
2.4 各组大鼠抗氧化酶胱甘肽过氧化物酶(GPx)和超氧化物歧化酶(SOD)的水平比较
与对照组相比,CLP组心肌组织中SOD和GPX活性降低(P<0.01);而化纤胶囊2号可以增强脓毒症致心肌损伤大鼠心肌组织中SOD和GPX活性(P<0.01)。结果见表4。
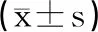
表4 各组大鼠GPx和SOD水平比较
3 讨论
脓毒症患者血清LDH水平可在一定程度反应患者能量代谢状态,作为脓毒症患者休克判定的参考指标和早期病死率的有效预测指标[10-11]。IL-1β、TNF-α可反应机体感染早期炎症水平[12]。丙二醛(MDA)是细胞膜上多不饱和脂肪酸受到自由基攻击后产生的脂质过氧化产物,MDA增高提示氧化应激增加[13]。谷胱甘肽过氧化物酶(GPx)和超氧化物歧化酶(SOD)属于机体抗氧化酶,能够清除超氧阴离子自由基,保护细胞免受损伤。MDA、SOD和GPx结合多用于评价机体的氧化应激及抗氧化情况[14]。脓毒症会导致包括心肌组织损伤在内的多器官功能障碍,对脓毒症的治疗是一个挑战。本研究测定脓毒症心肌损伤大鼠血清炎症因子、血清心肌酶水平,测定心肌损伤大鼠心肌组织氧化应激损伤及抗氧化水平功能,确定了化纤胶囊2号对脓毒症心肌损伤的保护作用。在CLP组大鼠中,炎症的发生是由于炎症因子的增加,而化纤胶囊2号的治疗改善了炎症因子水平。炎症因子、氧化应激激活导致包括心肌组织在内的不同器官的损伤。增加抗氧化继而降低氧化应激反应可以防止心肌组织的损伤,本研究证实,化纤胶囊2号治疗可以抑制氧化应激增强水平。
化纤胶囊 2 号以“化纤胶囊”为研发基础进行化裁而来。考虑脓毒症合并心肌损伤伴有因全身血液高度浓缩引发的凝血功能异常,以及因血液组分外渗导致的水肿等临床症状,故经辨证后在原方的基础上结合“桃红四物汤”“当归补血汤”“真武汤”等经典方剂进行改进。方中黄芪、红花、桃仁、附子共为君药,具有益气活血、扶正固本、温阳利水的作用[15-17]。
综上所述,越来越多的证据表明,脓毒症诱发的心肌损伤可增加脓毒症的病死率。心脏是脓毒症早期和渐进方式受到深刻影响的器官之一[18]。脓毒症引起的心肌功能障碍(SIMD)机制并非冠状动脉血流不足导致的整体性心肌缺血[19]。而是由于脓毒症期间机体对炎症的过强、过激反应[20-21],及中性粒细胞吞噬细菌的呼吸暴发中产生大量氧自由诱导心肌损伤。研究显示冠状动脉血流分布不均、内皮损伤、血管内纤维蛋白沉积和中性粒细胞浸润导致心脏微循环障碍[22],而氧化应激可引起心肌的不可逆损伤[23]。因此,脓毒症经充分补液与治疗后,心脏微循环恢复,仍旧会存在难治的循环障碍,目前已证实脓毒症后存在的心肌实质损伤引起心脏功能下降[24]。本研究应用具有益气活血、扶正固本、温阳利水作用的中药化纤胶囊2号治疗脓毒症诱导心肌损伤大鼠,并通过监测早期炎症因子、心肌酶及氧化应激水平的变化,证实了化纤胶囊2号具有减轻脓毒症的炎症反应作用,还能降低脓毒症诱导的心肌损伤大鼠的氧化应激水平,由此达到保护脓毒症诱导的心肌损伤的目的。
