鸭坦布苏病毒病-H9亚型禽流感二联灭活疫苗免疫佐剂筛选
2021-05-12田宇杰嵇辛勤章丽娇刘青涛韩凯凯刘宇卓赵冬敏王梦瑶
田宇杰,嵇辛勤,章丽娇,刘青涛,韩凯凯,杨 婧,刘宇卓,赵冬敏,刘 娜,王梦瑶,李 银*
(1.贵州大学动物科学学院,贵州贵阳 550025;2.江苏省农业科学院 兽医研究所/农业部 动物疫病诊断与免疫重点开放实验室/国家兽用生物制品工程技术研究中心,江苏南京 210014;3 贵州省农业科学院 畜牧兽医研究所,贵州贵阳 550025)
自2010年4月以来,江苏、浙江、福建、安徽、江西和河北等省的鸭发生了一种以产蛋率、采食量显著下降,具有脑炎样神经症状的传染病,引起该病的病原为一种新的黄病毒,即鸭坦布苏病毒(Duck Tembusu virus,DTMUV)[1-2]。感染DTMUV的鸭群主要表现为采食骤降、产蛋骤降乃至停产的主要临床特征,并伴有食欲减退、高热、排绿色粪便及运动障碍,有的出现精神沉郁、共济失调,严重者发生死亡。该病在我国大部分养鸭地区均有流行,已成为危害水禽养殖的重要传染病之一[3]。有研究发现,我国7省(区)产蛋鸭群存在DTMUV的严重感染,应引起高度重视[4]。
禽流感病毒(Avian influenza virus,AIV)属于正黏病毒科A型流感病毒属,家禽感染AIV后,有的不表现临床症状,有的表现为呼吸道疾病和产蛋下降,严重的可导致全身性疾病。自20世纪90年代以来,H9N2亚型AIV已在世界多个国家和地区发展成地方流行并形成了稳定的种系,是当前禽流感流行的主要病毒亚型之一,严重危害养禽业的发展。通过对水禽流感监测、病毒分离鉴定及基因树分析表明,无论是哺乳动物还是鸡源禽流感病毒,均可从鸭等水禽分离到。随养殖量的渐增,水禽AIV(H9亚型)发生普遍,造成减蛋减产,诱发免疫抑制易继发感染,为其他亚型AIV提供基因供体。鸭等水禽兼具AIV(H9亚型)储存宿主、传染源和易感者[5],因此,从源头上控制和消灭鸭的H9亚型禽流感会起到事半功倍的作用。在鸭的养殖过程中,DTMUV和AIV(H9亚型)常常混发和继发[6],并且症状和病变相似不易区分。尽快研制出能有效防控 H9亚型AIV和TMUV的疫苗十分重要。
佐剂能诱发机体产生长期、高效的特异性免疫反应,提高机体保护能力,同时减少免疫物质的用量,降低疫苗生产成本。由于佐剂各自性质不同而导致刺激机体抗体产生水平和持续期也存在较大差异,所以不同佐剂制成的疫苗的免疫效果也会有差别[7]。二联疫苗中两种抗原相混具有稀释作用,为保证二联疫苗的免疫效果,本试验对鸭二联疫苗的佐剂进行对比筛选,即将不同佐剂与相同含量的坦布苏病毒病和H9亚型禽流感两种抗原制成灭活疫苗,免疫樱桃谷肉鸭,通过测定抗体水平筛选理想的二联疫苗佐剂。
1 材料与方法
1.1 材料
1.1.1 实验动物与病毒株 24日龄非免疫鸭樱桃谷鸭,购自南京大厂区某养鸭场,AIV(H9亚型)HI抗体与DTMUV ELISA抗体均为阴性。鸭源H9亚型AIV NJ01株,DTMUV JS804株,由江苏省农业科学院兽医研究所禽病实验室分离、鉴定、保存。
1.1.2 主要试剂 卡波姆(971P)购自北京国人逸康科技有限公司;铝胶、白油均购自南京天邦生物科技有限公司;蜂胶购自威海百合生物技术股份有限公司。
1.1.3 主要仪器 立式蒸汽灭菌器(SY-450)购自徐州圣华医疗器械有限责任公司;酶标仪(ELx800)购自美国伯腾仪器公司(Biotek);优普超纯水制造系统购自南京优普试验仪器有限公司;二级生物安全柜购自西班牙Telsta BioIIA公司;电热恒温培养箱(DNP-916A)购自上海光都仪器设备有限公司;精密电子天平(AA200)购自美国丹佛仪器公司(Denver Instrument); 高速冷冻离心机购自德国艾本德公司(Eppendorf);低温冰箱购自海尔公司。
1.2 方法
1.2.1 抗原制备 将DTMUV JS804株和AIV(H9亚型)NJ01株分别接种BHK-21细胞和SPF鸡胚进行增殖,DTMUV与AIV(H9亚型)尿囊液均采用1/1000 β丙内酯灭活。将灭活后的AIV(H9亚型)与DTMUV液按照1∶2比例混合作为二联抗原,分别与不同佐剂制成二联疫苗。
1.2.2 不同佐剂灭活疫苗的制备 ①卡波姆佐剂。卡波姆母液的配制:称取卡波姆(971 P)粉末,用无菌超纯水膨胀过夜,使用1 mol/L NaOH(PBS配制)调pH7.0,用灭菌PBS定容,使卡波姆浓度为6 mg/mL,高压灭菌后即为母液。取卡波姆母液分别与二联抗原和灭菌PBS配制,体积占比均为1/3,卡波姆终浓度为2 mg/mL、3 mg/mL、4 mg/mL的卡波姆佐剂疫苗,分别标记为1号、2号、3号疫苗。②铝胶佐剂疫苗。取7.5 g铝胶,加入50 mL PBS,充分溶解,用乳化仪低速搅拌,溶解后的铝胶与二联抗原以2∶1的体积比混合,搅拌1 min,标记为4号疫苗。③白油佐剂疫苗。取47 mL白油与3 mL司本-80混合后高温灭菌,作为油相;取二联抗原25 mL,加入1.5 mL吐温-80混匀,作为水相;油相经过乳化仪低速搅拌后加入水相,体积比为2∶1,再高速搅拌1 min,标记为5号疫苗。④蜂胶佐剂疫苗 取3 g蜂胶,加入50 mL 950 mL/L酒精,37℃溶解24 h后取出,按照蜂胶∶二联抗原∶灭菌PBS=1∶1∶1比例配制,搅拌1 min,标记为6号疫苗。
1.2.3 疫苗的免疫接种 取1月龄非免疫鸭49只,随机平分成7组,第1组~第6组按表1腿部肌肉注射不同佐剂的灭活疫苗,第7组接种灭菌PBS作为空白对照。

表1 动物分组及免疫情况
1.2.4 免疫效果的检测 血清制备:分别于免疫前及免疫后1、2、3周翅静脉采血,37℃放置1 h,4℃条件下过夜后,经3 000 r/min离心5 min,分离血清,取上清液,置-20℃保存。H9亚型禽流感抗体的测定:参照常规血凝抑制试验[8],AIV的血凝抑制效价≥1∶8(23)判定为阳性。坦布苏病毒抗体的检测:参照文献[9]阻断ELISA方法的操作程序进行。阻抑率≥30%为阳性。
2 结果
2.1 免疫前后抗体抗体效价变化
抗体检测结果均为阴性。对1月龄樱桃谷鸭进行首免,21 d后二次免疫,间隔1周采集鸭血清,采用血凝抑制HI试验进行抗体检测(图1)。白油组于一免后14 d HI效价到达3 log2,抗体产生期较短,之后抗体水平持续升高,二免后HI效价能到达10 log2,明显高于其他各组;其他组别则于二免后产生较高水平抗体,抗体产生期慢且水平较低。
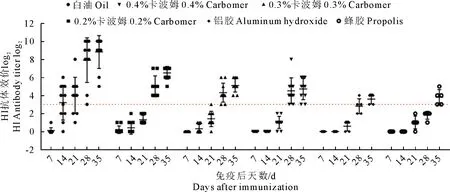
图1 免疫后鸭抗AIV HI抗体水平变化情况
2.2 免疫后坦布苏病毒抗体效价的变化
对1月龄樱桃谷鸭进行首免,21 d后二次免疫,间隔1周采集鸭血清,采用阻断Elisa方法进行抗体检测(图2)。白油组与卡波姆各组基本于一免后14 d产生较高水平抗体,其中白油组产生抗体水平较高,而卡波姆各组中4 mg/L组较高,铝胶组和蜂胶组抗体产生期长,抗体水平不高。

图2 免疫后鸭抗DTMUV抗体水平变化情况
3 讨论
卡波姆无毒、无刺激性,可增强机体特异性免疫能力。本试验所用卡波姆971P,其黏度(厘泊数)为2 000~11 000 cP,常用于口服、局部给药、控释骨架片、助悬剂[10]。标有字母P是唯一可用于口服或与黏膜接触的药用级别的聚合物。卡波姆单独作为佐剂或其与免疫刺激复合物的混合物作为佐剂能诱导机体产生高水平细胞免疫和体液免疫应答[11]。卡波姆作为一种新型佐剂被广泛应用于疫苗研制,本试验卡波姆佐剂疫苗免疫效果比油佐剂要差,水佐剂各组中免疫效果最好。
蜂胶是蜜蜂采集植物幼芽分泌的树脂,并混入蜜蜂上腭腺分泌物、蜂蜡、花粉及其他一些有机物和无机物的一种天然物质[12]。具有抗菌、抗肿瘤、抗病毒、增强机体免疫功能和促进组织再生等作用。能刺激机体细胞免疫、体液免疫、红细胞免疫系统和巨噬细胞补体系统产生免疫应答,作为佐剂具有良好的免疫增强作用。本试验中蜂胶佐剂疫苗免疫效果不理想,可能由于蜂胶剂型、工艺指标、产地等不同造成有效含量不同所致,或是杂质含量多未能充分溶解,蜂胶有效含量不足,影响免疫效果。铝胶佐剂能起到抗原储存库和传递作用,可引起机体产生局部炎症反应,增强固有免疫、获得性免疫及激活补体系统[13]。铝胶佐剂疫苗进入机体后会形成一个富含巨噬细胞的肉芽肿,持续刺激机体产生免疫应答。本试验表明铝胶佐剂疫苗免疫效果并不理想。
白油佐剂的作用机制是抗原包被在油相形成的微结构内,产生的储库效应能使抗原缓慢释放,刺激B淋巴细胞产生抗体[14]。白油是经超深度精制脱芳烃、硫和氮等杂质而得到的特种矿物油品,其对各种细胞因子具有较强的刺激作用,促进抗体产生。本次试验表明,白油佐剂免疫效果最佳。白油佐剂DTMUVD-AIV(H9)二联灭活疫苗免疫效果最好,抗体产生快、抗体滴度高,且高滴度抗体持续时间长,为制备本疫苗的首选佐剂。另外有研究表明白油可与IL-2混合作为佐剂的DTMUVD 灭活疫苗,比单独白油佐剂疫苗具有更好的免疫效果,可为DTMUVD-H9AI二联灭活疫苗的佐剂选择提供参考[15]。卡波姆佐剂各组于免疫后14 d可产生较高的坦布苏病毒病抗体,提示可作为坦布苏病毒病疫苗理想佐剂,但禽流感抗体产生较慢,至二免后才产生较高水平抗体,但抗体效价比白油佐剂疫苗低,说明其整体免疫效果低于白油佐剂疫苗组。
由上述可知该白油组较其他各组刺激机体产生的抗体水平更高,抗体产生早,而其他各组均为水佐剂组,说明二联苗中油佐剂较水佐剂组免疫效果更好;而水佐剂中卡波姆免疫效果最好,且二免后能达到免疫保护所需抗体水平。考虑到油佐剂疫苗在免疫过程中出现肌肉炎性反应,卡波姆可作为疫苗佐剂较为理想的选择之一。实践中应考虑到在充分发挥动物巨大的免疫潜力的同时应避免由于加载过多的成分而导致动物免疫能力及生理能力的浪费,因此研制适合家禽的微量、安全、高效、精准的新型疫苗将成为未来疫苗发展的方向[16]。
