苏木乙酸乙酯提取液通过miRNA-129-5p/Beclin1信号对血管内皮细胞自噬的影响*
2021-05-12李鑫峰袁星星周亚滨杨建飞
李鑫峰 袁星星 周亚滨 杨建飞 王 倩
(1.贵州中医药大学,贵州 贵阳 550025;2.黑龙江省中医药科学院,黑龙江 哈尔滨 150001;3.黑龙江中医药大学附属第一医院,黑龙江 哈尔滨 150040;4.贵州中医药大学第二附属医院,贵州 贵阳 550001)
动脉粥样硬化(AS)是缺血性心血管疾病的主要病理基础,主要表现为大中动脉内膜内的脂质堆积,促使管壁斑块形成、坏死、弹性降低,最终引起管腔狭窄或者阻塞的一类血管炎性疾病[1-2]。既往研究认为AS主要与脂质代谢紊乱、氧化应激、炎症反应、血小板激活、血管平滑肌细胞激活及免疫功能异常等因素有关[3]。然而近年来越来越多的研究关注到内皮细胞损伤在早期AS中的作用,因此修复内皮细胞损伤对于防治AS具有重要的意义。细胞自噬是真核生物内广泛存在的一种自稳机制,其主要通过清除生物体内功能异常的细胞器、被氧化的脂质及错误折叠的蛋白质等有害大分子物质以维持细胞的正常功能。内皮细胞自噬已被证实在AS发生初期起到了关键性的作用,自噬能够增强内皮细胞抗氧化应激损伤的能力和抑制内皮细胞凋亡,进而减缓斑块的形成[4]。课题组前期的研究结果发现苏木乙酸乙酯提取液(SAEE)能够通过抗炎、免疫调控、抑制脂质沉积和增加斑块稳定性等方面发挥抑制AS的作用[5-8]。同时,笔者研究发现SAEE能够促进细胞自噬进而抑制高脂饮食诱导的ApoE-/-小鼠证实动脉粥样斑块的形成和脂质蓄积。为进一步研究SAEE促进自噬的机制,本研究通过观察SAEE对氧化型低密度脂蛋白(ox-LDL)所诱导的内皮细胞损伤模型中自噬水平及miRNA-129-5p/Beclin1信号影响,以期进一步明确SAEE抑制AS的作用机制。
1 材料与方法
1.1 细胞株
人脐静脉内皮细胞株(HUVEC)购自武汉佰仟度生物科技有限公司,该细胞株由美国典型培养物保藏中心引进。
1.2 药物与试剂
ox-LDL购自北京索莱宝公司(货号:H7980);苏木生药购自贵州中医药大学第二附属医院,经乙醇浸泡等工序,合并后的滤水浴蒸干,制备乙醇提取干粉。经乙酸乙酯萃取后,所得溶液即为SAEE(纯度98%)。MTT细胞增殖及细胞毒性检测试剂盒、辣根过氧化物酶标记山羊抗兔IgG(H+L)购于上海碧云天生物技术有限公司(货号分别为C0009和A0208);RPMI 1640、10%胎牛血清(FBS)、青霉素-链霉素混合液购于美国Gibco公司(货号分别为A4192301,16140071和10378016);兔抗Beclin1、LC3B和GAPDH单克隆抗体购于美国Abcam公司(货号分别为ab210498,ab192890和ab8245);逆转录试剂盒购于北京宝日医生物技术有限公司(货号RR047A);RNA提取试剂盒和SYBR Green实时荧光定量PCR试剂盒购于美国Thermo Fisher公司(货号分别为15596026和A25742);双荧光素酶报告质粒载体psi CHECK2购于美国Promega公司(批号1908319);miRNA-129-5p mimics和miRNA-129-5p NC由上海吉玛制药技术有限公司合成(批号191019)。
1.3 分组及干预
HUVEC放入含10%胎牛血清、100 μg/mL青链霉素混合液的DMEM培养基中,置于37℃、5% CO2的饱和湿度培养箱中。HUVEC以2×105个细胞数种于100 mm培养皿中,分为空白组、模型组、SAEE组、模拟剂组及SAEE+模拟剂组,其中除空白组外,其余组参照文献[9]中方法采用100 μg/mL ox-LDL对细胞进行诱导构建内皮细胞损伤模型。此外,模拟剂组及SAEE+模拟剂组分别参照试剂说明书要求,转染100 nmoL miR-129-5p至细胞,SAEE组和SAEE+模拟剂组加入200 μg/mL SAEE进行干预。
1.4 指标检测
1.4.1 MTT法检测细胞活性 分别于培养12、24、48 h的各组细胞中加入20 μL MTT溶液,继续培养4 h。弃培养基后加入150 μL DMSO溶液,在酶标仪上于570 nm波长处测定各孔吸光度(A),并计算细胞活性。
1.4.2 细胞形态观察 于48 h收集各组细胞,于倒置相差显微镜下观察各组细胞形态及密度的变化。
1.4.3 荧光素酶报告基因实验检测miRNA-129-5p和Beclin1的结合活性 基于TargetScan数据库预测Beclin1与miR-129-5p的结合位点,将Beclin1中miR-129-5p结合位点的3′UTR的基因片段,插入psi CHECK2载体后构建Beclin1 3′UTR野生型质粒,同时利用基因位点突变构建Beclin1 3′UTR突变质粒后,采用RT-PCR验证。用WT质粒/MUT质粒和miR-129-5p mimics NC/miR-129-5p mimics分别对HUVEC细胞转染,48 h后提取细胞加入细胞裂解液,10 000×g离心5 min,取上清。参照双荧光素酶报告基因检测试剂盒说明分别检测海肾荧光素酶和萤火虫荧光素酶的活性,通过两者比值计算其相对荧光素酶活性。
1.4.4 RT-PCR法检测miRNA-129-5p及Beclin1 mRNA的表达 于48 h收集各组HUVEC细胞,分别采用相应的试剂盒提取细胞中总RNA或miRNA,核酸检测仪测定浓度,并在每个样本中取1 μg的RNA,通过逆转录进行cDNA的合成。在PCR条件下分别为85 ℃ 5 min,95 ℃ 30 s,40个周期60 ℃ 30 s,95 ℃ 5 s,以U6作为参照测定miR-129-5p表达水平,以GAPDH作为内参测定 Beclin1 mRNA 水平,用 2-ΔΔCt法计算样品中相应基因的表达水平的变化。各实验组均设置3个平行复孔,重复3次。引物序列见表1。

表1 RT-qPCR中的PCR反应引物
1.4.5 透射电镜观察细胞超微结构及自噬水平 于48 h收集各组细胞,PBS清洗,3%戊二醛和1%锇酸双重固定,梯度酒精、丙酮脱水,包埋,50 nm超薄切片。置于铜网以3%柠檬酸铅和醋酸双氧铀双重染色,透射电镜下观察细胞超微结构及自噬水平。
1.4.6 Western blotting检测Beclin1、LC3Ⅱ、LC3Ⅰ蛋白表达 于48 h收集各组HUVEC细胞,经PBS洗涤后加入RIPA裂解液冰上裂解30 min,离心收集上清,以BCA法测定蛋白浓度。取50 μg蛋白行聚丙烯酰胺凝胶电泳,分离蛋白后电转至聚偏二氟乙烯膜上,5%脱脂奶粉封闭1 h,加入稀释后的一抗:Beclin1(1∶1 000)、LC3(1∶1 000)和GAPDH(1∶1 000),4 ℃孵育过夜。加入稀释后的二抗,室温下孵育1 h。待ECL试剂盒显色后,以凝胶成像系统进行拍照。采用Image J对目的条带和GAPDH条带灰度值的比值进行处理,作为目的蛋白的相对表达量。
1.5 统计学处理
应用SPSS22.0统计软件。数据以()表示。多组间比较采用单因素方差分析检验,组间比较采用最小显著性差异法。P<0.05为差异具有统计学意义。
2 结 果
2.1 各组HUVEC细胞增殖情况比较
见表2。MTT检测结果显示,各组细胞12 h时OD值无明显差异。培养24、48 h后,模型组OD值明显低于空白组,差异均具有统计学意义(P<0.05);与模型组相比,SAEE能够显著促进HUVEC细胞的增殖,而miRNA-129-5p模拟剂显著抑制HUVEC细胞的增殖,差异均具有统计学意义(P<0.05),而SAEE+模拟剂组与模型组比较,OD值无明显差异(P>0.05)。
表2 各组细胞增殖情况比较(±s)
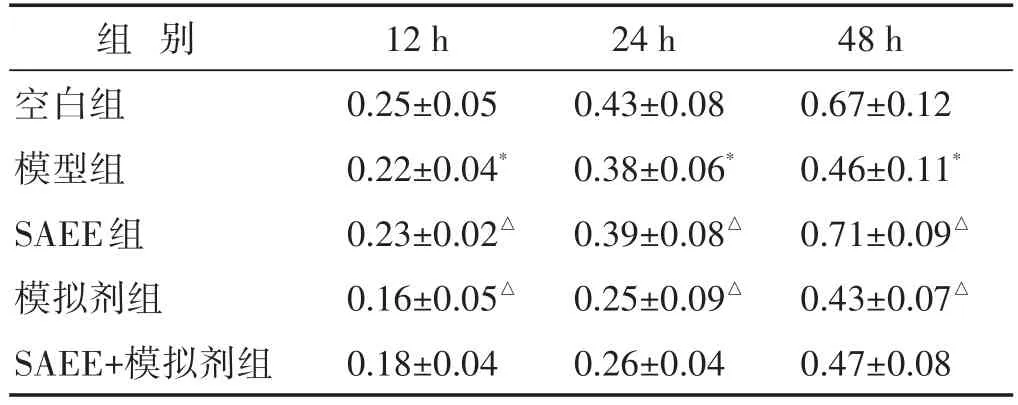
表2 各组细胞增殖情况比较(±s)
注:与空白组比较,*P<0.05;与模型组比较,△P<0.05。下同。
组别空白组模型组SAEE组模拟剂组SAEE+模拟剂组12 h 0.25±0.05 0.22±0.04*0.23±0.02△0.16±0.05△0.18±0.04 24 h 0.43±0.08 0.38±0.06*0.39±0.08△0.25±0.09△0.26±0.04 48 h 0.67±0.12 0.46±0.11*0.71±0.09△0.43±0.07△0.47±0.08
2.2 各组HUVEC细胞形态的比较
如图1所示,空白组HUVEC细胞发育良好,呈椭圆或梭形,边缘光滑,排列整齐。模型组细胞数量相比空白组明显减少,可见大量细胞碎片,细胞呈星形或长梭形,且排列紊乱。SAEE组细胞形态、密度与排列相比模型组显著改善,模拟剂组细胞损伤较模型组加重,SAEE+模拟剂组细胞形态及排列与模型组比较无明显改善。

图1 各组HUVEC细胞形态及密度的变化(100倍)
2.3各组miRNA-129-5p及Beclin1 mRNA表达的比较
双荧光素报告基因实验结果显示,共转染Beclin1-WT报告载体后,miRNA-129-5p mimic组的荧光素酶活性比miRNA-129-5p NC组明显降低,差异有统计学意义(P<0.05);而共转染Beclin1-MUT报告载体后,miRNA-129-5p mimic组荧光素酶活性与miRNA-129-5p NC组差异无统计学意义(P>0.05),这表明Beclin1与miRNA-129-5p存在特异性结合位点。见表3。与空白组相比,模型组miR-129-5p的表达水平无明显变化,差异无统计学意义(P>0.05)。与模型组相比,SAEE组miR-129-5p的表达水平显著下降,模拟剂组miR-129-5p的表达水平显著上升,差异均具有统计学意义(P<0.05),SAEE+模拟剂组miR-129-5p的表达水平与模型组无明显变化,差异无统计学意义(P>0.05)。而各组Beclin1 mRNA的表达无明显变化,差异无统计学意义(P>0.05)。见表4。
表3 各组miRNA-129-5p和Beclin1结合活性比较(±s)

表3 各组miRNA-129-5p和Beclin1结合活性比较(±s)
注:与miRNA-129-5p NC比较,*P<0.05。
?
表4 各组细胞中miRNA-129-5p及Beclin1 mRNA表达的比较(±s)

表4 各组细胞中miRNA-129-5p及Beclin1 mRNA表达的比较(±s)
?
2.4 各组HUVEC细胞超微结构及自噬水平的比较
透射电镜结果显示,空白组HUVEC细胞形态规整,细胞核大,可见少量自噬体和自噬溶酶体。模型组出现少量空泡,胞质变少,细胞核萎缩,可见自噬体数量增加和极少量自噬溶酶体。与模型组相比,SAEE组细胞形态明显改善,同时自噬体和自噬溶酶体数量明显增加,而模拟剂组细胞内空泡增多,胞质、细胞核萎缩情况加重,自噬体和自噬溶酶体数量明显减少。此外,SAEE+模拟剂组与模型组比较,细胞形态、自噬体和自噬溶酶体数量无明显变化。见图2。
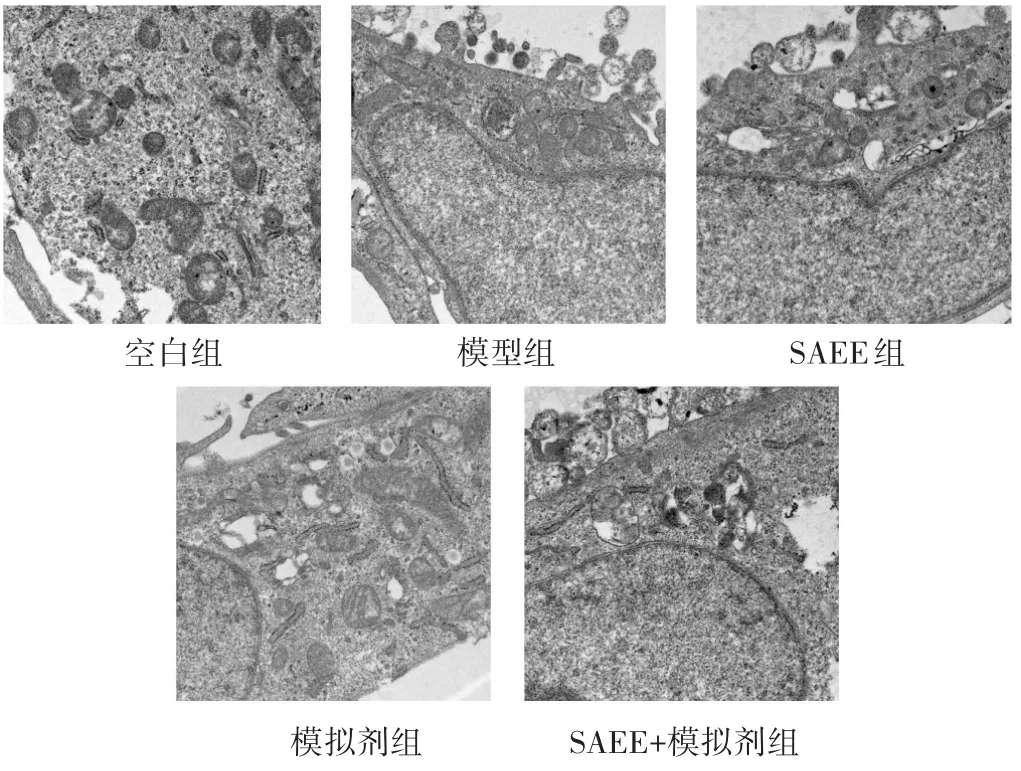
图2 各组HUVEC细胞超微结构及自噬水平的比较(5 000倍,3%柠檬酸铅+醋酸染色)
2.5 各组自噬相关蛋白表达的比较
见表5,图3。与空白组相比,模型组细胞中Beclin1蛋白和LC3Ⅱ/LC3Ⅰ的比值无明显变化,差异均无统计学意义(P>0.05);与模型组相比,SAEE组细胞中Beclin1蛋白和LC3Ⅱ/LC3Ⅰ的比值显著增加,模拟剂组中细胞中Beclin1蛋白和LC3Ⅱ/LC3Ⅰ的比值显著降低,差异均具有统计学意义(P<0.05)。而SAEE+模拟剂组与模型组比较,Beclin1蛋白和LC3Ⅱ/LC3Ⅰ的比值无明显改变,差异无统计学意义(P>0.05)。
表5 各组细胞中miR-129-5p/Beclin1通路中相关蛋白表达的比较(±s)

表5 各组细胞中miR-129-5p/Beclin1通路中相关蛋白表达的比较(±s)
组别空白组模型组SAEE组模拟剂组SAEE+模拟剂组Beclin1/GAPDH 0.82±0.11 0.85±0.09 1.24±0.12△0.59±0.05△0.79±0.15 LC3Ⅱ/LC3Ⅰ0.45±0.07 0.52±0.05 0.71±0.13△0.34±0.02△0.56±0.08

图3 各组细胞中自噬相关蛋白表达
3 讨论
内皮细胞损伤已被证实参与AS启动及进展的全过程,其可通过白细胞-内皮细胞黏附,继而造成动脉血管挛缩、血小板凝聚、氧化应激等病理变化[10]。动脉血管受到外界刺激后,可导致内皮细胞功能障碍,异常分泌ICAM-1和VCAM-1等黏附因子,造成游离单核细胞黏附于内皮细胞表面,逐渐聚集形成AS斑块。此外,大量凋亡的内皮细胞导致细胞数量急剧下降,造成内皮通透性发生改变并导致血管内膜损伤,而促进内皮细胞增殖可显著抑制AS斑块的形成[11-13]。
自噬作为细胞基础代谢过程,对基因的调控具有重要意义。研究发现内皮细胞自噬对AS具有保护作用[14]。当自噬功能受损,炎性反应被激活,可加速AS进展[15]。自噬作为一种自我防御及保护机制,能够有效清除受损细胞,降低内皮细胞凋亡及坏死[16]。此外,自噬能够增强内皮细胞抗氧化应激能力,抑制内皮细胞凋亡,延缓AS斑块形成。在自噬过程中,LC3前体经过处理变成可溶性LC3Ⅰ,再经过泛素样加工修饰为LC3Ⅱ,LC3Ⅱ在自噬泡形成和转运过程中,广泛存在于自噬体胞膜内,研究表明LC3Ⅱ的表达与自噬泡数量呈正比,可将LC3Ⅱ/LC3Ⅰ的比值作为观察细胞自噬强度的可靠指标[17]。
MiRNA在AS的进程中意义重大。作为内源表达非编码小分子RNA,其表达的改变会影响内皮细胞功能[18]。此外,内皮细胞的增殖、凋亡和迁移同样受到miRNA调控[19]。在诸多miRNA表达中,miR-129-5p与内皮细胞自噬关系密切,miR-129-5p过表达抑制细胞辐射诱导自噬[20]。本研究通过TargetScan网站预测发现Beclin1是miR-129-5p的潜在靶基因。Beclin1是自噬启动基因,能够参与诱导、生成及成熟全过程,具有直接或间接连接调控基因的作用,对内皮细胞自噬及凋亡的意义重大[21-22]。Beclin 1参与触发自噬体形成,与自噬表达程度呈正相关,因此成为衡量细胞自噬的常用指标之一[23]。研究发现miR-129-5p的上调是通过抑制Beclin1的蛋白翻译、抑制内皮细胞自噬、延缓AS的进展而实现的[24]。
本研究通过观察miR-129-5p与内皮细胞增殖、自噬的关系,探讨其抑制AS的作用机制。研究通过ox-LDL诱导构建内皮细胞损伤模型并MTT法检测细胞增殖发现12 h时,内皮细胞活性无显著性差异,随着时间的延长,SAEE能够显著促进细胞的增殖。RT-PCR结果发现,与模型组相比,SAEE组细胞中miR-129-5p的表达水平显著下降,而各组Beclin1 mRNA水平无明显变化,但是Beclin1蛋白的表达和LC3Ⅱ/LC3Ⅰ的比值显著增加,说明miR-129-5p是通过调控Beclin1转录后的翻译水平,达到促进细胞自噬的作用。
综上所述,SAEE可通过抑制miRNA-129-5p的表达促进Beclin1基因转录后翻译水平,进而促进内皮细胞自噬,发挥抗AS的作用。
