NtCPS2基因对顺-冷杉醇与赤霉素合成代谢途径的影响
2021-05-11贺凌霄李洪臣李芳芳颜培强远薛孙聚涛杨铁钊徐世晓
贺凌霄 何 雷 李洪臣 李芳芳 颜培强 姚 远薛 刚 孙聚涛 杨铁钊 徐世晓*
(1.河南农业大学 烟草学院,郑州 450002;2.中国烟草总公司 河南省公司,郑州450046;3.河南省烟草公司 三门峡市公司,河南 三门峡 472000;4.黑龙江省烟草公司 哈尔滨烟叶公司, 哈尔滨 150001)
顺-冷杉醇(cis-abienol)是大部分香料烟和部分雪茄烟叶片腺毛分泌物中特有的萜类香气前体物之一[1],由腺毛特异性启动子驱动柯巴基焦磷酸合酶(8-hydroxy-copalyl diphosphate synthase,CPS2)[2-5]而合成。Sallaud等[6]通过体外试验证明NtCPS2基因编码柯巴基焦磷酸合酶,参与赖百当类化合物前体物质8-羟基-柯巴基焦磷酸(8-α-hydroxy-copalyl-pyrophophate,8-OH-CPP)合成。与香料烟和雪茄烟不同,常规烤烟品种合成顺-冷杉醇,其香气风格会具有晾晒烟的特征,对卷烟香气产生负面影响,在一定程度上影响其工业可用性[7-8]。
在赖百当类合成途径中,牻牛儿基牻牛儿基焦磷酸(geranylgeranyl-PP,GGPP)通过折叠形成赖百当类烷骨架结构,在CPS2催化作用下形成8-OH-CPP;在顺-冷杉醇合成酶(cis-abienol synthase,ABS)和香紫苏醇合成酶(sclareol synthase,SCLS)催化作用下,8-OH-CPP分别合成顺-冷杉醇(cis-abienol)和赖百当烯二醇(labdene-diol)[9],见图1。
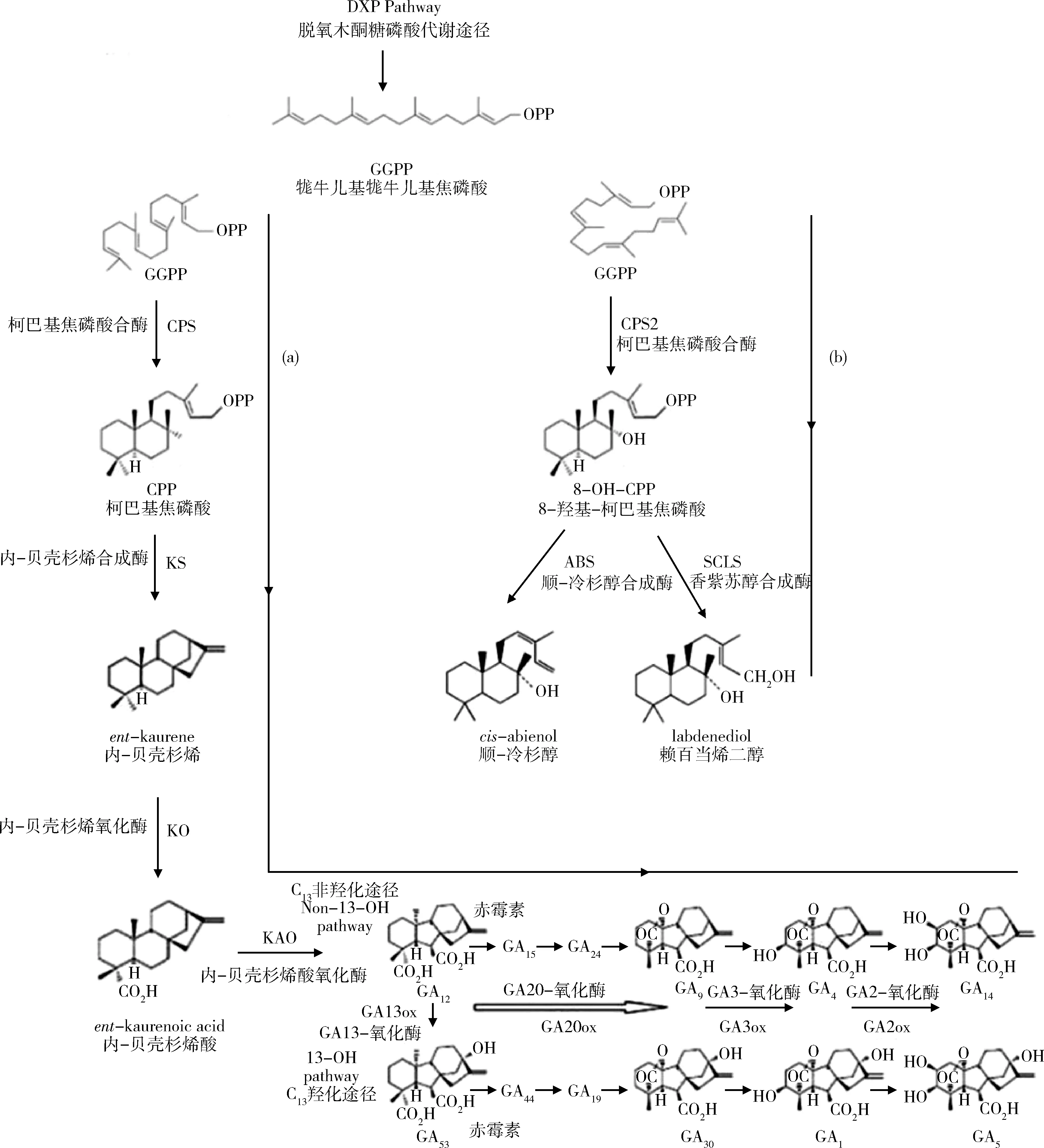
图1 烟草赤霉素(a)[10]和赖百当二萜(b)[1]合成途径Fig.1 Synthesis pathway of gibberellin (a)[10] and labdene diterpene (b)[1] in tobacco
赖百当类化合物合成的直接前体GGPP是萜类代谢的中间产物,其以丙酮酸、甘油醛-3-磷酸为原料由甲基赤藓醇-4-磷酸途径(methylerythritol-4-phosphate pathway, MEP)经多步反应后生成[11],后以不同于赖百当类合成的折叠方式形成赤霉素类烷骨架结构,在柯巴基焦磷酸合酶(ent-copalyl diphosphate synthase,CPS)、内-贝壳杉烯合成酶(ent-kaurene synthase,KS)催化作用下形成内-贝壳杉烯(ent-kaurene);在内-贝壳杉烯氧化酶(ent-kaurene oxidase,KO)、内-贝壳杉烯酸氧化酶(ent-kaurenoic acid oxidase,KAO)氧化作用下转化成GA12;再通过GA20-氧化酶 (GA20-oxidase,GA20ox)、GA2-氧化酶 (GA2-oxidase,GA2ox) 等合成具有生物活性的赤霉素[10,12-13],见图1。
目前,有关NtCPS2基因对顺-冷杉醇合成代谢途径的影响已有相关报道[1,6.8,15],但NtCPS2基因与赤霉素合成代谢关系的研究鲜见报道。本研究以河南农业大学自选烤烟品系‘8306’为材料[7],利用CRISPR/Cas9基因编辑技术对顺-冷杉醇合成基因NtCPS2进行编辑产生的突变植株[16],并筛选出纯合突变植株,比较纯合突变植株与野生型‘8306’在农艺性状,顺-冷杉醇和赤霉素含量及赤霉素合成关键基因的差异,旨在明确NtCPS2基因对顺-冷杉醇和赤霉素合成的调控方式,以期为萜类化合物对植物赤霉素合成反馈调节作用提供例证。
1 材料与方法
1.1 试验材料
试验材料为河南农业大学自选烤烟品系‘8306’野生型(WT)和利用CRISPR/Cas9技术对顺-冷杉醇合成基因NtCPS2进行编辑的‘8306’编辑系T2-26、T2-45和T2-48。
为得到去除顺-冷杉醇的‘8306’品系,‘8306’编辑系根据 cds 序列与基因组序列(NtCPS2,Genebank HE588139.1)在第 2 外显子区域设计 2 个 gRNA 靶位点序列,构建pRGEB32/Cas9-CPS2-gRNA 载体进行农杆菌介导的遗传转化,获得T0代阳性转化植株,对阳性植株NtCPS2基因进行测序表明,T0代共获得7株成功敲除植株,且突变均发生在靶点2上[16]。并在T1代中筛选出纯合‘8306’编辑系(T1-26、T1-45、T1-48)。本研究所用材料为‘8306’编辑系第二代纯合突变株系(T2-26、T2-45、T2-48)。
2018年3月1日播种, 5月1日移栽于河南省郑州市河南农业大学科教园。试验土壤是壤质潮土,各管理环节参考当地优质烟叶生产技术标准。当烟草中部叶叶长为1.5 cm时开始计算叶龄,于叶龄60 d时,每个品系挑选5株长势一致的烟株,每株取中部同位叶2片,沿主脉两侧截取4片直径为10 cm的叶圆片,每个品系取20片叶圆片,用于RNA提取和内源GA含量的测定。
1.2 试验方法
1.2.1编辑植株目标基因靶位点序列突变检测
用改进的CTAB法提取烟草基因组DNA。利用磨样机研磨样品T1-26、T1-45、T1-48,然后采用CTAB抽提缓冲液提取基因组DNA,DNA样品晾干后,加入ddH2O 100 μL备用。
设计引物17KN48-dF(5′→3′):ATCATAGCGGAATTGTTTGTCTC和17KN48-dR(5′→3′):TCCGTATAGATACCTAAGCGATCTG扩增目的条带并进行纯化,送至武汉天问生物科技有限公司测序。利用DANMAN 6.0 软件将测序结果与模板序列进行比对。扩增反应体系:2×PCR Mix 10 μL 上述引物各 0.3 μL,ddH2O 8.9 μL,烟草基因组DNA 0.5 μL。反应程序:94 ℃预变性5 min,32个循环(94 ℃ 30 s,56 ℃ 30 s,72 ℃ 40 s),72 ℃ 5 min,25 ℃ 1 min。上述PCR扩增产物,采用1%琼脂糖凝胶进行电泳检测。
1.2.2叶面分泌物二萜类物质(顺-冷杉醇)的测定
提取烟草叶片中的顺-冷杉醇参照陈伟等[17]的方法,通过NIST12检索谱库确定各类物质成分,并使用内标法对物质定量。
1.2.3农艺性状测量
每个品种(系)选择有代表性的5株,根据《烟草农艺性状调查测量方法(YC/T 142—2010)》[18]测定并记录株高和节距。
1.2.4内源赤霉素分析测试
采集各品种(系)中部叶片0.5 g,用液氮速冻后,存放于-80 ℃冰箱中保存,采用间接酶联免疫吸附法 (ELISA)[19](酶免疫试剂盒由中国农业大学化控中心提供)进行测定。
1.2.5GGPP分析测试
采集各品种(系)中部叶片0.5 g,用液氮速冻后,存放于-80 ℃冰箱中保存,采用间接酶联免疫吸附法 (ELISA)(上海润裕生物科技有限公司提供)进行测定。
1.2.6烟草叶片总RNA的提取
采用Plant RNA isolation Aid提取供试材料叶片总RNA,于-80 ℃保存。逆转录:利用HiScript II Q RT SuperMix for qPCR(+gDNA wiper)(Vazyme,R223-01)将待测RNA逆转录成cDNA,储存在-20 ℃冰箱备用。
引物设计采用Roche LCPDS2软件(表1)并由上海捷瑞生物工程有限公司合成。荧光定量PCR利用ChamQ SYBR qPCR Master Mix试剂盒(Q311-03,Vazyme)在LightCycler®480 Ⅱ型荧光定量PCR仪(Roche,Swiss)上进行反应。反应体系:2×ChamQ SYBR qPCR Master Mix 5.0 μL,引物各0.2 μL,cDNA 1.0 μL,Nuclease-free H2O 3.6 μL。PCR程序:95 ℃ 30 s;95 ℃ 10 s,60 ℃ 30 s,40个循环。通过2-ΔΔCt法计算基因相对表达量并作图。

表1 荧光定量引物序列(5′→3′)Table 1 Sequences of fluorescence quantitative primers (5′→3′)
2 结果与分析
2.1 编辑植株靶位点序列突变的差异分析
由图2可知,对‘8306’编辑系PCR扩增检测结果显示,扩增产物大小约468 bp。测序表明在NtCPS2基因开放阅读框第239位置插入单个碱基,其中T1-26和T1-45 插入单个T碱基,T1-48插入单个A碱基(图3)。测序结果利用解码网站http:∥skl.scau.edu.cn/dsdecode/进行分析,确定T1-26、T1-45、T1-48均为纯合型碱基插入。
2.2 不同编辑株系的顺-冷杉醇含量及合成关键基因表达量
由图4可知,在‘8306’不同的编辑系中,顺-冷杉醇含量较WT均显著降低。不同株系中冷杉醇含量由高到低为,WT>T2-45>T2-26>T2-48。
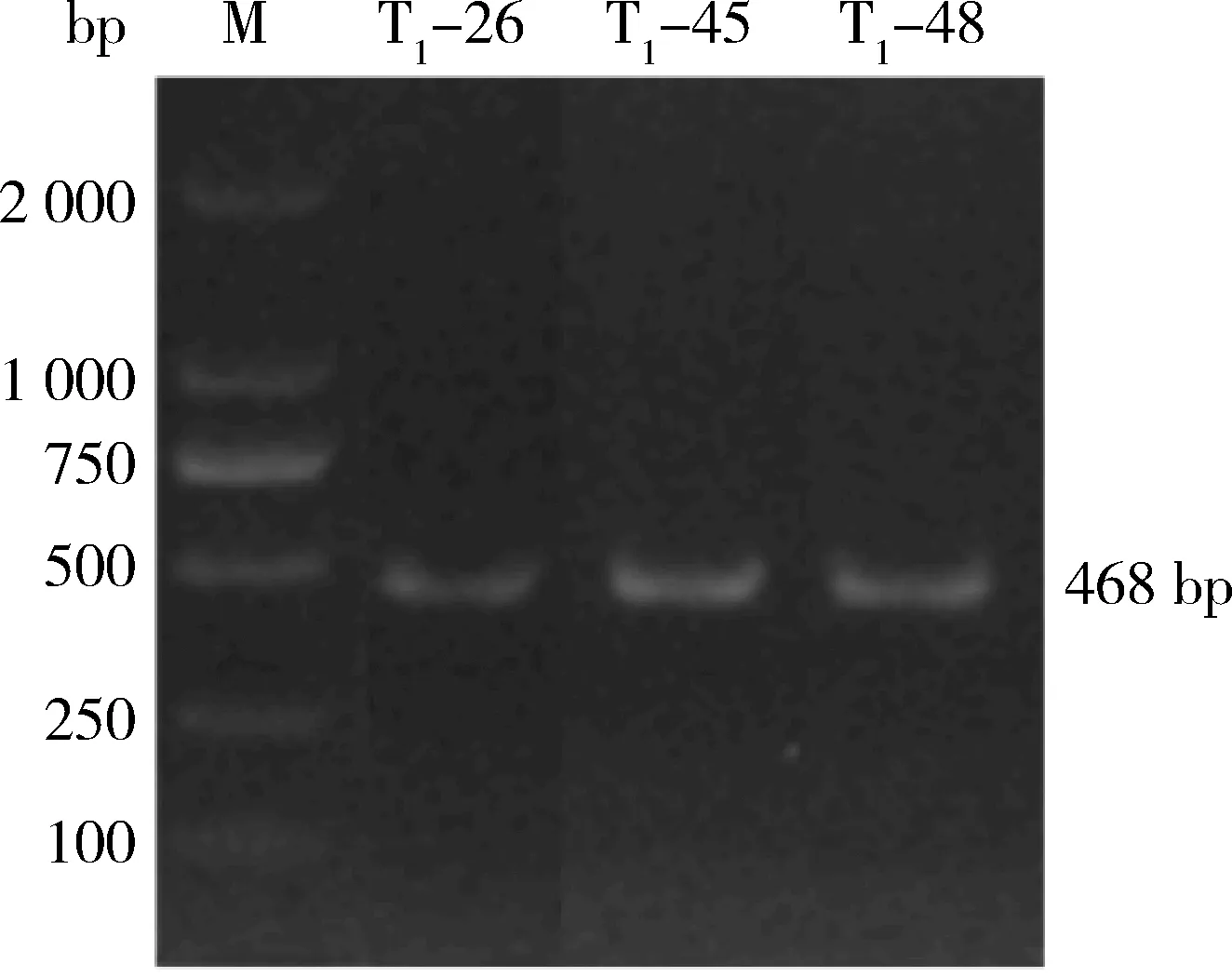
M,DNA Marker;T1-26、T1-45、T1-48,‘8306’编辑系纯合突变植株。下同。M, DNA Marker; T1-26, T1-45, T1-48 and‘8306’editing series homozygous mutant plants. The same below.图2 3个烟草‘8306’基因编辑株系的PCR检测结果Fig.2 PCR detection among 3 gene editing series of tobacco ‘8306’
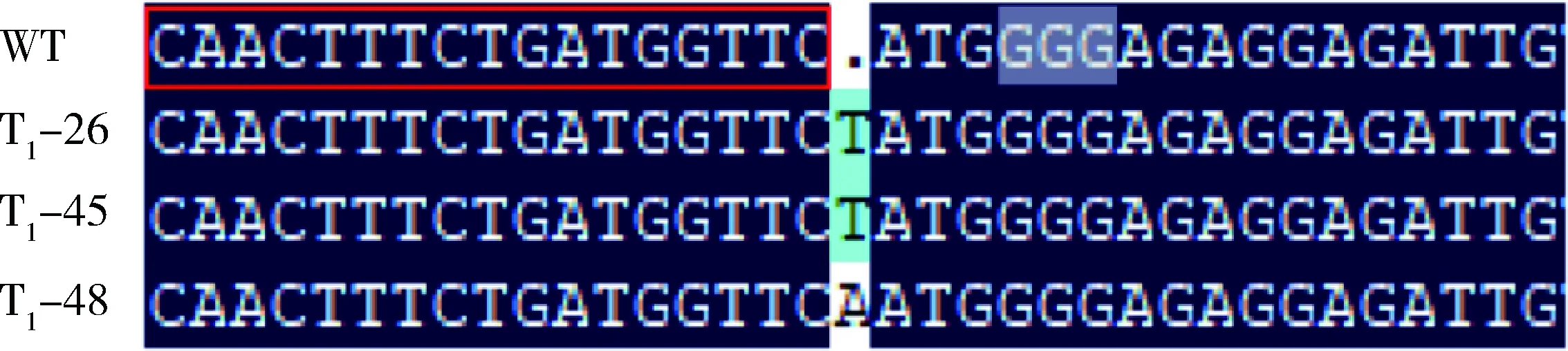
红色方框中是gRNA靶序列;阴影框中的GGG为PAM序列;A/T表示碱基突变位点。The red box represents the gRNA target sequence; GGG stands for PAM sequence in shadow box; A/T is for base insertion.图3 3个烟草‘8306’基因编辑株系的PCR产物测序结果Fig.3 Sequencing results for PCR products among 3 gene editing series of tobacco ‘8306’
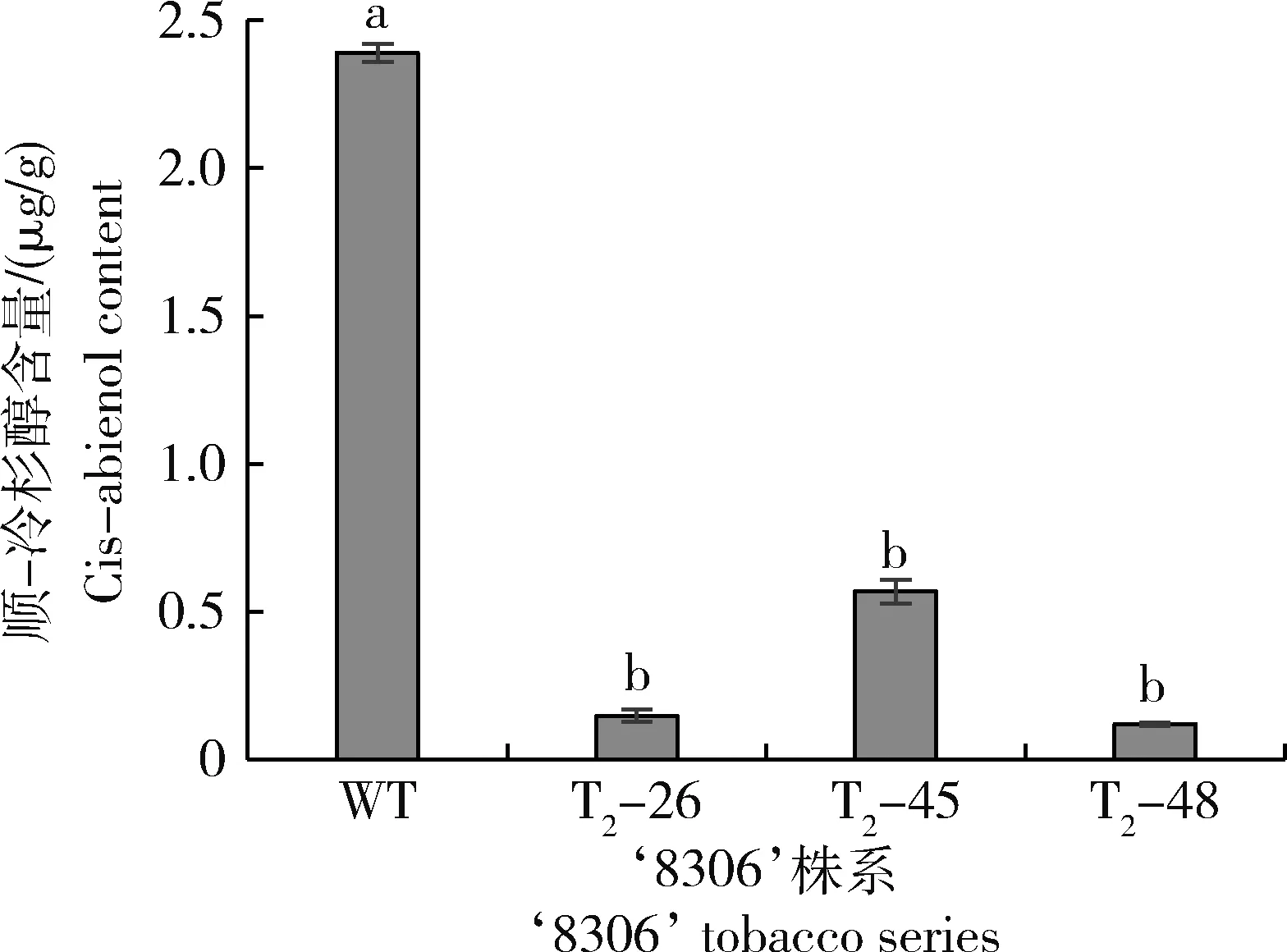
柱中不同小写字母表示P<0.05水平差异显著。下同。Different lowercase letters in the column indicate significant difference in P<0.05. The same below.图4 3个烟草‘8306’基因编辑株系的顺-冷杉醇含量Fig.4 Cis-abienol content among 3 gene editing series of tobacco ‘8306’
‘8306’编辑系的NtCPS2相对含量较WT显著降低(图5),同顺-冷杉醇含量变化趋势一致。
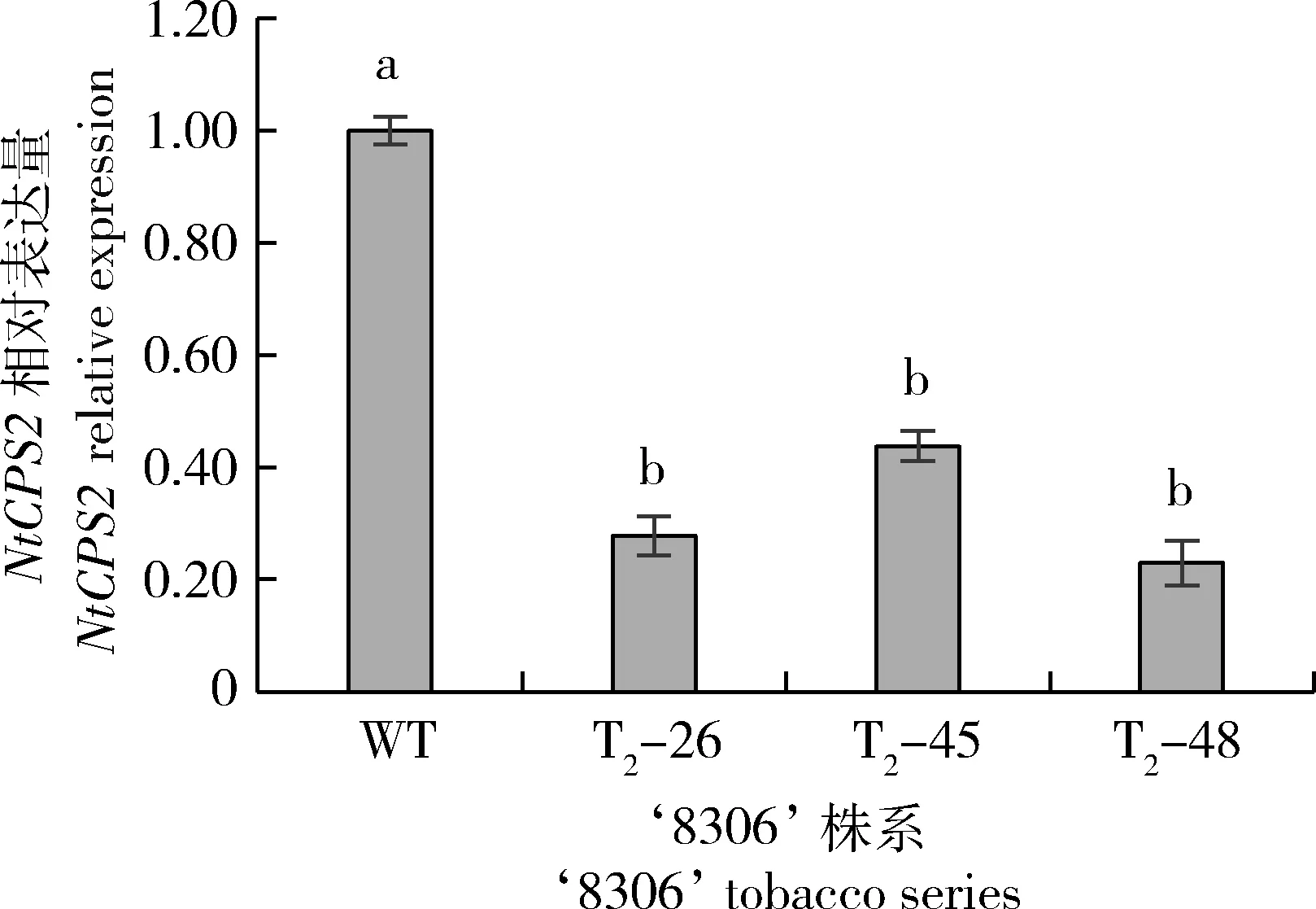
图5 3个烟草‘8306’基因编辑株系顺-冷杉醇合成关键基因的表达Fig.5 Key genes expression differences for cis-abienol among 3 gene editing series of tobacco ‘8306’
2.3 不同编辑株系的内源赤霉素含量
由图6可知,与野生型相比,各编辑株系内源赤霉素含量显著增加,且编辑株系间差异显著,以T2-45 的含量最高,即T2-45>T2-26>T2-48>WT。表明在‘8306’编辑顺-冷杉醇控制基因NtCPS2后内源赤霉素含量显著升高。
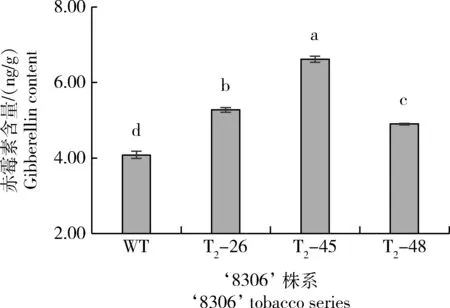
图6 3个烟草‘8306’基因编辑株系内源赤霉素含量Fig.6 Endogenous gibberellin content among 3 gene editing series of tobacco ‘8306’
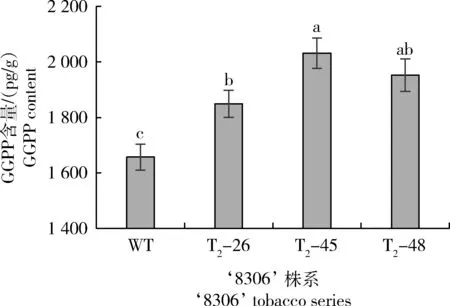
图7 3个烟草‘8306’基因编辑株系的GGPP含量Fig.7 GGPP content among 3 gene editing series of tobacco ‘8306’
2.4 不同编辑株系的牻牛儿基牻牛儿基焦磷酸(GGPP)含量
由图7可知,在‘8306’编辑顺-冷杉醇控制基因NtCPS2后GGPP含量较未编辑植株WT(‘8306’)均显著增加,编辑系间T2-45的GGPP含量最高,显著高于T2-26。
2.5 ‘8306’编辑系赤霉素合成关键基因的表达分析
由图8可知,与野生型相比,各编辑株系CPS和KAO基因相对表达量显著升高,GA2ox显著降低,T2-26、T2-45的DXR基因相对表达量与对照相比显著升高,T2-45和T2-48的GA20ox基因相对表达量与对照相比显著升高,T2-45的KO基因相对表达量与对照相比显著升高;编辑株系间,除KAO外,各基因相对表达量差异均不显著。
2.6 ‘8306’编辑系的农艺性状
从图9和图10可以看出,与WT相比,‘8306’各编辑株系的株高和节距均显著增加,编辑株系间差异不显著,表明编辑顺-冷杉醇控制基因NtCPS2可以显著提高‘8306’各编辑株系烟株的高度,增加烟株节距。
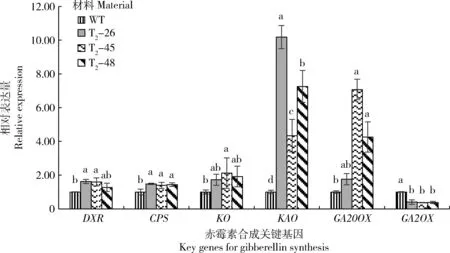
图8 3个烟草‘8306’基因编辑株系赤霉素合成关键基因的表达Fig.8 Key genes expression gibberellin among 3 gene editing series of tobacco ‘8306’
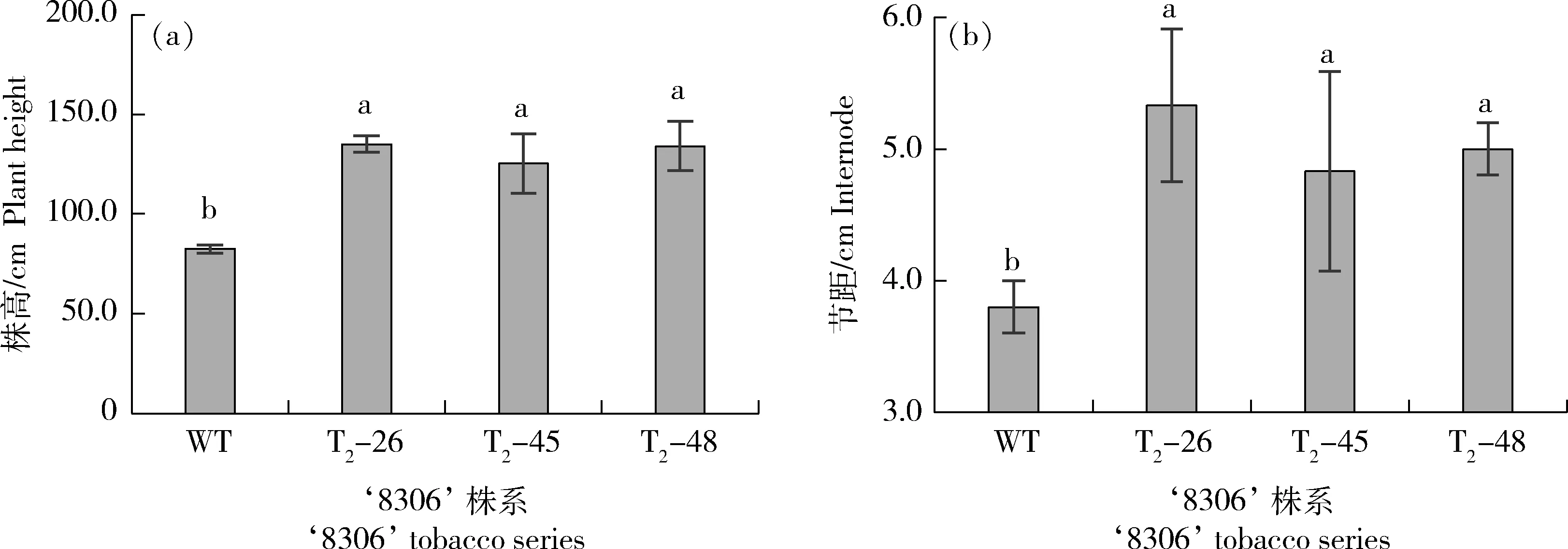
图9 烟草野生型与3个‘8306’基因编辑株系的株高(a)和节距(b)Fig.9 Plant height (a) and internode (b) between tobacco wild-type and 3 gene editing series of tobacco ‘8306’

图10 叶龄15 d烟草野生型与3个‘8306’基因编辑株系的株高Fig.10 Plant height between tobacco wild-type and 3 gene editing series of tobacco ‘8306’ with 15 d leaf-age
3 讨 论
本研究通过编辑NtCPS2基因使‘8306’的顺-冷杉醇含量降低71.01%~94.67%,赤霉素含量增加16.68%~38.27%。赤霉素合成途径中正调控关键基因GA20ox表达量显著增加,负调控关键基因GA2ox表达量显著减小,并且GGPP合成的关键基因DXR表达量提高,GGPP含量增加显著。
已有研究表明烟草中顺-冷杉醇的含量与NtCPS2基因表达量呈正相关,王国平[1]、常爱霞[15]和李艳华等[8]发现在特香型烤烟品种 ‘大白筋599’、‘革新三号’和‘豫烟11号’中顺-冷杉醇含量较高的同时NtCPS2基因表达量也显著高于其他品种。Sallaud等[6]在不含顺-冷杉醇的林烟草中进行了NtCPS2和NtABS转基因试验,结果发现NtCPS2通过催化GGPP形成8-OH-CPP,NtABS利用8-OH-CPP为底物合成顺-冷杉醇(图1(b))。本研究编辑NtCPS2基因抑制了柯巴基焦磷酸合酶的合成,减少顺-冷杉醇直接前体物质8-OH-CPP的含量从而降低烟草叶片中顺-冷杉醇的含量(图11)。
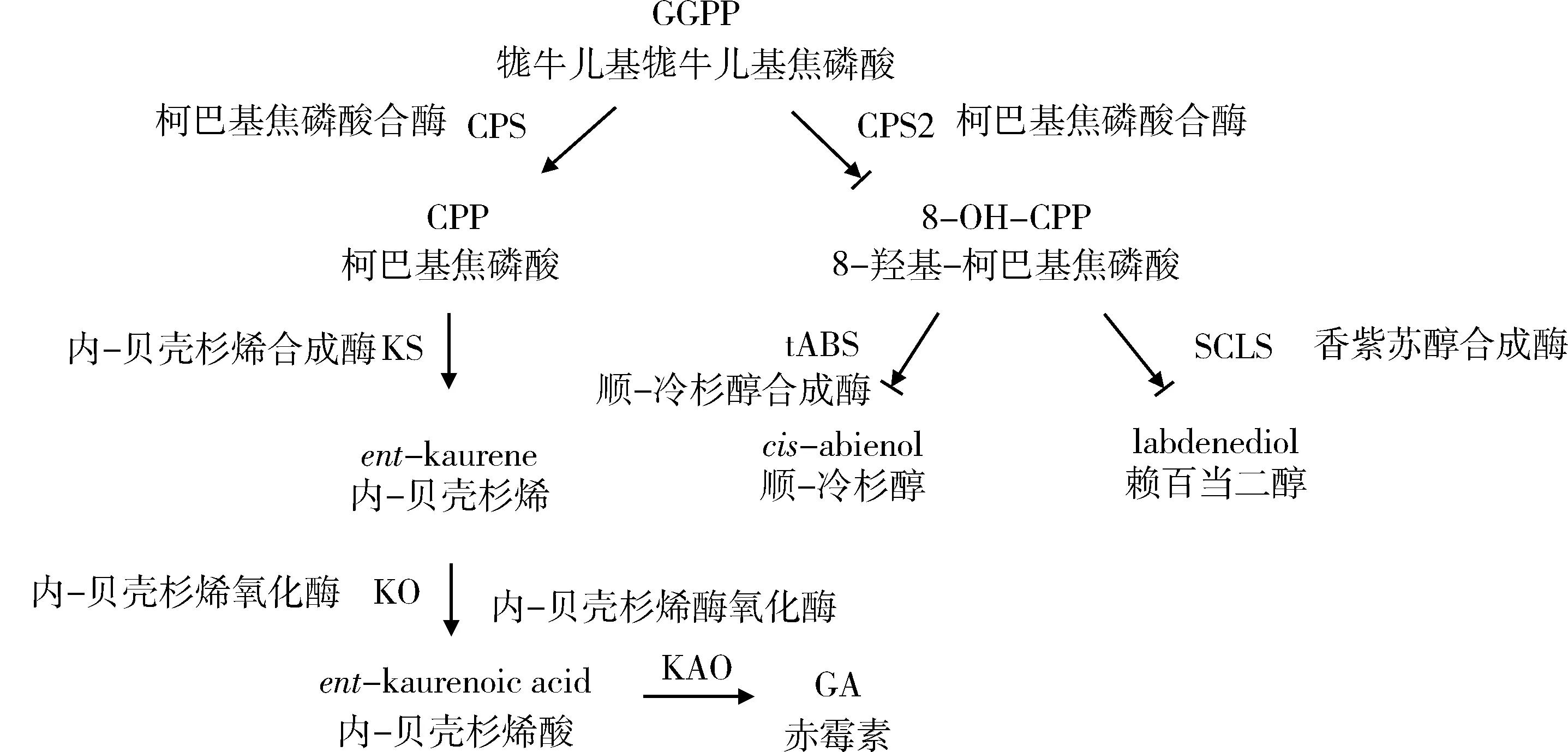
图11 3个烟草‘8306’基因编辑株系赤霉素[10]和赖百当二萜[1]合成途径Fig.11 Synthesis pathway of gibberellin[10] and labdene diterpene[1] in 3 gene editing series of tobacco ‘8306’
本研究发现编辑NtCPS2基因后,生成甲基赤藓醇-4-磷酸 (MEP)的关键基因DXR的表达量显著升高[20],说明编辑NtCPS2基因可以减少赖百当的合成对萜类代谢中间产物GGPP的竞争,促使CPS、KAO显著升高和GA2ox显著降低,从而促进C20类赤霉素转化为C19类赤霉素[21],并抑制植株中具有生物活性的GA1和GA4转化为无活性的GA8和GA34[22],进而增加具有生物活性的赤霉素含量[23],使得‘8306’编辑系的株高和节距显著增加。
已有研究证明植物激素茉莉酸和赤霉素等可以提高腺毛分泌物中萜类物质的含量,Sui等[24]发现茉莉酸可以通过提高CBTS和P450的表达量来提高西柏三烯二醇的含量。Traw等[25]和Maes等[26]研究证实赤霉素与茉莉酸协同调控可提高青蒿素含量。但腺毛分泌的萜类化合物对植物激素反馈调节作用的研究较少。
已有研究发现与类胡萝卜素积累相关的基因Or(Orange)发生突变后,在突变体中Or基因通过某种方式下调CPS基因的表达从而导致活性赤霉素含量的降低[27-28]。Fraser等[29]通过反义RNA技术抑制八氢番茄红素合成酶(phytoene synthase, PSY)基因PSY的表达,导致番茄中类胡萝卜素含量较野生型减少14倍,转基因株系中与类胡萝卜素合成共用相同底物的物质—赤霉素的含量提高3~5倍。NtCPS2基因与PSY一类,均是萜烯合成酶(terpene synthases, TPSs)的关键基因,编辑NtCPS2基因后,也对赤霉素合成途径中的TPSs细胞色素P450单加氧酶(cytochrome P450 monooxygenases, P450 s)和2-酮戊二酸依赖的双加氧酶(2-oxoglutarate-dependent dioxygenases, 2ODDs)相关合成基因CPS、KO、KAO、GA20ox和GA2ox产生影响。降低NtCPS2基因表达量可能减少对萜类代谢中间产物GGPP的竞争,并且促使了DXR基因表达量的增加,从而增加了赤霉素合成前体物质GGPP的含量,同时影响赤霉素合成途径中相关基因,进而提高赤霉素含量。
4 结 论
本研究发现利用CRISPR/Cas9基因组编辑技术对烤烟‘8306’的顺-冷杉醇合成关键基因NtCPS2编辑,降低了顺-冷杉醇的含量,影响赤霉素合成途径中DXR、GA20ox、GA2ox等基因的表达量,显著增加烟草叶片内的赤霉素合成前体物质GGPP的含量,萜类化合物对植物赤霉素合成起反馈调节作用。
