基于同步荧光光谱的鸡肉中甲磺酸达氟沙星和氧氟沙星残留快速检测方法研究
2021-05-11黄俊仕刘木华袁海超黄双根赵进辉
陈 健,黄俊仕,2,刘木华,2,袁海超,2,黄双根,2,赵进辉,2*,徐 宁,王 婷,胡 围
1.江西农业大学,江西省现代农业装备重点实验室,江西 南昌 330045 2.江西农业大学,江西省果蔬采后处理关键技术及质量安全协同创新中心,江西 南昌 330045
引 言
喹诺酮类抗生素(Quinolones)是一类人工合成的广谱抗生素,在家禽饲养和疾病的防治中被广泛应用[1]。我国的家禽养殖向着规模化、集约化方向发展,抗生素发挥着越来越重要的作用,但抗生素的不规范、不合理使用导致禽肉抗生素残留的问题也日趋严重[2]。甲磺酸达氟沙星(danofloxacin mesylate,DFM)和氧氟沙星(ofloxacin,OFL)是常用的喹诺酮类抗生素,其残留进入人体可能引起癌症、基因突变等[3]。因此,建立一种快速、经济的鸡肉中DFM和OFL残留的检测方法是一项十分有意义的工作。基于对消费者安全的考虑,农业农村部限定了鸡肉中喹诺酮类抗生素的最大残留限量,其中达氟沙星的最大残留限量为200 μg·kg-1,OFL被禁用[4-5]。
目前,液相色谱法[6-7]、液相色谱和质谱联用法[8-9]等方法可用于鸡肉中喹诺酮类抗生素残留的检测,这些方法虽然有较高的灵敏度,但仪器昂贵、运行成本高且需要较高的操作水平[10]。同步荧光技术同时扫描激发和发射单色器波长,同时利用了化合物的吸收特性和发射特性,具有简化光谱、窄化谱带、减弱背景干扰和降低散射光等优点[11]。近年来,李月秋等[12]应用同步荧光技术检测猪肉中头孢噻呋抗生素的残留量,蔡其洪等[13]应用同步荧光技术检测火腿肠、猪肉、鱼肉、鸭肉和鸡肉中氟罗沙星抗生素的残留量。本研究以鸡肉为载体,DFM和OFL抗生素为研究对象,应用同步荧光技术尝试建立一种鸡肉中DFM和OFL残留快速检测的方法。
1 实验部分
1.1 仪器与试剂
荧光分光光度计(Cary Eclipse,美国瓦里安);电子天平(FA1004B,上海上平仪器有限公司);纯水机(全自动RO,湖南科尔顿水务有限公司);超声波清洗器(JK-50B,合肥金尼克机械有限公司);漩涡混合器(VORTEX-5,海门市其林贝尔仪器有限公司);振荡器(KJ-201BS,江苏康健医疗用品有限公司);低速离心机(JW-1024,安徽嘉文仪器装备有限公司);组织捣碎匀浆机(JJ-2B,江苏省金南仪器厂);石英比色皿(1 cm光程,宜兴市晨伟玻璃仪器厂)。
鸡胸肉(南昌市某大型超市);DFM和OFL(≥98%,上海源叶生物科技有限公司);乙腈、甲酸和氢氧化钠(分析纯,西陇科学股份有限公司);十二烷基硫酸钠(分析纯,SDS,金克隆北京生物技术有限公司);溴代十六烷基三甲胺(分析纯,CTAB,金克隆北京生物技术有限公司);壬基酚聚氧乙烯醚系列(7)醚(分析纯,NP-7,上海麦克林生化科技有限公司);有机相针式滤器(0.45 μm,上海安谱实验科技股份有限公司)。
1.2 样品制备
(1)抗生素储备液的配制:取5.0 mg的DFM(或OFL)标准品溶于50 mL超纯水,可得到100 mg·L-1DFM(或100 mg·L-1OFL)储备液,于4 ℃下储存。
(2)抗生素工作液的配制:取0.15 mL的DFM(或OFL)储备液,用超纯水稀释至15 mL得到1.0 mg·L-1DFM(或OFL)工作液,于4 ℃下储存。
(3)根据文献[14]中的快速溶剂萃取法提取空白鸡肉,略作修改,具体如下:称取均质的鸡胸肉1.0 g,置于10 mL离心管中,加入2%甲酸-乙腈溶液4 mL,涡旋1 min,然后,于离心机上以4 000 r·min-1的速率离心5 min,将上清液移入另一个10 mL离心管中,将离心残渣用4 mL 2%甲酸-乙腈溶液再提取一次,合并上清液,混匀,过0.45 μm滤膜,用2%甲酸-乙腈定容至10 mL,得到空白鸡肉提取液。
(4)根据文献[14]中的快速溶剂萃取法提取鸡肉中DFM和OFL的残留,略作修改,具体如下:①加标鸡肉的制备:称取均质的鸡胸肉1.0 g,置于10 mL离心管中,分别添加0.01,0.04,0.08,0.10,0.12,0.16,0.20,0.24,0.28,0.32,0.36,0.40和0.44 mL 的DFM储备液和0.01,0.04,0.08,0.10,0.12,0.16,0.20,0.24,0.28,0.32,0.36,0.40和0.44 mL的OFL储备液,两者浓度随机组合,涡旋1 min。②鸡肉中抗生素的提取:再加入2%甲酸-乙腈溶液4 mL,涡旋1 min,然后,于离心机上以4 000 r·min-1的速率离心5 min,将上清液移入另一个10 mL离心管中,将离心残渣用4 mL 2%甲酸-乙腈溶液再提取一次,合并上清液,混匀,过0.45 μm滤膜,用2%甲酸-乙腈定容至10 mL。得到含DFM和OFL的鸡肉提取液:DFM浓度为0.1,0.4,0.8,1.0,1.2,1.6,2.0,2.4,2.8,3.2,3.6,4.0和4.4 mg·L-1(分别对应于鸡肉中含有1.0,4.0,8.0,10.0,12.0,16.0,20.0,24.0,28.0,32.0,36.0,40.0和44.0 mg·kg-1DFM),OFL浓度为0.1,0.4,0.8,1.0,1.2,1.6,2.0,2.4,2.8,3.2,3.6,4.0和4.4 mg·L-1(分别对应于鸡肉中含有1.0,4.0,8.0,10.0,12.0,16.0,20.0,24.0,28.0,32.0,36.0,40.0和44.0 mg·kg-1OFL)。
1.3 标准溶液以及鸡肉提取液的同步荧光光谱的采集
为了采集标准溶液以及鸡肉提取液的同步荧光光谱,分别取500 μL DFM标准溶液(1.0 mg·L-1)、OFL标准溶液(1.0 mg·L-1)、空白鸡肉提取液和含DFM和OFL的鸡肉提取液(1.0 mg·kg-1DFM,1.0 mg·kg-1OFL)于不同的石英比色皿中,再先后加入130 μL SDS缓冲液(0.1 mol·L-1),670 μL氢氧化钠溶液(0.1 mol·L-1),采集波长差Δλ=130和200 nm处的同步荧光光谱。
1.4 定性试验设计方案
(1)为了探究不同氢氧化钠溶液浓度对同步荧光强度的影响,向石英比色皿中依次加入500 μL含DFM和OFL的鸡肉提取液(1.0 mg·kg-1DFM,1.0 mg·kg-1OFL),130 μL SDS溶液(0.1 mol·L-1),670 μL氢氧化钠溶液(0.001,0.01,0.1,0.2,0.3和0.4 mol·L-1),设置5个平行组,采集Δλ=130和200 nm处的同步荧光光谱。
(2)为了探究不同表面活性剂对同步荧光强度的影响,向石英比色皿中依次加入500 μL含DFM和OFL的鸡肉提取液(1.0 mg·kg-1DFM,1.0 mg·kg-1OFL),130 μL CTAB表面活性剂(0.019 mol·L-1)或SDS表面活性剂溶液(0.1 mol·L-1)或NP-7表面活性剂(5.33 mmol·L-1),670 μL氢氧化钠溶液(0.1 mol·L-1),设置5个平行组,采集Δλ=130和200 nm处的同步荧光光谱。
1.5 定量试验设计方案
向石英比色皿中依次分别加入500 μL的含不同浓度DFM和OFL的鸡肉提取液,130 μL SDS溶液(0.1 mol·L-1),670 μL氢氧化钠溶液(0.1 mol·L-1),设置5个平行组,采集Δλ=130和200 nm处的同步荧光光谱。
1.6 荧光光谱仪参数设置
荧光光谱仪参数设置如下:激发波长扫描范围为240~450 nm,激发、发射狭缝宽度均为5 nm,PMT电压为700 V。
1.7 数据处理方法

2 结果与讨论
2.1 标准溶液以及鸡肉提取液的同步荧光光谱
DFM和OFL具有相似的化学结构,进而有类似的荧光特性。为了实现辨别的目的,须要找到合适的Δλ。图1给出了DFM和OFL标准溶液的同步荧光光谱图,从中看出,DFM和OFL荧光光谱有明显区别,在Δλ=130 nm时,可由282 nm处宽谱峰辨别出DFM。在Δλ=200 nm时,可由318 nm处宽谱峰辨别出OFL。图2给出了鸡肉提取液的同步荧光光谱图。从中看出,鸡肉中DFM和OFL的荧光激发峰相对标准溶液中DFM和OFL的荧光激发峰发生红移现象。含DFM和OFL的鸡肉提取液在Δλ=130 nm处有位于288 nm处DFM的荧光激发峰,在Δλ=200 nm处有位于325 nm处OFL的荧光激发峰,而空白鸡肉提取液在这些位置处未出现宽谱峰。综上所述,鸡肉中DFM和OFL残留可通过Δλ/激发波长130/288 nm和200/325 nm实现同时检测。
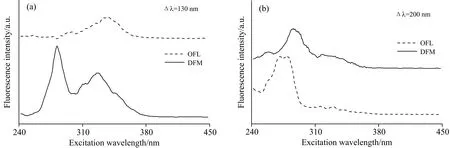
图1 DFM和OFL标准溶液的同步荧光光谱图Fig.1 Synchronous fluorescence spectra of DFM and OFL standard solutions
2.2 同步荧光光谱检测条件优化
由图3(a)可知,随着氢氧化钠溶液浓度增加,DFM的荧光强度呈先增强,后减弱的趋势。对于OFL而言,荧光强度也呈先增强,后减弱的趋势。产生荧光强度变化的原因可能是氢氧化钠溶液浓度的增加,体系pH会升高,进而影响了DFM和OFL的质子离解平衡[15],影响了它们的荧光强度。在氢氧化钠溶液浓度为0.1 mol·L-1时,DFM和OFL的荧光强度最大。因此,0.1 mol·L-1为氢氧化钠溶液最佳的加入浓度。
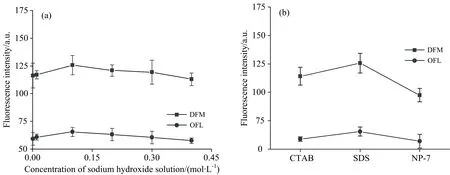
图3 不同条件对荧光强度的影响(a):氢氧化钠溶液浓度;(b):表面活性剂Fig.3 Effects of difference conditions on the fluorescence intensities(a):Concentration of sodium hydroxide solution;(b):Surfactants
表面活性剂具有荧光增敏的效果,被广泛应用于荧光检测。表面活性剂达到临界胶束浓度时能形成胶束,使DFM和OFL分子处于有序的微环境,减少了分子间的碰撞概率[16]。在本试验中SDS在体系中浓度为10.0 mmol·L-1,大于其临界胶束浓度8.0 mmol·L-1[17]。由图3(b)可知,在加入SDS表面活性剂时,DFM络合物的荧光强度最大。另一方面,在加入SDS表面活性剂时,OFL络合物的荧光强度最大。因此,选用SDS表面活性剂。
2.3 主成分分析
PCA是一种经典的多元统计分析技术,其中心目的是将光谱的数据降维。表1给出了前4个主成分的方差贡献率和累计方差贡献率。从中可见,DFM和OFL前3个主成分的累计方差贡献率均达到了90%。随着主成分数增大,其方差贡献率逐渐减小。通常主成分数大于90%的累计方差贡献率就能代表原始变量的大部分信息[18]。因此,选择前3个主成分进行PLSR和MLR分析。

表1 前4个主成分的方差贡献率和累计方差贡献率Table 1 Variance contribution rate and cumulative variance contribution rate for the first four principal component
2.4 预测模型的建立和预测结果的分析
含DFM和OFL的鸡肉提取液样本共13个,随机选取7个样本作为训练集,以建立预测模型,剩余6个作为预测集,以分析模型预测结果,预测集的数据都落在训练集的范围之内,如表2所示。

表2 鸡肉中DFM和OFL残留的样本统计结果Table 2 Statistical results of samples of DFM and OFL residues in chicken
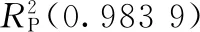

表3 鸡肉中DFM和OFL残留的模型预测统计结果Table 3 Statistical results of prediction model of DFM and OFL residues in chicken
综合上述的信息得出基于PLSR的DFM残留预测模型和基于MLR的OFL残留预测模型的综合评价更好,因此本试验分别用PLSR和MLR算法建立鸡肉中DFM和OFL残留的预测模型,检测鸡肉中DFM和OFL残留的检出限均可达1.0 mg·kg-1,并绘制了鸡肉中DFM和OFL残留的样本关系图(见图4)。本方法能够满足鸡肉中DFM和OFL残留快速同时检测要求,对后续研究具有一定的参考价值。

图4 鸡肉中DFM和OFL残留的样本关系图Fig.4 Plots of the relationship between the actual and predicted values of DFM and OFL residues in chicken for the training and prediction samples
3 结 论
采用同步荧光技术结合化学计量学方法,建立了鸡肉中DFM和OFL残留快速检测的方法。试验结果表明,采用同步荧光技术可有效的分辨出鸡肉提取液、DFM和OFL的荧光特征峰,使鸡肉中DFM和OFL残留被同时检测,简化了检测步骤,为鸡肉中抗生素残留的快速检测提供技术支持。
