补肾化瘀泄浊方通过调控细胞外调节蛋白激酶信号通路阻抑人肾小管上皮细胞间充质转化的机制研究
2021-05-11袁雅琪朱晓琳殷立平尹文雁凌淑洵高雪琴
袁雅琪 朱晓琳 殷立平 尹文雁 凌淑洵 高雪琴 李 立
(南京中医药大学第二附属医院肾内科,江苏南京210017)
慢性肾脏病(CKD)是全世界范围内严重威胁人类健康的公共卫生难题。引起CKD的多种因素会诱导致纤维化因子和致炎因子产生增加,进而通过多种途径引起肾脏组织结构变化,表现为细胞极性消失、骨架重塑、迁移和侵袭性增强,上皮组织消失,成纤维细胞、炎症细胞聚集,细胞外基质沉积,发生纤维化,最终造成肾功能进行性丧失[1]。大量研究表明,在肾脏纤维化的发生发展中,肾小管上皮细胞的上皮间充质转化(EMT)扮演着极其重要的角色,即使在CKD早期也可检测到上皮、间质标志物的相互转变[2-3]。
转化生长因子β(TGF-β)被公认为最重要的EMT正向调节因子,在诱导肾小管上皮细胞EMT中扮演了极其重要的角色[4]。Smad信号能够介导一系列的分子事件,而这些事件是EMT进程所必需的。TGF-β/Smad通路是诱导EMT的经典信号通路[5],而Wnt、细胞外调节蛋白激酶(ERK)等多种信号通路常常与其发生交叉对话。补肾化瘀泄浊方是南京中医药大学第二附属医院肾脏科在长期临床用药过程中的经验方,对缓解CKD的进展具有较好的临床疗效。本研究拟探讨补肾化瘀泄浊方在人肾小管上皮细胞(HK-2)EMT中的作用及其干预机制,为其临床使用提供理论依据。
1 实验材料
1.1 实验细胞HK-2细胞株购自中国科学院典型培养物保藏委员会细胞库。
1.2 药物与试剂补肾化瘀泄浊方药物组成:生黄芪30 g,党参15 g,苍术15 g,生地黄15 g,土茯苓30 g,丹参15 g,桃仁10 g,水蛭3 g,虎杖15 g,白花蛇舌草15 g,生大黄10 g。中药按处方量173 g加水500 mL,煎煮2次,滤过除去杂质,进一步水煎浓缩,滤过除菌备用。TGF-β1购自美国R&D公司;胎牛血清、DMEM培养基购自美国Gibco公司;E-钙黏蛋白(E-cadherin,批号:3195)、α-平滑肌肌动蛋白(α-SMA,批号:19245)、波形蛋白(Vimentin,批号:5741)、β-肌动蛋白(β-actin,批号:4970)、细胞外调节蛋白激酶(ERK,批号:4695)、磷酸化细胞外调节蛋白激酶(p-ERK,批号:4370)、Smad2/3(批号:8685)、p-Smad2/3(批号:18338)多克隆抗体,免疫球蛋白G(IgG)二抗(批号:7074),购自美国CST公司;丝裂原活化蛋白激酶激酶(MEK)抑制剂(PD98059,批号:MP23)购自上海爱必信生物科技有限公司;RIPA细胞裂解液(P0013B)购自上海碧云天公司;BCA蛋白定量试剂盒购自美国Thermo公司;RT-PCR逆转录试剂盒、Real-time PCR试剂盒购自日本TaKaRa公司;超敏ECL发光液购自美国Millipore公司。
1.3 主要仪器倒置相差显微镜;多功能酶标仪(PerkinElmer);荧光定量PCR循环仪;垂直电泳仪、转膜槽(BIO-RAD)。
2 实验方法
2.1 细胞培养将HK-2以贴壁方式培养,培养基为含10%胎牛血清的DMEM培养液(含青霉素100 U/mL+链霉素100 μg/mL),放置于37 ℃含95%空气、5%CO2、饱和湿度的培养箱中培养,于细胞对数生长期进行实验。
2.2 细胞活力检测待HK-2生长至80%~90%时,将其消化重悬接种于96孔板内培养,待细胞贴壁后进行分组与干预。设空白组和补肾化瘀泄浊方不同剂量(1、2、5、10 ng/mL)组,每组设5个复孔。培养24 h后每孔加入10 μL CCK-8试剂,孵育4 h后,测定波长450 nm处各孔OD值,取平均值进行分析。
2.3 细胞形态学观察细胞分组同步化培养,待生长至70%左右融合后,空白组仍于正常培养液中培养,模型组于正常培养液加TGF-β1 5 ng/mL[6],中药低、中、高剂量组在模型组的基础上加入低、中、高剂量(1、2、5 ng/mL)补肾化瘀泄浊方水煎剂干预,孵育48 h后,倒置显微镜下(×40)观察细胞形态。
2.4 Western blot检测相关蛋白表达细胞同步化培养后分为空白组、模型组(TGF-β1 5 ng/mL)、PD98059干 预 组(TGF-β1 5 ng/mL+PD98059 10 μmol/L)和中药低、中、高剂量组(TGF-β1 5 ng/mL+补肾化瘀泄浊方水煎剂1、2、5 ng/mL),干预24 h,收集细胞。采用RIPA裂解液(含蛋白酶抑制剂、磷酸酶抑制剂、EDTA)抽提总蛋白,BCA法进行蛋白定量,蛋白样品20 μg每泳道加入到8%SDS-PAGE凝胶中进行电泳分离,将蛋白电转至PDVF膜上,5%脱脂奶粉封闭液封闭1 h,一抗4 ℃过夜,TBST漂洗3次后加入辣根碱过氧化物酶标记的二抗室温孵育1 h,TBST漂洗3次后,于PVDF膜上滴加ECL显影液,凝胶成像系统扫描并分析条带。
2.5 Real-time PCR检测相关基因mRNA的表达细胞同步化培养后分为空白组、模型组(TGF-β1 5 ng/mL)和中药低、中、高剂量组(TGF-β1 5 ng/mL+补肾化瘀泄浊方水煎剂1、2、5 ng/mL),干预24 h后采用TRIzol裂解细胞,室温静置5 min,加入氯仿充分振荡15 s,室温静置3 min,12 000×g、4 ℃离心15 min后提取上清,加入异丙醇,轻轻混匀后室温静置10 min,12 000×g、4 ℃离心10 min,弃上清,加入75%乙醇轻轻洗涤,7500×g、4 ℃离心5 min,弃上清,室温干燥沉淀后采用适量DEPC水溶解总RNA。测定总RNA浓度及纯度后,采用500 ng RNA进行逆转录,根据说明书,加入Master Mix和RNase-free dH2O,在37℃ 15 min,85 ℃ 5 s,4 ℃条件下合成cDNA。根据Real-time PCR说明书,在PCR反应板中加入SYBR Premi×E×TaqⅡ、cDNA及目的基因引物,在50 ℃ 20 s、95 ℃ 10 min、95 ℃ 15 s、60 ℃ 15 s、72 ℃ 40 s条件下采用荧光定量PCR循环仪扩增40个循环,相对定量法(2-△△Ct)进行统计分析。根据Gen Bank E-cadherin、α-SMA、Vimentin及β-actin基因全长序列,利用引物设计软件Primer 5.0设计E-cadherin、α-SMA、Vimentin及β-actin的引物。引物由生工生物工程(上海)股份有限公司合成。
2.6 统计学方法采用SPSS 17.0软件对数据进行统计分析。数据以(±s)表示,2组间比较采用独立样本 t 检验,3组及以上各组间的比较采用ANOVA单因素方差分析,P<0.05为差异有统计学意义。
3 实验结果
3.1 补肾化瘀泄浊方对HK-2细胞活力的影响与空白组比较,1、2、5 ng/mL补肾化瘀泄浊方水煎剂干预对HK-2细胞活力无影响,但当剂量达到10 ng/mL时,细胞活力有所下降(P<0.05),考虑可能为细胞毒性作用,故后续实验选用浓度1、2、5 ng/mL的补肾化瘀泄浊方水煎剂。见图1。

图1 不同剂量补肾化瘀泄浊方作用24 h后HK-2细胞活力比较(±s,n=3)
3.2 补肾化瘀泄浊方对TGF-β1诱导HK-2 EMT细胞形态学的影响空白组HK-2细胞呈“鹅卵石样”外观;模型组少见鹅卵石样细胞,多见EMT特有的“纺锤形”结构,细胞变瘦长,呈梭形,似成纤维细胞样;经低、中、高剂量补肾化瘀泄浊方水煎剂干预后上述改变得到一定程度的抑制,部分细胞逆转为鹅卵石样,并以高剂量组作用最为明显。见图2。
3.3 补肾化瘀泄浊方对TGF-β1诱导HK-2 EMT标记物的影响中药各剂量组α-SMA、Vimentin蛋白、mRNA表达较模型组明显下降(P<0.05),E-cadherin蛋白、mRNA表达较模型组明显上升(P<0.05),见图3、图4。以上变化以高剂量组最为明显。
3.4 补肾化瘀泄浊方对TGF-β1诱导HK-2 ERK及Smad2/3 的影响与空白组比较,模型组HK-2细胞经TGF-β1刺激后,磷酸化ERK、磷酸化Smad2/3蛋白水平显著升高(P<0.05)。与模型组比较,低、中、高剂量补肾化瘀泄浊方均能有效抑制ERK及Smad2/3蛋白高磷酸化水平(P<0.05),以高剂量影响最为明显。此外,TGF-β1和补肾化瘀泄浊方对ERK及Smad2/3总蛋白的表达无明显影响。见图5。
3.5 补肾化瘀泄浊方对比ERK通路抑制剂对TGF-β1诱导HK-2 EMT及Smad2/3的影响结果显示:与模型组比较,PD98059干预组、中药高剂量组α-SMA、Vimentin、磷酸化Smad2/3蛋白表达水平均明显降低(P<0.05);Smad2/3总蛋白的表达无明显差异。见图6。
4 讨论
肾脏纤维化是各种CKD发展到最后的共同病理过程,是导致肾功能损伤的关键因素。近年来,人们在肾脏纤维化的分子和细胞调控因子方面做了大量研究。研究证明EMT是肾脏纤维化的一个重要进程,抑制EMT成为预防肾脏纤维化发生和发展的有效手段[7]。通常,在肾脏纤维化EMT过程中,肾小管上皮细胞失去上皮细胞标记物,如黏附蛋白E-cadherin表达下调;获得间充质细胞标记物,表 现 为Vimentin、α-SMA、Snail表达上调[8]。TGF-β1作为最重要的促纤维化因子,在肾脏纤维化中也发挥了关键作用[9]。研究表明,TGF-β1可以通过Smad依赖性和Smad非依赖性通路发挥生物学功能[10],TGF-β1下游信号包括了细胞质中Smad2/3 蛋白磷酸化,磷酸化Smad2/3与Smad4 形成复合物,随之转移到细胞核中,激活纤维化相关转录因子[11]。此外,TGF-β1/Smad信号通路与ERK信号通路之间的交互关系在肾脏纤维化中也已经被证实[12]。
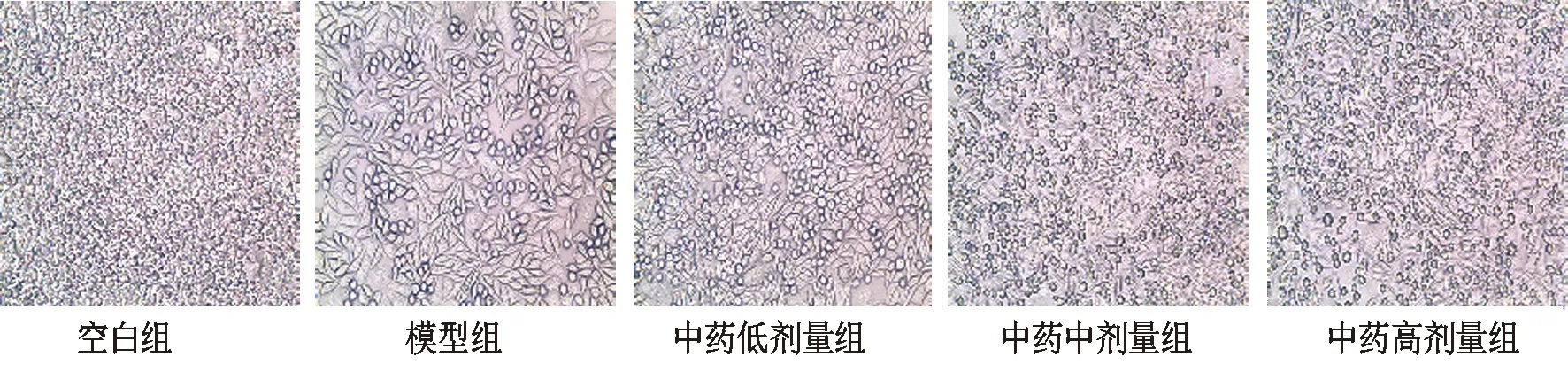
图2 各组HK-2 EMT细胞形态学比较(×40)
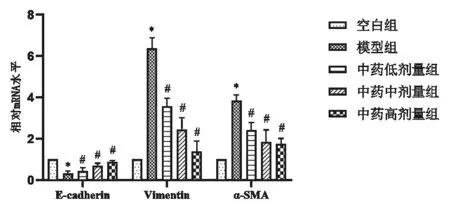
图4 各组TGF-β1诱导HK-2 EMT标记物mRNA表达比较(±s,n=3)
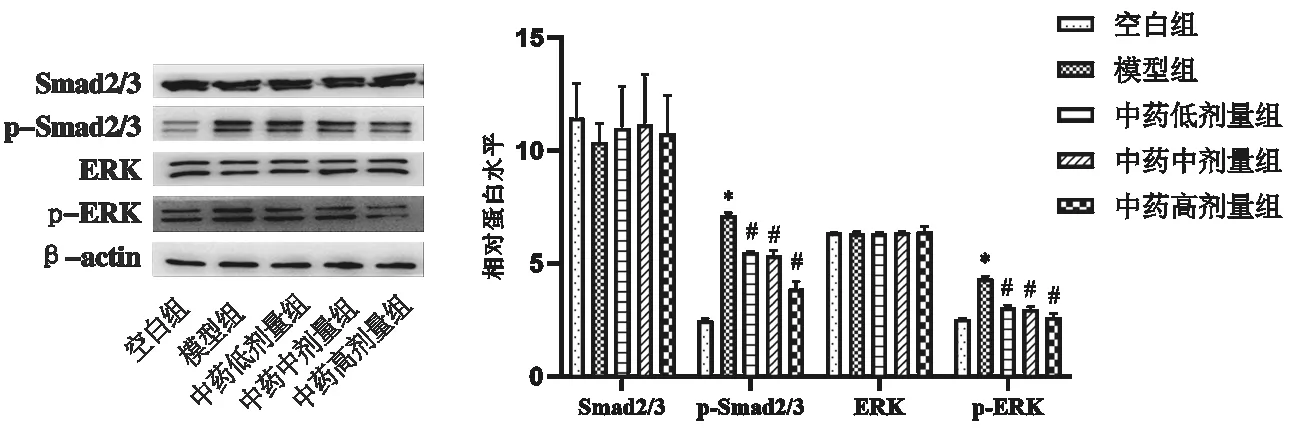
图5 各组TGF-β1诱导HK-2 ERK及Smad2/3 蛋白表达比较(±s,n=3)
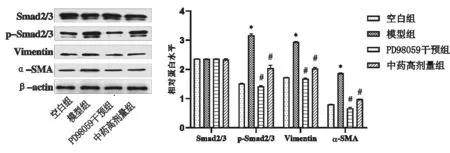
图6 各组TGF-β1诱导HK-2 EMT及Smad2/3 蛋白表达比较(±s,n=3)
本研究采用TGF-β1刺激HK-2诱导EMT,观察发现HK-2细胞形态出现了明显改变,且EMT标记物E-cadherin蛋白及mRNA表达水平明显下降,Vimentin、α-SMA蛋白及mRNA表达水平明显上调,以上结果均提示HK-2细胞EMT体外模型构建成功。此外,本研究还发现经TGF-β1刺激后,ERK及Smad2/3蛋白磷酸化水平显著升高;但使用ERK通路抑制剂预处理,再给予TGF-β1干预后,HK-2 EMT标记物Vimentin、α-SMA蛋白表达下降,同时Smad2/3磷酸化水平也有所下降。这些现象反映出:ERK信号通路参与了TGF-β1诱导的HK-2细胞EMT,并且Smad2/3蛋白可能是ERK信号通路的下游信号分子。
CKD可归属于中医学“水肿”“关格”“虚劳”“水毒症”等范畴,乃本虚标实证,本虚可为气、血、阴、阳亏虚,标实以水湿、湿毒、血瘀多见,病位在肾,可累及多脏。补肾化瘀泄浊方化裁自肾气丸合桃红四物汤,可补虚祛邪。方中黄芪益气固表、利水载毒而出,党参健脾益肾、益气行水,苍术利水解表、托毒外出,生地黄清热凉血,土茯苓、虎杖、白花蛇舌草清利湿热,丹参、桃仁活血化瘀,水蛭补肝肾、活血化瘀,大黄泻下通便排毒兼活血化瘀。诸药合用,共奏补肾益气、活血化瘀、泄浊排毒之功效。本研究将此中药复方制成不同剂量水煎剂干预HK-2,结果表明:补肾化瘀泄浊方能在一定程度上呈剂量依赖性地逆转TGF-β1诱导的EMT标记物E-cadherin、Vimentin、α-SMA蛋白及mRNA的表达;同时,与模型组比较,补肾化瘀泄浊方各剂量组ERK磷酸化及Smad2/3磷酸化水平均有一定程度的下调,且以5 ng/mL效果最佳。这表明补肾化瘀泄浊方在阻抑HK-2 EMT的同时还抑制了ERK及Smad2/3蛋白活性。在与ERK通路抑制剂PD98059干预组比较后,我们发现补肾化瘀泄浊方调控EMT标记物及Smad2/3的作用与ERK通路抑制剂的效果类似,表明补肾化瘀泄浊方缓解EMT的作用很有可能与ERK通路有关。
综上所述,本研究发现,补肾化瘀泄浊方很可能通过调控ERK信号通路,抑制Smad2/3蛋白磷酸化,从而实现逆转HK-2 EMT的作用。但本研究只观察了TGF-β1/Smad信号通路与ERK信号通路之间的交互关系,而中药复方发挥疗效是多成分多靶点共同作用的结果,是否存在调节其他信号通路的功能,将是我们下一步研究的方向。
