膈肌移动度与肺切除术后肺部并发症及近期预后的关系
2021-05-11王小文李林峻吴庆琛贺雪梅
岳 红 王小文 李林峻 张 勇 陈 丹 吴庆琛 贺雪梅
肺切除手术后常发生肺部并发症。膈肌是人体主要的呼吸肌,膈肌功能障碍是导致患者呼吸衰竭和延迟机械通气撤离的重要原因,不利于患者预后[1]。多数膈肌功能障碍患者无明显临床症状,不易被识别。目前用于检查膈肌功能的方法有膈肌肌电图、测量跨膈压,均为侵入性检查,且操作复杂,不易被患者接受。超声作为一种无创、实时、动态的检查方法,近年来在临床膈肌功能监测方面的应用逐渐受到重视。本研究应用超声测量膈肌移动度(diaphragmatic excursion,DE),探讨肺切除术患者围术期的DE 与肺部并发症及其近期预后的关系,分析导致术后膈肌功能障碍的危险因素,旨在早期发现膈肌功能不全,指导临床制定治疗方案。
资料与方法
一、研究对象
序贯性收集2019 年9 月至2020 年1 月于我院胸外科行单侧肺切除术的患者90 例,男41 例,女49 例,年龄35~81 岁,平均(58.78±9.89)岁。纳入标准:①年满18 周岁;②体质量指数(BMI)<30 kg/m2;③择期行单侧肺(肺段、肺叶)切除术;④术前未行放疗、化疗或其他可能影响膈肌功能的治疗。排除标准:①既往有胸腔手术史;②术后皮下气肿明显影响检查者;③合并慢性心肺疾病;④临床资料不完整。剔除标准:研究过程中,膈肌超声显像不满意者。本研究经我院医学伦理委员会批准,受检者均签署知情同意书。
二、仪器与方法
1.超声检查:使用迈瑞M 9 彩色多普勒超声诊断仪,凸阵探头,频率1~5 MHz。患者取仰卧位,自主呼吸,将探头置于肋缘下锁骨中线与腋前线之间,垂直于膈肌移动,见膈肌声像图为一高回声亮线,然后切换至M 型超声,测得膈肌运动轨迹上波峰与波谷的垂直距离[2],即为DE,测量3 次取平均值。分别于术前(T0)和术后24、48、72 h(T1、T2、T3)测量所有患者双侧DE。
2.分组:以术后24 h 平静呼吸状态下DE<1 cm 作为膈肌功能障碍的诊断标准[3],将患者分为膈肌功能障碍组(DD组)54例和膈肌功能正常组(ND组)36例。
3.观察指标:收集患者临床资料,包括一般资料、手术切除范围、术后并发症,以及近期预后、术后死亡率等。随访患者至出院,近期预后指标包括:肺完全复张时间、胸引带管时间。肺部并发症包括:肺复张不全、肺部感染、肺漏气、术后残腔、胸腔积液。肺复张不全:影像学检查证实1 个或多个肺段或肺叶的容量或含气量减少。肺部感染:①术后出现高热(体温>38.5℃)症状,并经血培养检查证实;②术后咳出浓痰,影像学检查提示肺部新发斑片状渗出影,经痰标本培养出致病菌;③术后白细胞计数明显上升,经升级抗生素治疗后白细胞计数明显下降。中度以上肺漏气:术后闭式胸腔引流管持续漏气时间>7 d不能拔除。术后残腔:术后行胸部X片或CT检查提示术侧胸腔上缘低于第三后肋水平。胸腔积液:患者自觉症状明显,经影像学检查证实,需反复多次行胸腔穿刺或再次行胸腔闭式引流[4-5]。无需处理或无临床意义的并发症如少许气胸、少量胸腔积液、局限性的皮下气肿等对患者术后康复出院未造成不利影响的,则不予记录。比较两组上述指标的差异。
三、统计学处理
结 果
一、两组一般资料比较
90 例患者术前均无膈肌功能障碍。DD 组患者与ND 组比较,肺叶切除及有吸烟史比例更大,差异有统计学意义(P<0.01),余指标比较差异均无统计学意义。见表1。
二、两组患者术后肺部并发症及近期预后比较
1.术后肺部并发症:90例患者中共35例出现肺部并发症。其中 DD 组 27 例,ND 组 8 例,两组术后并发症总发生率(50.0% vs. 22.2%)比较,差异有统计学意义(P=0.008)。两组术后肺复张不全、术后残腔、术后胸腔积液、肺部感染的发生率比较,差异均有统计学意义(均P<0.05),术后肺漏气发生率比较,差异无统计学意义。见表2。
2.近期预后:随访期间无患者死亡。DD组术后肺完全复张时间和胸引管带管时间均较ND 组更长,肺完全复张时间>3 d者比例较ND组增高,差异均有统计学意义(P=0.005、0.002、0.001)。见表2。
三、围术期DE变化
1.术侧与健侧 DE 变化:两组术后24 h 术侧DE 较术前均明显下降,术后48 h 开始回升,到术后72 h 尚未恢复至术前水平。两组术后48 h 健侧DE 与术前比较均无明显变化,术后72 h 起均开始代偿性增加。其DE 变化趋势见图1。
2.手术前后双侧DE变化:两组术前双侧DE比较,差异无统计学意义;术后各时间点双侧DE 比较差异,均有统计学意义(均P<0.001),见图2和表3。
四、术后膈肌功能障碍的危险因素分析
1.单因素分析:将性别、年龄、吸烟史、手术时间、手术切除范围、ASA 评级作为变量,对术后膈肌功能障碍的危险因素进行单因素分析,结果显示,有吸烟史、肺叶切除患者的术后膈肌功能障碍发生率显著高于无吸烟史、肺段或楔形肺切除的患者(均P<0.05)。
2.多因素Logistic 回归分析:有吸烟史、肺叶切除是术后膈肌功能障碍的危险因素(均P<0.05)。见表4。
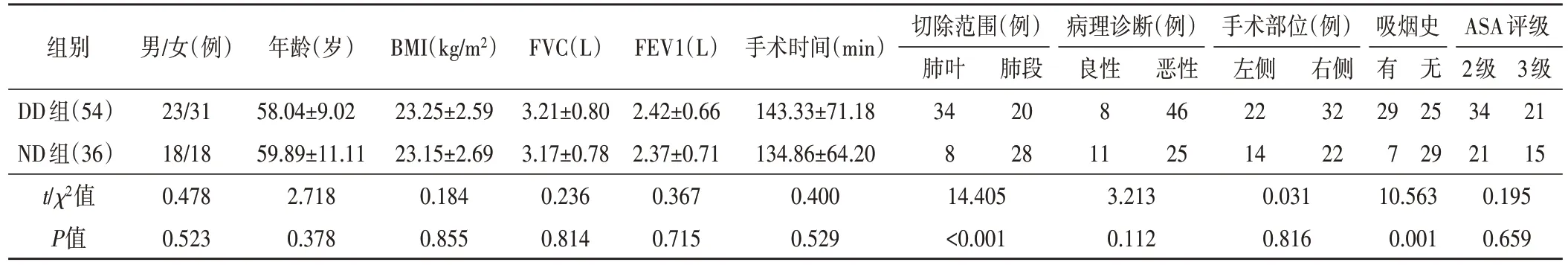
表1 两组患者一般资料比较
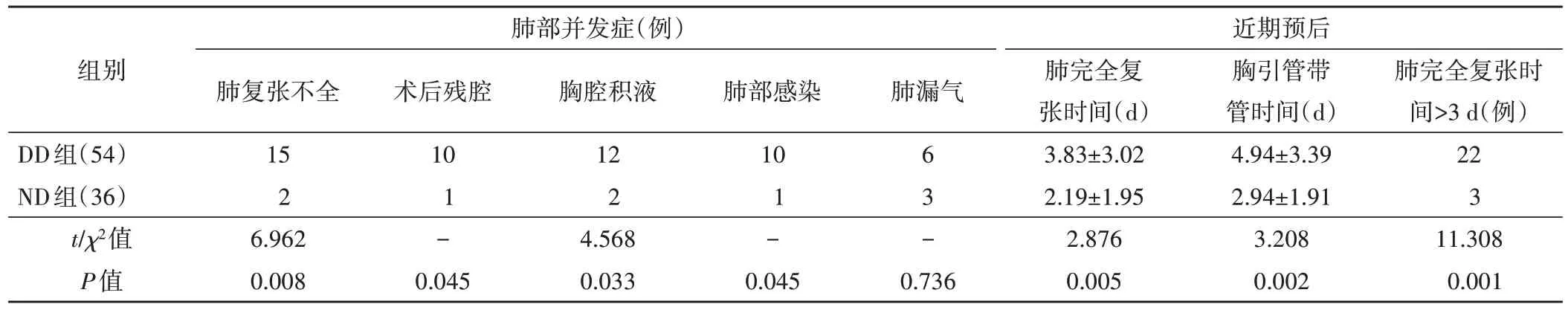
表2 两组患者术后并发症及近期预后情况比较
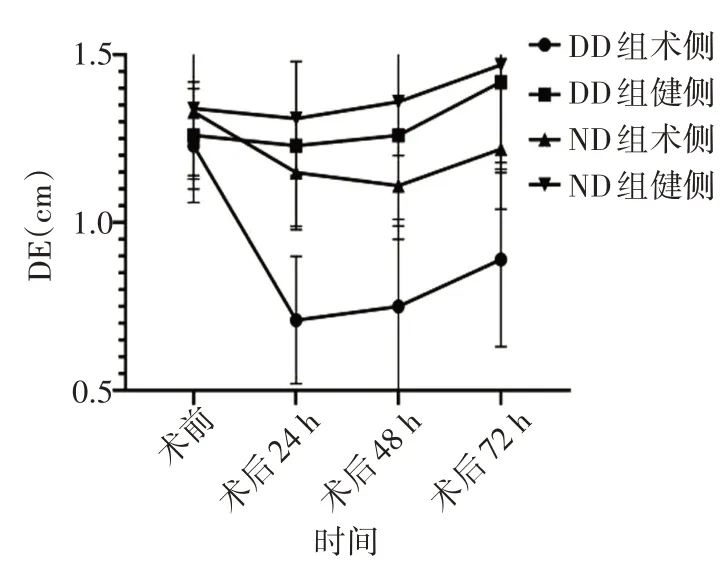
图1 两组围术期DE变化趋势
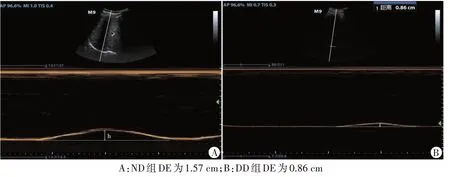
图2 两组测量DE超声图像
表3 两组患者围术期DE变化情况() cm
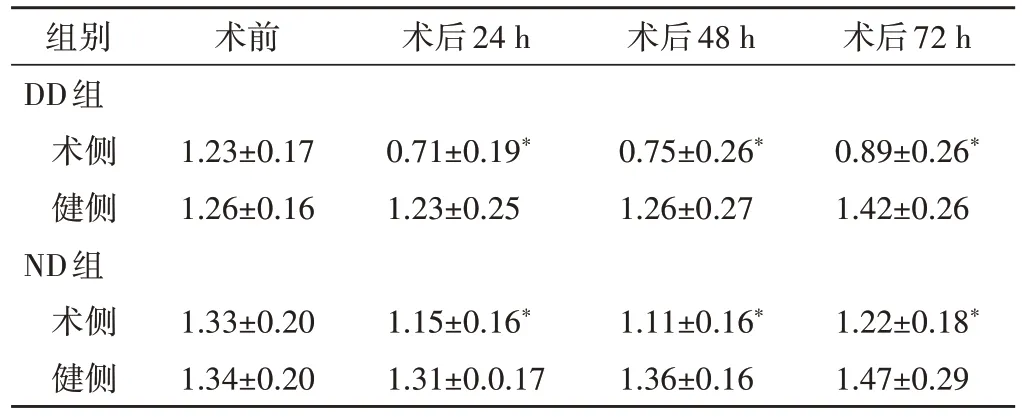
表3 两组患者围术期DE变化情况() cm
与本组健侧比较,*P<0.05
术前 术后24 h 术后48 h 术后72 h组别DD组术侧健侧ND组术侧健侧1.23±0.17 1.26±0.16 0.71±0.19*1.23±0.25 0.75±0.26*1.26±0.27 0.89±0.26*1.42±0.26 1.22±0.18*1.47±0.29 1.33±0.20 1.34±0.20 1.15±0.16*1.31±0.0.17 1.11±0.16*1.36±0.16

表4 单侧肺切除术后膈肌功能障碍的多因素Logistic回归分析
讨 论
文献[6-7]报道胸外科手术患者术后肺部并发症的发生率约11%~49%,本研究中肺切除术后并发症的发生率为39%。术后肺部并发症不仅与高死亡率、重症监护、住院时间长、费用增加有关[8],还可影响患者术后肺功能和生活质量[9]。因此早期识别术后并发症高危患者非常关键。既往研究[10-11]表明,胸腹部手术会影响患者术后膈肌及肺功能,而超声可通过实时、动态地显示患者双侧膈肌运动,量化DE,进而评估膈肌功能。本研究旨在探讨围术期DE 与肺切除术后患者发生肺部并发症及近期预后的关系。
本研究结果显示,DD 组术后肺部并发症发生率显著高于ND 组(P<0.05)。DD 组中出现肺复张不全15例,明显多于ND 组(2例);DD 组肺切除术后发生肺部感染者(10例)明显多于ND组(1例),差异均有统计学意义(均P<0.05)。分析原因为肺切除术可引起胸壁形态和静息膈肌长度变化,术后疼痛也导致膈神经抑制,从而引起膈肌功能障碍。由于膈肌收缩在腹部和胸部之间提供压差,当膈肌功能障碍时,其在维持胸腹腔内的压力方面效果降低,且膈肌功能障碍影响肺壁和胸壁力学,不利于肺复张。同时,术后膈肌肌力下降,咳嗽排痰能力受损,加之外感因素,更易发生肺部感染。肺部感染又进一步削弱膈肌功能,导致恶性循环。DD 组54例患者的膈肌功能障碍均发生在手术同侧,其中2例除发生术侧膈肌功能障碍外,健侧膈肌功能也发生了障碍,术后24 h 内膈肌功能障碍的发生率为60%,略低于Spadaro 等[11]报道的68%,分析原因可能与本研究纳入患者的年龄较低有关。
本研究还发现健侧DE 在术后48 h 内保持不变;术后72 h 开始,健侧DE 开始出现代偿性增加,这与Takazakura 等[12]发现术后 3 个月时应用 MRI 测量的结果相似,但本研究观察的时间点明显提前。分析其原因,膈肌代偿性运动增加可能出现得更早,或超声能更早地监测到膈肌的代偿性运动增强。由此可推测,围术期早期发现膈肌功能障碍,及时进行干预,尽早促进膈肌功能恢复有利于肺复张和减少术后肺部并发症。
针对危险因素治疗和干预也是降低术后膈肌功能障碍发生的重要方法。除发现膈肌功能障碍导致术后肺部并发症发生率增高外,本研究还分析了术后发生膈肌功能障碍的危险因素,结果显示,有吸烟史、肺叶切除是肺切除术后膈肌功能障碍的独立危险因素。因此对于有吸烟史、行肺叶切除的患者,在术前应该充分评估患者肺功能,此外在手术前,应综合评估患者情况,选择最适合的术式,做好充分准备,缩短手术时间,减少术中患者机体消耗,进而降低术后膈肌功能障碍的发生风险,减少术后肺部并发症的发生,改善预后。
本研究的局限性:首先,超声的扫描深度有限,严重肥胖患者的膈肌无法完全清晰显示,在部分患者中应用受限,对于此类患者可以结合MRI 评估膈肌功能;其次,本研究样本量偏小,期待后续更大样本更完整的研究。
综上所述,通过床旁超声评估围术期DE,可早期发现膈肌功能障碍,及早采取干预措施,以减少术后肺部并发症的发生,改善患者近期预后。
