调控生物钟的小分子化合物的研究进展
2021-05-10凡杰夫何颖王伟忠谭兴张建王杨凯
凡杰夫 何颖 王伟忠 谭兴 张建 王杨凯

摘 要 目的:了解调控生物钟的小分子化合物的研究进展,为生物节律干预策略的研究和相关药物的研发提供参考。方法:对钟基因的调控机制、调控生物钟的小分子化合物[如靶向蛋白激酶、靶向核受体、靶向隐花色素蛋白(CRY)、靶向時钟蛋白(CLOCK)]的作用机制及其筛选和鉴定方法进行综述。结果与结论:生物体内与生物钟的发生和维持相关的基因被称为节律基因,包含钟基因和钟控基因两类。钟基因是维持生物钟节律的关键,其表达受到转录-翻译反馈环路的调控。钟基因表达失调将导致生物钟节律的减弱或紊乱,从而导致多种疾病的发生、发展。生物钟相关蛋白调控小分子化合物可靶向蛋白激酶参与的翻译后修饰,在生物钟的调控中具有重要作用,其突变可能参与了多种由生物钟紊乱所致的疾病;靶向核受体的小分子化合物可对癌细胞产生明显的细胞毒性效果,可为多效抗癌药的研发提供帮助;靶向CRY的小分子化合物可增强CRY稳定性和CRY-周期基因(PER)蛋白复合体对核转运类似蛋白1(BMAL1)-CLOCK的抑制作用,减少关键钟基因的表达,从而使患者胶质母细胞瘤干细胞发生周期停滞,引起凋亡增加;靶向CLOCK的小分子化合物是调控钟基因转录-翻译反馈环路的重要组成部分,其含量和活性能显著影响生物钟的稳定性和振幅强度。目前,对大多数小分子调节物质的研究仍停留在基础实验阶段,还存在对钟蛋白的精确调控存在困难,对BMAL1和PERs等关键钟蛋白的调节物的研究仍处于盲区等不足;而对已知调控生物钟的小分子化合物,进一步的修饰与改造、优化其药动学特性、减轻其不良反应,是该领域重要的研究方向。
关键词 生物节律;钟基因;小分子化合物;表型筛选;靶向筛选;生物钟调控
中图分类号 R966 文献标志码 A 文章编号 1001-0408(2021)07-0890-07
生物钟(Circadian clock)是生物适应外界环境规律性变化的一种内在机制,控制着生命活动的节律性,而多种钟基因及其蛋白产物所构成的复杂调控网络保证了生物钟节律与环境节律的一致性[1-2]。生物钟受到外源性和内源性信号的调节,从而产生适应性变化。其中,光照和温度是调控生物钟的重要外源性信号,生物钟中枢区域下丘脑视交叉上核输出的神经和体液信号是调控生物钟的内源性因素[2]。生物钟节律的减弱或紊乱与睡眠障碍、代谢失调、肿瘤等多种疾病息息相关[3]。研究表明,多种小分子化合物具有对生物钟的调控作用,筛选并鉴定调控生物钟的小分子化合物并阐明其药理作用,对相关疾病的药物研发具有重要的意义,也为新型靶向药物的研发提供了可能。基于此,笔者就调控生物钟的小分子化合物的筛选方法和作用机制进行综述,以期为生物节律干预策略的研究和相关药物的研发提供参考。
1 钟基因的调控机制
生物体内与生物钟的发生和维持相关的基因被称为节律基因,包含钟基因(Clock genes)和钟控基因两类,前者对维持生物节律起关键作用。哺乳动物体内存在多种钟基因,包括时钟基因(Clock)、脑和肌肉组织芳香羟受体核转运类似蛋白1基因(Bmal1)、周期基因1-3(Per1-3)、隐花色素基因(Cry)等[4]。钟控基因广泛分布于全身的组织、细胞,位于钟基因下游并受其调控,使得相关生理活动呈现节律性;同时,核受体亚家族1 D组成员1基因(NR1D1,又称Rev-erbα)、白蛋白D位点结合蛋白基因(Dbp)和腺病毒E4启动子结合蛋白4基因(E4bp4)等钟控基因对钟基因的表达具有反馈调节作用[5-7]。多种节律基因及其蛋白产物构成了复杂的生物钟调控网络,其转录、翻译、磷酸化等分子调控机制是维持生物钟周期性振荡的关键。小分子对钟基因表达的调节机制见图1。
1.1 钟基因的自主调控机制
钟基因的表达受到节律基因转录-翻译反馈环路的调控,其中钟基因及其蛋白产物构成核心调控环路,钟控基因参与构成两条调控钟基因的辅助环路[8]。在核心环路中,Clock和Bmal1基因表达的蛋白产物CLOCK和BMAL1构成异二聚体,激活钟基因转录,发挥正向调控作用;而Per和Cry基因的蛋白产物PER、CRY入核形成稳定的复合物,抑制CLOCK-BMAL1异二聚体的作用,起负性调控作用[8]。两条辅助环路中的第一条包括2个核受体家族,即REV-ERBα/β和RORα/β/γ,它们竞争结合Bmal1顺式作用元件RORE,分别对Bmal1转录起抑制和促进作用[5]。在另一条辅助环路中,CLOCK- BMAL1异二聚体促进下游钟控蛋白DBP和E4BP4生成,DBP参与构成的蛋白复合体可增强CLOCK-BMAL异二聚体对Per的诱导作用;相反,E4BP4则使其诱导作用减弱[9]。研究发现,DBP浓度在清晨达到高峰,在夜晚降至低谷,且与PER的浓度变化相符[4]。这3条反馈环路是调控钟基因的主要途径,使钟基因的表达发生自主振荡,在生物体内稳定地运行,将生物节律维持在24 h左右[4]。
1.2 钟蛋白修饰对钟基因调控的影响
钟蛋白的翻译后修饰在钟基因的调控过程中起重要作用,多种蛋白激酶如CK1、CK2、JNK、MAPK和GSK-3参与了钟蛋白的磷酸化过程,例如JNK可介导CLOCK和BMAL1的磷酸化、干扰其入核转运的过程并抑制CLOCK-BMAL1异二聚体的功能[10];CK1和MAPK则可介导PER和CRY的磷酸化,并增强其对CLOCK- BMAL1异二聚体的抑制作用[11];泛素化影响钟蛋白的稳定性,如F-box蛋白介导PER和CRY单体发生泛素化,而后被蛋白酶体降解[12]。翻译后修饰过程可显著影响生物钟自主调控过程中的关键蛋白的活性和功能,对于生理或病理情况下生物钟的调节与重置具有重要意义,异常的翻译后修饰将导致生物钟节律的紊乱,例如在家族性晚期睡眠综合征中,PER蛋白磷酸化的缺失会导致节律周期前移4 h[13]。
2 调控生物钟的小分子化合物的筛选和鉴定方法
生物化学和高通量筛选技术的发展使得从成千上万的小分子物质中筛选出影响生物钟节律的小分子化合物成为可能。目前,表型筛选法和靶向筛选法是筛选与鉴定调控生物钟的小分子化合物的主要方法。
2.1 基于细胞表型的高通量篩选法
基于细胞表型的高通量筛选方法以无偏差方式筛选影响生物钟节律的小分子化合物,该方法依赖高通量筛选技术和信息技术从众多特征良好的化合物中挑选出能显著改变细胞节律表型的小分子化合物[14]。
该方法对小分子化合物的作用靶点和作用机制没有限制,能更全面地筛选出影响生物钟的小分子化合物;并且在确定候选化合物的作用靶点时,有可能发现新的节律相关蛋白和作用机制。表型筛选法还能直接筛选出强烈影响生物钟动态的小分子化合物,并能对化合物的功能表现进行明确的鉴定与选择。但广泛而全面的筛选也造成了该方法的局限性,由于筛选容量庞大,对实验处理的精确性、一致性要求高,因此较难获得高质量和高准确度的数据。
2.2 靶向筛选法
X射线晶体学的发展对蛋白晶体结构的解析起到了巨大的推动作用,而对钟蛋白结构的认识又使得筛选靶向特定蛋白的小分子化合物成为可能[15]。
该方法可有针对性地寻找作用于目的蛋白的小分子化合物,避免了无偏差筛选的盲目性和偶然性,保证了筛选出的活性小分子能直接作用于调节生物钟的核心蛋白,而不是通过其他途径间接影响生物钟的节律。这些优点使靶向筛选法对于筛选鉴定调节生物钟的小分子化合物具有十分重要的意义。目前,还没有发现作用于PERs、BMAL1等钟蛋白的小分子化合物,且已知的生物钟调节物也大多缺乏对蛋白亚型的选择性,因此更具针对性的靶向筛选法将在进一步的研究中起到重要作用。靶向筛选法的局限性主要表现在其研究范围仅限于直接作用于已知蛋白质结构的小分子化合物,而无法筛选其他作用方式的化合物,例如影响钟蛋白的亚细胞定位的小分子物质[4]。
3 生物钟相关蛋白调控小分子化合物对钟基因的调控及应用
生物钟与睡眠、代谢、情绪反应等多种生理活动息息相关,研究人员也一直致力于探索生物钟调控药物对这些生理功能障碍引起的疾病的作用。数量众多的符合Lipinski规则的小分子化合物是具有潜力的生物钟调控药物,这些小分子化合物可结合生物钟相关蛋白并改变其生物活性,从而影响钟基因的表达以起到调控生物钟的作用[3,16]。最初,研究人员使用基于表型的高通量筛选法鉴定出多种影响钟蛋白翻译后修饰过程的小分子化合物,发现蛋白激酶(如CK1、CK2、GSK-3)为其主要的作用靶点;最近,研究人员尝试使用小分子化合物直接靶向调控钟基因的核心蛋白,包括CRY、核受体(REV-ERB、ROR)和CLOCK。下文将分别描述靶向多种生物钟相关蛋白的小分子化合物对钟基因和生物钟的影响,及其在相关疾病中的应用。
3.1 靶向蛋白激酶
蛋白激酶参与的翻译后修饰在生物钟的调控中具有重要作用,蛋白激酶的突变可能参与了多种由于生物钟紊乱所致的疾病的发生、发展,因此蛋白激酶是小分子药物研发中备受关注的调控靶点。靶向蛋白激酶的生物钟调控小分子化合物见表1。
蛋白激酶CK1在钟基因的调控中发挥着重要作用,PER蛋白是其主要作用靶点[11]。小分子化合物Longdaysin是最先被鉴定出的CK1抑制剂,具有延长周期的作用[16]。虚拟分子对接研究显示,Longdaysin的嘌呤环和亚胺基与CK1亮氨酸残基间形成氢键,介导两者结合;抑制CK1活性将导致PER磷酸化减弱,并使PER-CRY复合物对CLOCK-BMAL1异二聚体的抑制作用减弱,从而增强钟基因的表达[17]。在人类的家族性晚期睡眠综合征中发现Per或CK1δ基因的单点突变,使PER蛋白的磷酸化受到影响,导致睡眠等行为提前4 h出现;使用CK1抑制剂Longdaysin后,节律周期得以延长,显示出Longdaysin对于该综合征有良好的治疗潜力[12]。进一步研究发现,Longdaysin衍生物NCC007与CK1结合更稳定,并显示出更强的抑制作用[17]。另外,IC261、SP600125等小分子化合物也具有对CK1的抑制作用,并通过相似过程延长节律周期[18]。值得关注的是,CK1有7种亚型,其中CK1α/δ/?被证实参与钟基因的调节,这3种不同亚型的CK1具有相似的功能,而研究显示CK1δ的作用最重要[11]。针对不同亚型的CK1的小分子物质也会产生不同的结果,如特异的CK1?抑制剂PF-4800567只轻度延长周期,而CK1δ的特异性抑制剂PF-670462则具有显著延长节律周期的作用[19]。这些更具针对性的小分子抑制剂是研究各CK1亚型具体功能的基础,也将为药物的开发提供更多的可能。
CK2也是一种重要的蛋白激酶,其抑制剂DMAT、CX-4945等表现出周期延长的效果,但这些抑制剂的特异性不强,会同时对多种激酶产生抑制作用[20-21]。GO289是最新被鉴定的CK2抑制剂,其对CK2的选择性很强且能高效地抑制CK2活性[半数抑制浓度(IC50)=7 nmol/L],能显著延长细胞周期;其能通过溴代愈创木酚基团与CK2中Glu114、Val116和Lys68这3个在其他激酶中不保守的氨基酸残基形成氢键,这是其具有强烈选择性的分子基础[22]。该研究进一步分析发现,CK2的可能磷酸化位点很多,涉及BMAL1、CLOCK、PER2、CRY1等多种钟蛋白,其具体作用仍有待进一步研究。CK2功能失调常见于癌症,抑制剂GO289对人肾癌细胞系和小鼠MLL-AF9急性髓系白血病细胞的生长产生明显的抑制作用[20,22]。因此,选择性的CK2抑制剂为治疗生物钟相关的癌症提供了一种可能的候选化合物。
GSK-3(α/β)可介导100多种底物的磷酸化,涉及多条细胞通路并与大量疾病相关,其作用包括加强EEV-ERBα稳定性以抑制Bmal1基因转录、直接降低BMAL1蛋白稳定性等[23]。Lithium、CHIR99021和Lazakenpaullone是目前已知的GSK-3抑制剂,但其生物学效应则完全相反,其中Lithium可延长节律周期,而CHIR99021、Lazakenpaullone则可缩短节律周期[3,24]。进一步研究发现,Lithium可广泛抑制多种激酶的活性,但对GSK-3的特异性不强;而CHIR99021、Lazakenpaullone对GSK-3具有较强的选择性[25]。研究还发现,Lithium等非特异性抑制剂对于双相情感障碍、抑郁症等心理疾病具有良好的疗效,而CHIR99021等GSK-3特异性抑制剂则可以解除GSK-3抑制糖原合成的作用,从而对2型糖尿病产生治疗效果[23]。
3.2 靶向核受体
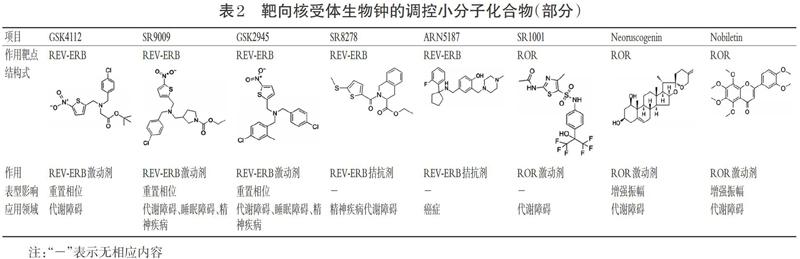
REV-ERB和ROR两个核受体家族参与构成的辅助环路在钟基因的调控中发挥着重要的作用,也是生物钟调控药物的主要靶点[2]。目前,已发现多种靶向核受体的小分子化合物,其功能多样,在代谢障碍、精神和睡眠疾病等多个领域发挥作用。但其大多缺乏对受体亚型的特异性作用,因而疗效有限、不良反应多[3]。同时,对于REV-ERB、ROR的受体-配体复合物结构的研究,目前只报道了REV-ERB、ROR分别与其天然配体血红素、胆固醇结合形成的复合体结构[26-27]。阐明其与人工合成或天然提取的小分子化合物构成的复合物结构将有助于开发更有效的小分子调节物。靶向核受体的生物钟调控小分子化合物见表2。
3.2.1 靶向REV-ERB REV-ERB是一种核激素受体,以血红素为天然配体,抑制Bmal1基因转录[3]。首先发现的REV-ERB小分子化合物激动剂是GSK4112[28]。对HepG2肝细胞系的研究表明,GSK4112可增强REV- ERB对Bmal1转录的抑制作用,减弱糖异生相关基因的表达,减少小鼠原代肝细胞合成葡萄糖[28]。
GSK4112衍生物SR9009和SR9011作为REV-ERB激动剂,可影响下丘脑视交叉上核钟基因的表达,增强Pers基因的表达振幅,减弱Crys基因的表达振幅并使Bmal1基因的表达周期前移,引起肝脏、骨骼肌和脂肪组织中一系列代谢相关基因的节律表达模式发生改变,增加能量消耗,显著减轻肥胖模型小鼠的体质量[29-30]。代谢物检测发现,SR9009和SR9011还具有减少焦虑、诱发觉醒的作用,具有治疗相关疾病的潜力[31]。后续研究表明,多种GSK4112衍生物具有更好药动学特性,例如GSK2945显示出较长的半衰期和良好的口服利用度;而Compound 10、16、23的半衰期较短,适用于短期急性注射治疗[32]。
SR8278是REV-ERB拮抗剂,通过抑制REV-ERB作用使其靶基因Bmal1、G6Pase和Pepck的表达增加;细胞试验还发现,SR8278能有效抑制葡糖糖诱导的胰岛素释放,提示REV-ERB拮抗剂可在血糖调节方面发挥作用[33]。另一种小分子化合物ARN5187具有拮抗REV- ERB和抑制细胞自噬的双重作用,对癌细胞产生明显的细胞毒性效果,可为多效抗癌药的研发提供帮助[34]。
3.2.2 靶向ROR ROR也是一种核受体,与REV-ERB有着相似的DNA结合区域(DBDs)和各异的配体结合域(LBDs),并能与胆固醇结合。ROR晶体结构中还存在一个可与共激活因子结合的helix12结構[35]。T0901317、SR1001及其多种衍生物被鉴定为ROR的可逆激动剂,对免疫、代谢等方面疾病模型的小鼠具有治疗效果[4],但尚未有研究报道这些ROR可逆激动剂对生物钟功能的影响。
多种天然小分子化合物具有调节ROR的作用,其中新红豆素(Neoruscogenin)被鉴定为ROR激动剂,其与ROR结合可增强Bmal1和代谢基因的表达,对动脉粥样硬化的治疗及脂糖代谢的改善具有潜在意义[36]。另一种天然化合物诺比利丁(Nobiletin)在表型筛选实验中被确定为ROR激动剂,具有增强节律振幅的作用,可使糖尿病或肥胖模型小鼠的钟基因(Bmal1、Npas2)和钟控基因(Ucp1、Atp5d)表达显著上调,起到维持小鼠血糖血脂稳态、保护代谢功能等作用[37]。诺比利丁、新红豆素及其代谢物质天然存在,无毒性,且具有良好的改善代谢的能力,是具有潜力的候选药物[38-39]。
3.3 靶向CRY的小分子化合物
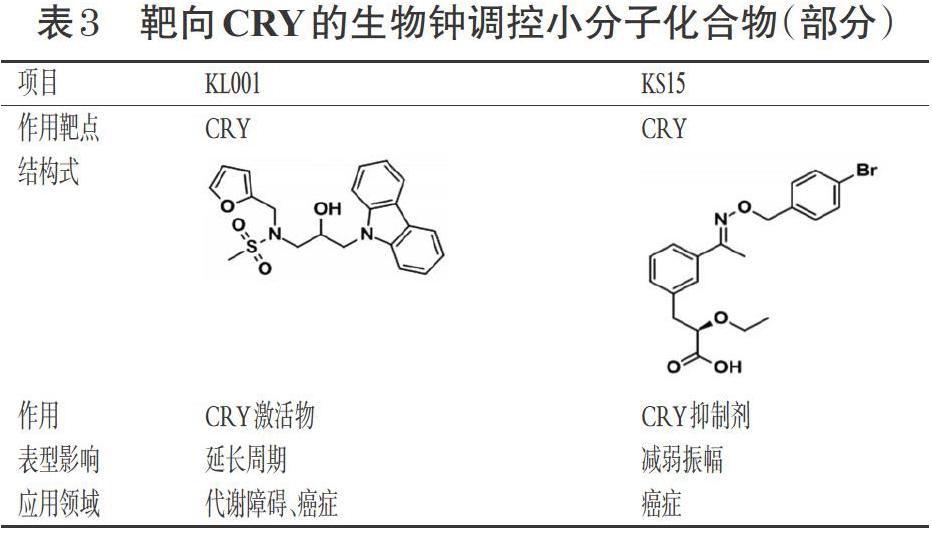
钟蛋白CRY是调控钟基因的核心环路负反馈途径中重要的组成部分,靶向CRY的生物钟调控小分子化合物见表3。
最先被发现的CRY调节物是KL001,它是一种含有甲磺酰胺和呋喃结构的咔唑类化合物[40]。KL001的甲磺酰胺结构可与泛素化相关物质F-box/LRR重复蛋白3(FBXL3)和黄素腺嘌呤二核苷酸(FAD)竞争CRY中FAD口袋处的结合位点,抑制CRY泛素化降解[41]。在胶质母细胞瘤干细胞(GSCs)中,KL001增强了CRY稳定性和CRY-PER蛋白复合体对CLOCK-BMAL1异二聚体的抑制作用,从而减少了关键钟基因的表达,使患者GSCs发生了周期停滞,引起其凋亡增加[42]。口服KL001衍生物(Compound50、KL004)可延长GSCs移植小鼠的生存时间,提示KL001衍生物可能对肿瘤有抑制作用,同时也表明CRY蛋白对节律相关疾病的重要作用,为相关疾病的药物开发提供了重要的靶点[42-43]。构效关系研究表明,KL001的咔唑基是其保持活性的关键结构,此外含有甲烷磺酰胺和呋喃结构的KL001也比含有乙酰胺和氯氰基苯基的KL044效果强10倍[44]。
通过表型筛选法确定了另一种CRY抑制剂——KS15。结合生物素的KS15能阻断CRY对CLOCK- BMAL1异二聚体的抑制作用,在激活部分钟控基因表达的同时可减弱细胞节律的振幅[45]。 Chun 等[46]对人乳腺癌MCF-7细胞的研究发现,KS15可上调凋亡基因和细胞周期调节因子(如p53和Bax)的表达量,并表现出对肿瘤细胞的抗增殖和促凋亡特性,但并不降低非癌细胞MCF-10A的活性。对KS15的构效关系分析确定了其抑制CRY的关键位点,但其与CRY相互作用的分子机制仍不清楚[45]。
3.4 靶向CLOCK
CLOCK是调控钟基因的转录-翻译反馈环路中重要的组成部分,其含量和活性显著影响生物钟的稳定性和振幅强度[3]。靶向CLOCK的生物钟调控小分子化合物详见表4。
对CLOCK-BMAL1异二聚体的晶体结构研究发现,这两种关键钟蛋白通过相似的结构域(bHLH、PAS-A、PAS-B)结合,形成3个蛋白质-蛋白质接口以完成稳定的相互作用,这也为各种小分子化合物的结合提供了可能。目前,CLK8是唯一鉴定出的靶向CLOCK的小分子化合物。分子对接研究发现,CLK8可与CLOCK蛋白的bHLH和PAS-A结构域结合,从而减弱CLOCK和BMAL1的相互作用,并影响CLOCK蛋白的亚细胞定位,使其在细胞核内的含量降低;同时CLK8可减弱转录-翻译反馈环路中正反馈环路的作用,却不影响负反馈环路中CRY和PER的含量,导致生物节律振幅增强,但其具体机制仍不清楚[47]。CLK8作为一种新型生物钟调节物,对于治疗由病理情况或衰老引起的振幅衰减具有潜在意义,并且已证明核心钟蛋白CLOCK是具有潜力的调控靶点,这也为钟基因相关疾病的治疗提供了更多的可能性。
4 結语
生物钟失调参与了睡眠障碍、代谢紊乱、癌症等多种疾病的发生、发展,而小分子化合物能通过调控钟基因的表达影响生物钟,从而改善病变机体的生理功能,具有治疗生物钟失调相关疾病的潜力[2-3]。蛋白激酶、核受体(REV-ERB、ROR)、CRY、CLOCK等在维持和调控生物节律中有着重要的作用,可作为小分子化合物的作用靶点。目前,鉴定出的小分子调节物大多缺乏针对不同亚型钟蛋白的选择性,这使得对钟蛋白的精确调控存在困难。另外,对BMAL1和PERs等关键钟蛋白的调节物的研究仍处于盲区,还有待于对蛋白晶体结构的深入探索和进一步的靶向筛选鉴定。而对已知调控生物钟的小分子化合物,进一步的修饰与改造、优化其药动学特性、减轻其不良反应,是该领域重要的研究方向。目前,对大多数小分子调节物质的研究仍停留在基础实验阶段,对于已在动物模型上显示出良好治疗效果和药学特性的生物钟调节化合物也需进入其下一阶段的临床试验。
参考文献
[ 1 ] 王晗.生物钟生物学及其研究进展[J].生命科学,2015,27(11):1313-1319.
[ 2 ] 郭金虎,徐璎,张二荃,等.生物钟研究进展及重要前沿科学问题[J].中国科学基金,2014,28(3):179-186.
[ 3 ] MILLER S,HIROTA T. Pharmacological interventions to circadian clocks and their molecular bases[J]. J Mol Biol,2020,432(12):3498-3514.
[ 4 ] CHEN Z,YOO S H,TAKAHASHI J S. Development and therapeutic potential of small-molecule modulators of circadian systems[J]. Annu Rev Pharmacol Toxicol,2018,58(1):231-252.
[ 5 ] ZHANG Y,FANG B,EMMETT M J,et al. Discrete functions of nuclear receptor Rev-erbalpha couple metabolism to the clock[J]. Science,2015,348(6242):1488-1492.
[ 6 ] YOSHITANE H,ASANO Y,SAGAMI A,et al. Functional D-box sequences reset the circadian clock and drive mRNA rhythms[J]. Commun Biol,2019,2:300.
[ 7 ] MORISHITA Y,MIURA D,KIDA S. PI3K regulates BMAL1/CLOCK-mediated circadian transcription from the Dbp promoter[J]. Biosci Biotechnol Biochem,2016,80(6):1131-1140.
[ 8 ] YU X,ZECHARIA A,ZHANG Z,et al. Circadian factor BMAL1 in histaminergic neurons regulates sleep architecture[J]. Curr Biol,2014,24(23):2838-2844.
[ 9 ] TANOUE S,FUJIMOTO K,MYUNG J,et al. DEC2- E4BP4 heterodimer represses the transcriptional enhancer activity of the EE element in the Per2 promoter[J]. Front Neurol,2015,6:166.
[10] MAUVOISIN D. Circadian rhythms and proteomics:its all about posttranslational modifications[J]. Wiley Interdiscip Rev Syst Biol Med,2019,11(5):e1450.
[11] LEE H,LEE J W. The roles of CKⅠ in circadian rhythm[J]. Future Med Chem,2019,11(20):2621-2624.
[12] XING W,BUSINO L,HINDS T R,et al. SCF(FBXL3) ubiquitin ligase targets cryptochromes at their cofactor pocket[J]. Nature,2013,496(7443):64-68.
[13] KALMBACH D A,ANDERSON J R,DRAKE C L. The impact of stress on sleep:pathogenic sleep reactivity as a vulnerability to insomnia and circadian disorders[J]. J Sleep Res,2018,27(6):e12710.
[14] HIROTA T,LEWIS W G,LIU A C,et al. A chemical bio- logy approach reveals period shortening of the mammalian circadian clock by specific inhibition of GSK-3β[J]. Proc Natl Acad Sci USA,2008,105(52):20746-20751.
[15] ESTRELLA M A,DU J,KORENNYKH A. Crystal structure of human nocturnin catalytic domain[J]. Sci Rep,2018,8(1):16294.
[16] HIROTA T,LEE J W,LEWIS W G,et al. High-throughput chemical screen identifies a novel potent modulator of cellular circadian rhythms and reveals CKⅠalpha as a clock regulatory kinase[J]. PLoS Biol,2010,8(12):e1000559.
[17] LEE J W,HIROTA T,ONO D,et al. Chemical control of mammalian circadian behavior through dual inhibition of casein kinase Ⅰα and β[J]. J Med Chem,2019,62(4):1989-1998.
[18] KON N,SUGIYAMA Y,YOSHITANE H,et al. Cell- based inhibitor screening identifies multiple protein kina- ses important for circadian clock oscillations[J]. Commun Integr Biol,2015,8(4):e982405.
[19] VARGHESE R T,YOUNG S,PHAM L,et al. Casein kinase 1 epsilon regulates glioblastoma cell survival[J]. Sci Rep,2018,8(1):13621.
[20] CHEN X,LI C,WANG D,et al. Recent advances in the discovery of CK2 allosteric inhibitors:from traditional screening to structure-based design[J]. Molecules,2020,25(4):870.
[21] QIAO Y,CHEN T,YANG H,et al. Small molecule modulators targeting protein kinase CK1 and CK2[J]. Eur J Med Chem,2019,181:111581.
[22] OSHIMA T,NIWA Y,KUWATA K,et al. Cell-based screen identifies a new potent and highly selective CK2 inhibitor for modulation of circadian rhythms and cancer cell growth[J]. Sci Adv,2019,5(1):eaau9060.
[23] REISCHL S,KRAMER A. Kinases and phosphatases in the mammalian circadian clock[J]. Febs Lett,2011,585(10):1393-1399.
[24] MOORE S F,VAN DEN BOSCH M T,HUNTER R W, et al. Dual regulation of glycogen synthase kinase 3 (GSK3)α/β by protein kinase C(PKC)α and Akt promotes thrombin-mediated integrin αⅡbβ3 activation and granule secretion in platelets[J]. Biol Chem,2013,288(6):3918-3928.
[25] BEUREL E,GRIECO S F,JOPE R S. Glycogen synthase kinase-3 (GSK3):regulation,actions,and diseases[J].Pharmacol Ther,2015,148:114-131.
[26] MINAMI Y,OISHI I,ENDO M,et al. ROR-family receptor tyrosine kinases in noncanonical Wnt signaling:their implications in developmental morphogenesis and human diseases[J]. Dev Dyn,2010,239(1):1-15.
[27] STRICKER S,RAUSCHENBERGER V,SCHAMBONY A. ROR-family receptor tyrosine kinases[J]. Curr Top Dev Biol,2017,123:105-142.
[28] GRANT D,YIN L,COLLINS J L,et al. GSK4112,a small molecule chemical probe for the cell biology of the nuclear heme receptor Rev-erbalpha[J]. Acs Chem Biol,2010,5(10):925-932.
[29] CHEN H,ISAYAMA K,KUMAZAWA M,et al. Integration of the nuclear receptor REV-ERBalpha linked with circadian oscillators in the expressions of Alas1,Ppargc1a,and Il6 genes in rat granulosa cells[J]. Chronobiol Int,2015,32(6):739-749.
[30] CHU G,ZHOU X,HU Y,et al. Rev-erbα inhibits proliferation and promotes apoptosis of preadipocytes through the agonist GSK4112[J]. Int J Mol Sci,2019,20(18):4524.
[31] DIERICKX P,EMMETT M J,JIANG C,et al. SR9009 has REV-ERB-independent effects on cell proliferation and metabolism[J]. Proc Natl Acad Sci USA,2019,116(25):12147-12152.
[32] ZHANG T,ZHAO M,LU D,et al. REV-ERBα regulates CYP7A1 through repression of liver receptor Homolog-1[J]. Drug Metab Dispos,2018,46(3):248-258.
[33] LEE J,KIM D E,GRIFFIN P,et al. Inhibition of REV- ERBs stimulates microglial amyloid-beta clearance and reduces amyloid plaque deposition in the 5XFAD mouse model of Alzheimers disease[J]. Aging Cell,2020,19(2):e13078.
[34] DE MEI C,ERCOLANI L,PARODI C,et al. Dual inhibition of REV-ERBβ and autophagy as a novel pharmacological approach to induce cytotoxicity in cancer cells[J]. Oncogene,2015,34(20):2597-2608.
[35] KOJETIN D J,BURRIS T P. REV-ERB and ROR nuclear receptors as drug targets[J]. Nat Rev Drug Discov,2014,13(3):197-216.
[36] HELLEBOID S,HAUG C,LAMOTTKE K,et al. The identification of naturally occurring neoruscogenin as a bioavailable,potent,and high-affinity agonist of the nuc- lear receptor RORalpha (NR1F1)[J]. J Biomol Screen,2014,19(3):399-406.
[37] HE B,NOHARA K,PARK N,et al. The small molecule nobiletin targets the molecular oscillator to enhance circadian rhythms and protect against metabolic syndrome[J]. Cell Metab,2016,23(4):610-621.
[38] HUANG H,LI L,SHI W,et al. The multifunctional effects of nobiletin and its metabolites in vivo and in vitro[J/OL].Evid Based Complement Alternat Med,2016[2020-06-02].https://pubmed.ncbi.nlm.nih.gov/27761146/. DOI:10.1155/ 2016/2918796.
[39] MULVIHILL E E,BURKE A C,HUFF M W. Citrus flavonoids as regulators of lipoprotein metabolism and atherosclerosis[J]. Annu Rev Nutr,2016,36:275-299.
[40] LEE J W,HIROTA T,KUMAR A,et al. Development of small-molecule cryptochrome stabilizer derivatives as modulators of the circadian clock[J]. Chem Med Chem,2015,10(9):1489-1497.
[41] MILLER S,AIKAWA Y,SUGIYAMA A,et al. An isoform-selective modulator of cryptochrome 1 regulates circadian rhythms in mammals[J]. Cell Chem Biol,2020,27(9):1192-1198.
[42] DONG Z,ZHANG G,QU M,et al. Targeting glioblastoma stem cells through disruption of the circadian clock[J]. Cancer Discov,2019,9(11):1556-1573.
[43] HUMPHRIES P S,BERSOT R,KINCAID J,et al. Carbazole-containing amides and ureas:discovery of cryptochrome modulators as antihyperglycemic agents[J]. Bioorg Med Chem Lett,2018,28(3):293-297.
[44] OSHIMA T,YAMANAKA I,KUMAR A,et al. C-hactivation generates period-shortening molecules that target cryptochrome in the mammalian circadian clock[J]. Angew Chem Int Ed Engl,2015,54(24):7193-7197.
[45] JANG J,CHUNG S,CHOI Y,et al. The cryptochrome inhibitor KS15 enhances E-box-mediated transcription by disrupting the feedback action of a circadian transcription-repressor complex[J]. Life Sci,2018,200:49-55.
[46] CHUN S K,CHUNG S,KIM HD,et al. A synthetic cryptochrome inhibitor induces anti-proliferative effects and increases chemosensitivity in human breast cancer cells[J]. Biochem Biophys Res Commun,2015,467(2):441-446.
[47] DORUK Y U,YARPARVAR D,AKYEL Y K,et al. A clock-binding small molecule disrupts the interaction between CLOCK and BMAL1 and enhances circadian rhythm amplitude[J]. J Biol Chem,2020,295(11):3518- 3531.
(收稿日期:2020-06-05 修回日期:2021-01-02)
(編辑:罗 瑞)
