云南4个湖泊浮游生物碳、氮稳定同位素的季节变化及其影响因子*
2021-05-10陈子栋黄林培刘园园陈小林陈光杰
陈子栋,黄林培,陈 丽,梁 红,刘园园,陈小林,张 涛,陈光杰
(云南省高原地理过程与环境变化重点实验室,云南师范大学地理学部,昆明 650500)
稳定同位素示踪方法已成为识别生态系统结构与功能的重要研究手段之一,有助于揭示生态系统中食物网结构、碳氮元素循环及其与环境的关系[1-3]. 水域生态系统中,碳稳定同位素(δ13C)常用于识别有机质来源[4]、指示初级生产力变化[5]、示踪有机碳在食物网的迁移路径与转化过程[6-7]. 氮稳定同位素(δ15N)可以示踪污染物的来源及其组成[8],能够反映氮素利用和分馏过程[9],是定量评价食物网营养结构与氮循环的重要方法[10]. 湖泊作为内陆水体的重要组成,其生物地球化学循环过程与湖泊类型、流域开发程度等密切相关. 近几十年,受全球变暖和人类活动的双重影响,越来越多的湖泊水体出现面积萎缩、富营养化加剧、生态系统退化和物种多样性降低等特征,显著改变了湖泊碳、氮元素地球化学循环的时空模式[11].
浮游植物作为重要的初级生产者,在湖泊生态系统的能量流动和物质循环中起着关键作用[12]. 浮游动物作为湖泊生态系统的异养生物,又是高营养级消费者的捕食对象,位于食物链的重要环节[13]. 同时,浮游植物和浮游动物具有生长速度快、周转率高且对外界环境变化敏感等特征,其δ13C、δ15N值能够快速响应湖泊水体环境与食物来源的波动[5,14]. 然而,由于湖泊浮游生物样品的纯化提取难度较大,国内主要集中于水体悬浮颗粒有机物(POM)δ13C、δ15N值的时空变化研究[4,15]. Gu[16]和Xu等[17]对全球多个湖泊POM的空间调查发现,不同类型湖泊中δ13CPOM和δ15NPOM分布模式有较大差异,陆源营养盐负荷的影响显著. 王静等[9]对贵州两个湖泊δ15NPOM的季节波动及水体剖面上的垂直变化进行研究,揭示了湖泊内部氮源变换及生物地球化学作用的影响. 滇东湖泊[18]及热带地区水库[19]的研究表明,浮游动物δ13C、δ15N值变化趋势与浮游植物和POM的相似,具有明显的时空模式,反映了食物来源时空变化的驱动作用. 目前,针对云南湖泊浮游植物、浮游动物碳、氮稳定同位素的研究仍然不足,在云南地区湖泊类型多样、季风气候明显的背景下,需系统识别浮游生物δ13C、δ15N值的季节特征与区域模式,明确不同湖泊类型下影响生物地球化学循环的关键因子.
本文以湖泊水深和营养水平具有差异的4个云南湖泊(抚仙湖、阳宗海、长桥海和大屯海)为研究对象,通过对浮游植物和浮游动物δ13C、δ15N值的季节变化,探讨季节尺度上浮游生物碳、氮稳定同位素对环境因子的响应模式及其与湖泊类型的关系,有助于认识云南高原湖泊生物地球化学循环的时空特征、关键过程及其影响因子,为湖泊治理及生态评价提供重要的科学依据.
1 材料与方法
1.1 研究区概况
研究区位于云南中部和东南部,抚仙湖(24°17′~24°37′N,102°49′~102°57′E)、阳宗海(24°01′~24°58′N,102°59′~103°02′E)位于滇中地区,为典型高原构造断陷型深水湖泊. 长桥海(23°26′6″N,103°22′12″E)、大屯海(23°25′38″N,103°18′39″E)为滇东南地区蒙自盆地中天然发育的浅水湖泊(图1). 研究区气候类型为亚热带高原季风气候[20],旱季和雨季分明. 滇中(昆明、玉溪)和滇东南(蒙自)地区3个站点的降水数据(数据来自中国气象数据网 http://data.cma.cn)表明(表1),2017年6月-2018年5月期间,降水量主要集中于6-10月,占全年降水量的85%,其中6、9月平均降水量分别为213和104 mm,12、3月降水量显著减少,平均约为14和42 mm.
抚仙湖与阳宗海为大型深水湖泊,湖泊水体单季混合. 抚仙湖5-9月湖水分层,10月以后湖泊水体混合作用逐渐加强,冬、春季处于混合状态[21]. 阳宗海6-9月水体分层,10月中旬温跃层厚度变薄,12月份温跃层消失,湖水混合[22]. 长桥海、大屯海为小型浅水湖泊,湖水全年处于混合状态. 抚仙湖近些年沿岸开发较快,湖水水质逐渐受影响;阳宗海于2008年砷污染事件后,目前处于综合治理和生态修复阶段[23]. 长桥海和大屯海由于人类活动强烈,过度养殖、开发程度高以及建筑堤坝使得湖面萎缩,逐渐成为水库型湖泊[24].
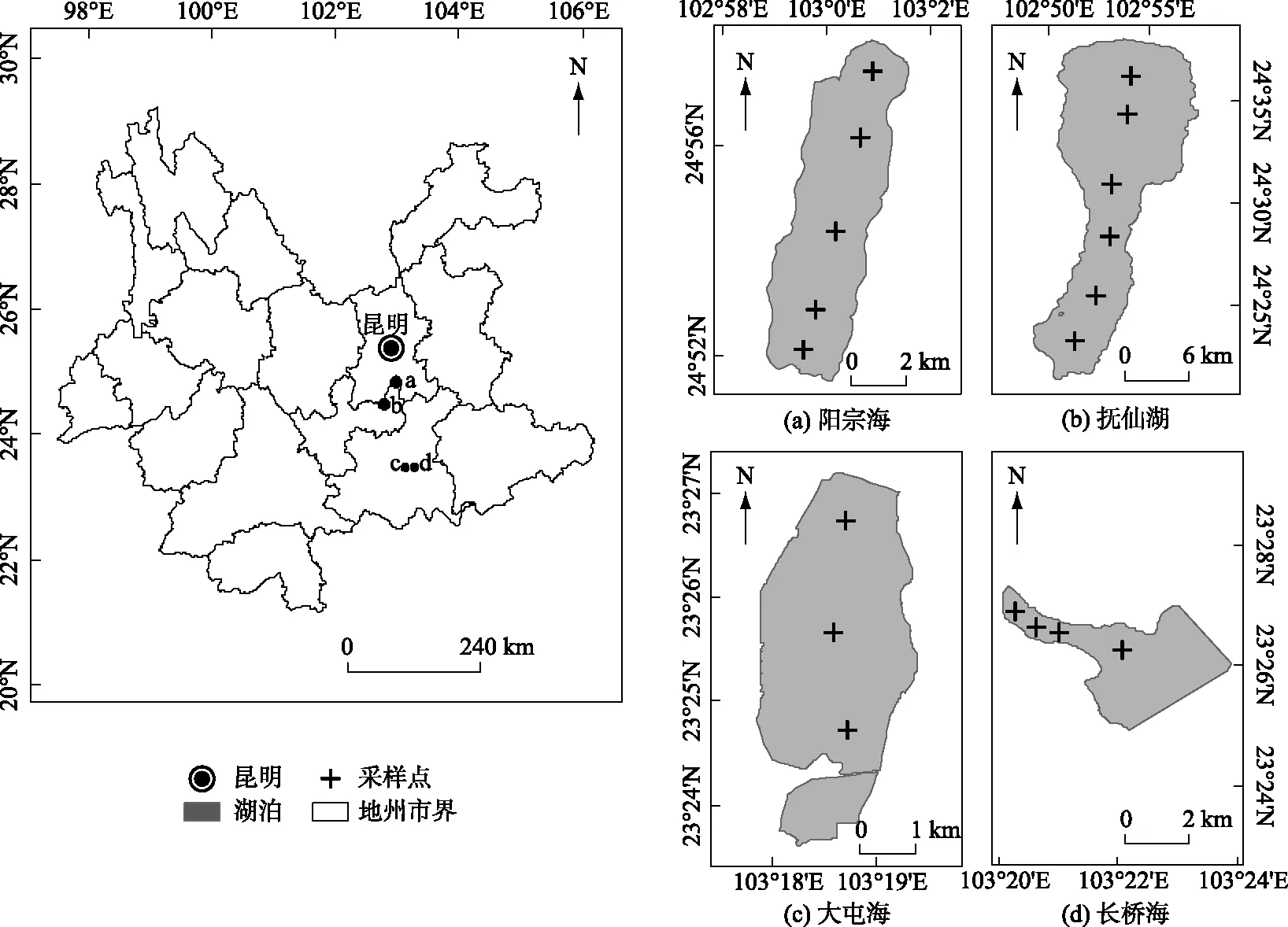
图1 研究区域与湖泊采样点分布Fig.1 Location of four study lakes and sampling sites within each lake

表1 湖泊和流域基本信息[20]
1.2 样品采集与处理
根据湖泊大小及其形态特征,在抚仙湖和阳宗海(大型深水湖泊)分别设置6和5个采样点,在长桥海和大屯海(小型浅水湖泊)分别设置4和3个采样点(图1). 分别于2017年6、9、12月、2018年3月对4个湖泊开展水质样品和浮游生物样品采集工作,共采集144个样品. 在每个采样点,使用多参数水质分析仪(美国Xylem公司,型号YSI6600V2)测定水体温度(WT)、表层水体pH值等水质参数,使用塞氏盘和测深仪分别测定水体透明度(SD)和水深(Depth). 用采水器采集1 L表层水质样品,4℃低温保存并带回实验室,总磷(TP)、总氮(TN)、叶绿素a(Chl.a)浓度等水质理化指标均参照《水与废水监测分析方法》进行测定[25].
基于浮游植物和浮游动物个体大小差异,浮游生物同位素样品先使用22和64 μm的浮游生物网在湖泊表层0~2 m拖曳采集,再分别经64和250 μm的网筛过滤,获得浮游植物(22~64 μm)和浮游动物(>250 μm)样品. 采集完成后置于4℃保温箱中冷藏保存. 在室内,向浮游生物样品中加入10%稀盐酸进行酸化处理,静置24 h以去除样品中无机碳,酸化后样品用去离子水清洗至中性. 将浮游生物样品置于玻璃皿中,在体视显微镜下用细胞夹、解剖针和胶头滴管挑出杂质. 经镜下鉴定,抚仙湖浮游植物样品以绿藻和硅藻占优,阳宗海、长桥海和大屯海均以蓝藻为主;4个湖泊中,大型浮游动物(>250 μm)均以桡足类和枝角类占优. 样品处理完成后放入冻干机(意大利EYELA公司,型号FDU-1110),在-50℃下冻干至恒重,用锡杯包好待测.
1.3 碳、氮稳定同位素分析及数据处理
碳、氮稳定同位素比值使用气体同位素比质谱仪(美国Thermo Scientific公司,型号MAT-253)联用Flash EA元素分析仪,采用快速燃烧法测定. 稳定同位素组成以国际通用的δ值表示,其定义为:
(1)
式中,X表示13C或15N,Rsample为样品13C/12C或15N/14N,Rstandard为标样13C/12C或15N/14N,分析精度<0.1‰. 样品测试在云南省高原地理过程与环境变化重点实验室完成.
本文结果中数据为平均值±标准差,统计分析前均对数据进行正态分布检验,应用Student’st-test检验方法进行差异显著性检验,统计分析与制图在R(3.5.1)和Grapher 12软件中完成.
2 结果
2.1 主要水质参数的季节变化特征
4个湖泊表层水温均呈现明显的季节变化,夏、秋季水温显著高于冬、春季(图2). 抚仙湖、阳宗海6月与9月表层水体水温相近,平均值为(23.09±1.70)℃,略低于长桥海和大屯海(25.77±0.98)℃;在12与3月,4个湖泊的表层水温均下降明显,平均值为(15.96±1.18)℃. 抚仙湖和阳宗海湖水pH值季节变化与水温一致,夏、秋季(9.03±0.14)高于冬、春季(8.67±0.31). 长桥海和大屯海湖水pH值季节变化不明显,全年pH平均值分别为8.66±0.20和8.41±0.25. 抚仙湖和阳宗海采样点水深全年变化不大,长桥海与大屯海同一采样点的水深在6月较浅,而在9月达到最大值.
根据湖泊营养状况分级标准[26],本次调查期间抚仙湖为贫营养湖泊、阳宗海为中营养湖泊,长桥海、大屯海为富营养湖泊. 4个湖泊的水体Chl.a浓度季节变动较大,全年Chl.a浓度平均值分别为(7.48±3.64)μg/L(抚仙湖)、(13.54±7.10)μg/L(阳宗海)、(73.56±28.04)μg/L(长桥海)以及(108.37±30.18)μg/L(大屯海). 4个湖泊中抚仙湖的营养水平较低,TP浓度在3月((46.05±16.32)μg/L)显著高于其他月份,TN浓度则在12月最高((546.26±20.62)μg/L). 阳宗海TP、TN浓度在12月达到最高值,分别为(39.56±7.77)μg/L和(1131.71±239.88)μg/L,水体SD冬、春季大于夏、秋季. 长桥海3月TP浓度最高((143.01±24.38)μg/L),9月TN浓度最高((3354.86±482.41)μg/L). 大屯海TP、TN浓度为4个湖泊中最高,均在6月达到最高值,分别为(171.78±46.96)μg/L和(4025.45±438.47)μg/L. 长桥海与大屯海的SD在6月最低,特别是大屯海,6月份SD仅为(0.27±0.12)m,显著小于其余季节((0.46±0.07)m).
2.2 浮游植物和浮游动物碳、氮稳定同位素的季节变化特征
4个湖泊浮游生物δ13C、δ15N均呈现明显的季节变化特征,但不同类型湖泊间存在差异(图3). 6、9月营养水平较低的大型深水湖泊浮游植物δ13C值为-20.34‰±1.98‰,显著高于12、3月(-28.00‰±2.51‰,P<0.001). 而营养水平较高的小型浅水湖泊浮游植物δ13C值在6月最高(-21.24‰±0.88‰),9、12、3月δ13C 值较低,分别为-27.84‰±1.41‰、-25.77‰±0.19‰和-25.15‰±2.16‰.
在氮同位素方面,抚仙湖浮游植物δ15N值最小,全年平均值为5.09‰±0.83‰,其中3月(6.25‰±0.19‰)显著高于其他月份(P<0.01). 阳宗海浮游植物δ15N平均值为8.66‰±2.79‰,最大值出现在3月(11.84‰±0.40‰). 长桥海浮游植物δ15N值季节变化范围为10.64‰~14.06‰(年平均值为11.61‰±1.64‰),3月显著高于6、9、12月(P=0.01). 大屯海浮游植物δ15N值季节变幅最大(年平均值为10.85‰±6.24‰),从6月(5.43‰±1.64‰)开始递增上升到次年3月(19.80‰±4.99‰). 总体而言,4个湖泊浮游植物δ15N值均在3月达到最高,且显著高于其余3个月份(P<0.05).

图2 4个高原湖泊7个主要水环境指标的季节特征Fig.2 Seasonal variation of seven key water quality parameters in four plateau lakes
浮游动物δ13C值的季节变化趋势与浮游植物较为一致(图3),除抚仙湖(P=0.04),其余3个湖泊浮游动物与浮游植物全年δ13C值均无显著差异(P>0.05). 4个湖泊浮游动物δ15N值则显著高于浮游植物(P<0.05).
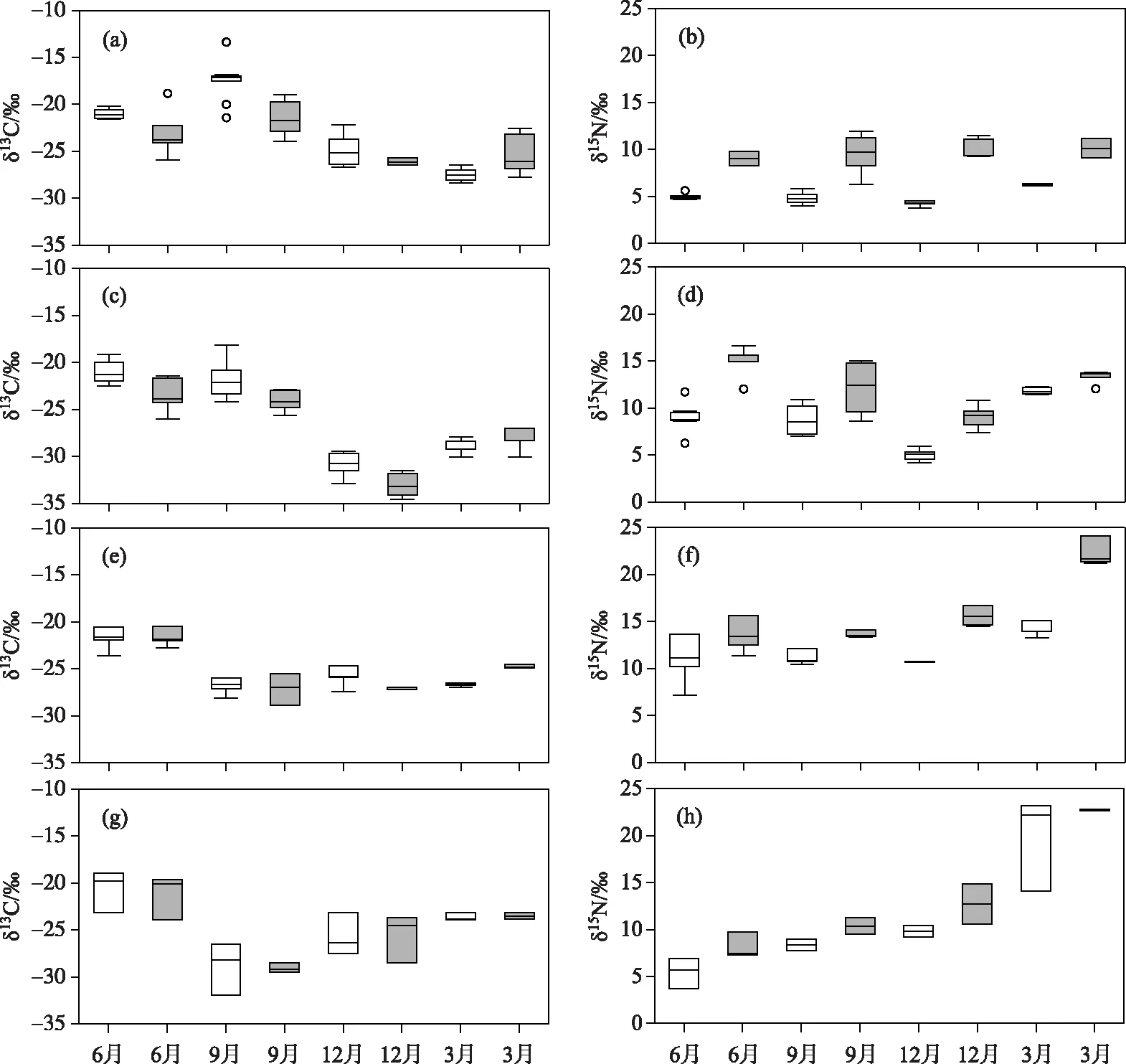
图3 4个湖泊不同月份浮游植物和浮游动物碳、氮稳定同位素的分布特征 (白色箱线图代表浮游植物,灰色箱线图代表浮游动物. a、b:抚仙湖;c、d:阳宗海;e、f:长桥海;g、h:大屯海)Fig.3 Boxplots showing seasonal distribution of carbon and nitrogen stable isotopes of phytoplankton and zooplankton at four lakes in different months (The white and gray boxplots indicate phytoplankton and zooplankton, respectively. a, b: Lake Fuxian; c, d: Lake Yangzong; e, f: Lake Changqiao; g, h: Lake Datun)
2.3 浮游动物与浮游植物碳、氮稳定同位素的相互关系
4个湖泊的数据对比表明,浮游动物与浮游植物的δ13C、δ15N值具有显著的正相关关系(R2=0.59,P<0.001;R2=0.73,P<0.001)(图4). 在浮游动物与浮游植物的同位素差值(富集度)分布频率上,富营养浅水湖泊浮游生物δ13C、δ15N均具有更小的富集度分布特征(图5). 营养水平较低的大型深水湖泊中,浮游生物δ13C富集度绝对值分布于0~7‰区间,0~2‰区间分布频数占46%,偏态系数为0.59,全年平均富集度为2.60‰±0.98‰,其中6、9、12月富集度较大,平均值为3.02‰±2.14‰,3月富集度小,为1.67‰±1.65‰. 营养水平较高的小型浅水湖泊中,浮游生物δ13C富集度绝对值集中分布于0~4‰区间,0~2‰区间分布频数占69%,偏态系数为0.98,全年平均富集度为1.61‰±0.90‰. 浮游生物δ15N富集度方面,营养水平较低的大型湖泊中偏态系数为-0.35(负偏分布),47%落在4‰~6‰区间,平均值为4.19‰±1.25‰. 营养水平较高的小型湖泊中偏态系数为0.77(正偏分布),0~4‰区间出现频率为64%,平均值为3.62‰±2.19‰,其中3月δ15N富集度为6.35‰±2.50‰,显著高于其余月份(2.71‰±1.22‰,P<0.05).

图4 4个湖泊浮游植物和浮游动物碳(a)、氮(b)稳定同位素散点图Fig.4 Scatter plot of carbon (a) and nitrogen (b) stable isotopes of phytoplankton and zooplankton in four lakes

图5 浮游动物与浮游植物稳定同位素富集度直方图(a、c:大型深水湖泊;b、d:小型浅水湖泊)Fig.5 Histogram showing stable isotope differences between zooplankton and phytoplankton (a, c: large deep lakes; b, d: small shallow lakes)
2.4 浮游生物碳、氮稳定同位素比值与环境因子的关系
不同类型湖泊中,浮游生物δ13C值的影响因素并不相同(图6). 大型深水湖泊(抚仙湖和阳宗海)浮游植物、浮游动物δ13C值季节变化与湖泊表层水温(R2=0.75和0.54,P<0.001)、pH(R2=0.49和0.40,P<0.001)、降水量(R2=0.37和0.32,P<0.001)呈显著正相关关系. 小型浅水湖泊(长桥海和大屯海)浮游植物、浮游动物δ13C值季节变化则与降水量(R2=0.32,P<0.01;R2=0.15,P<0.05)呈正相关,与SD(R2=0.31,P<0.01;R2=0.41,P<0.001)和采样点水深(R2=0.25,P<0.01;R2=0.14,P<0.05)呈负相关关系(图6). 总体上,浮游植物δ13C值与环境因子之间的决定系数高于浮游动物. 在氮同位素方面,湖泊浮游生物δ15N值的季节变化与湖泊营养水平指标(TN、TP)呈弱相关或无显著相关关系(图7).

图6 不同类型湖泊浮游植物碳稳定同位素与环境因子的相关性Fig.6 Correlation between carbon stable isotope of phytoplankton and environmental factors in different types of lakes

图7 不同湖泊中浮游植物氮稳定同位素与水体总氮、总磷浓度的相关性 (a、b:大型深水湖泊;c、d:小型浅水湖泊)Fig.7 Correlation between nitrogen stable isotope of phytoplankton and total nitrogen, total phosphorus concentrations in different lakes (a, b: large deep lakes; c, d: small shallow lakes)
3 讨论
3.1 浮游生物碳稳定同位素季节变化的影响因子识别
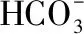
小型浅水湖泊中,浮游生物δ13C值的季节变化与SD、降水量和采样点水深相关. SD通常与藻类生物量呈负相关[35],然而在季节尺度上,长桥海和大屯海这一变化规律并不显著(P>0.05). 长桥海和大屯海6月SD最低,而长桥海6月Chl.a浓度最小,大屯海的Chl.a水平虽然在6月最高,但是相较Chl.a浓度接近的12月,SD却有很大差异(图2). 因此,研究区小型浅水湖泊SD的季节变化与藻类生物量无关. 长桥海和大屯海集水面积与湖泊面积之比分别为15.61和23.07,显著高于两个大型深水湖泊(表1),指示雨季大量流域物质的输入可能是影响小型湖泊水体SD的主要原因. 同时长桥海和大屯海湖水为主要工农业用水,雨季初期正是农业灌溉用水的主要时期,采样点水深反映湖泊水位在雨季不升反降,表明湖水被大量用于灌溉,湖面积萎缩,集水面积/湖泊面积比值进一步增加,导致夏季浮游植物样品中陆源有机质占比增加,δ13C值升高.
3.2 浮游生物氮稳定同位素的季节性特征
此次调查的4个湖泊在水体营养水平、水深及湖泊面积有着明显不同,但浮游生物δ15N值在春季(3月)均显著高于其他季节. 前人研究表明,固氮蓝藻的固氮作用是影响藻类δ15N值的主要原因之一[5,36]. 然而,抚仙湖浮游植物生物量以绿藻和硅藻占优[37-38]. 阳宗海、长桥海和大屯海虽然蓝藻生物量高[22,38-39],但TN∶TP比值高(图2),固氮蓝藻异形胞并不发育[38],对浮游生物δ15N值季节变化影响不大. 云南地区季节性氮营养盐的来源上存在较大差异,雨季期间,流域土壤流失严重,δ15N值较低的农业化肥[40]、陆源有机质[41]通过面源污染方式输入湖泊;旱季期间入湖河流水流下降,生活污水负荷增加,此时氮主要来源于富集15N的生活污水[42]等点源污染.面源污染和点源污染作为云南湖泊不同季节主要污染方式,其δ15N值[40-42]与云南湖泊浮游植物δ15N值的季节变化相一致,可能通过生物吸收作用影响了浮游生物δ15N值的季节模式. 12月份虽为旱季,但湖泊仍然受到来自雨季输入的亏损15N的营养盐影响,δ15N值上升不明显,并且冬季温度低浮游植物生长缓慢,15N亏损[43],个别湖泊如阳宗海,浮游生物δ15N值反而下降. 3月为旱季的中晚期,雨季输入的营养盐影响已非常弱,且温度回升,浮游植物生长速率变快,15N在生物体内富集[43],造成浮游植物δ15N值达到全年最高. 因此,雨季面源污染为主向旱季点源污染为主的季节转变是造成云南湖泊浮游生物δ15N值季节性变化的主要影响因素.
3.3 湖泊类型与浮游生物碳、氮稳定同位素富集度的关系
4个湖泊浮游动物与浮游植物的δ13C、δ15N值具有显著相关关系(图4),表明浮游植物是浮游动物的主要食物来源. 然而,不同类型湖泊浮游生物碳、氮稳定同位素富集度呈现不同分布特征(图5),指示浮游动物对浮游植物作为食物的依赖程度有所不同.
在浮游动物与浮游植物δ13C富集度方面,营养水平较低的大型深水湖泊具有更高的δ13C富集度以及更大范围的富集度分布特征(图5). 由于营养水平较低的湖泊初级生产力低,陆源有机质对食物网的贡献总体较高. 前人研究表明,在贫营养湖泊,陆源有机质对湖泊的贡献可高达75%[44]. 由于陆源有机质同位素与内源浮游植物同位素存在差异[45-46],导致营养水平低的湖泊中浮游动物由于摄入陆源有机质而与浮游植物δ13C值相异性增大,并且这种相异性还表现在季节尺度上. 在6、9、12月,大型深水湖泊浮游动物与浮游植物δ13C富集度较大(3.02‰±2.14‰),表明陆源有机质对食物网的贡献从雨季一直持续到冬季. 3月δ13C值相异性减弱(1.67‰±1.65‰),浮游动物碳源主要受到浮游植物的影响,可能与春季浮游植物群落结构中高质量食物硅藻生物量增加[21]有关. 营养水平较高的小型湖泊,尽管夏季受流域输入影响明显,但全年浮游动物与浮游植物δ13C富集度总体较小,偏态系数达到0.98,表明陆源有机质对富营养湖泊食物网的影响比较有限,富营养湖泊中浮游动物碳源以内源碳(如浮游植物)为主,导致在有机碳传输过程中表现出较强的耦合作用与相近的δ13C值.
浮游生物δ15N富集度在大型深水湖泊为负偏分布、富集度大,而小型浅水湖泊为正偏分布、富集度小(图5). 在营养水平低的湖泊,初级生产力相对较低、食物来源少,导致浮游动物摄食率增加,造成非必需营养物质的额外代谢循环,使得动物组织和食物之间的δ15N富集度增加[47]. 此外,动物细胞内谷氨酸和天冬氨酸之间的转氨作用过程中,14NH2比15NH2快1.0083倍,同样会导致食物缺乏的情况下动物组织15N的增加[48],造成消费者与食物的δ15N差异进一步扩大. 相反,在富营养湖泊中,初级生产力高,食物充足,浮游动物与浮游植物δ15N富集度减小. 然而,4个湖泊浮游生物δ15N富集度最大值出现在富营养湖泊(长桥海和大屯海)的3月,平均值为6.35‰±2.50‰,是其余季节δ15N富集度的两倍,且超过消费者与食物之间δ15N富集系数的一般分布范围(3‰~5‰)[49]. 较大的δ15N富集度表明长桥海和大屯海浮游动物(>250 μm)在春季可能更多地以小型浮游动物作为主要食物来源,导致其营养级位置升高. 剔除长桥海和大屯海3月数据,富营养的小型浅水湖泊浮游动物与浮游植物δ15N富集度为2.71‰±1.22‰,显著低于营养水平较低的大型深水湖泊(4.19‰±1.25‰),表明随湖泊营养水平增加,浮游植物作为主要食物来源充足,相邻营养级之间δ15N富集度降低.
4 结论
1)云南不同类型的湖泊中,浮游生物δ13C值具有明显的季节变化特征,且影响因素有所差异. 大型深水湖泊浮游生物δ13C值在雨季较大,受生长速率、陆源有机质输入及无机碳浓度的季节变化控制. 而小型浅水湖泊浮游生物δ13C值的季节变化则受夏季流域物质输入影响明显.
2)4个湖泊浮游生物δ15N值均在春季显著增大,呈现出一致的季节变化规律,可能反映了云南地区流域污染物来源的季节变化特征,即从雨季的面源污染(农业化肥)为主向旱季的点源污染(生活污水)为主的转变模式.
3)与营养水平较低的湖泊相比,富营养湖泊浮游动物碳源主要受内源碳(如浮游植物)控制,导致有机碳在传输过程中有较强的耦合作用,并且相邻营养级之间总体具有更小的δ15N富集度特征.
