CO2浓度倍增和土壤盐胁迫对藜麦生理特征及产量的影响
2021-05-09杨爱峥李志磊李全峰贺昕瑶
杨爱峥,李志磊,付 强※,李全峰,贺昕瑶
(1. 东北农业大学水利与土木工程学院,哈尔滨 150030;2. 东北农业大学公共管理与法学院,哈尔滨 150030)
0 引 言
随着人类社会经济发展和能源消费的增加,导致温室气体在大气层中不断积累,据政府间气候变化专业委员会(Intergovernmental Panel on Climate Change)统计,二氧化碳(CO2)在大气层中的体积浓度已由工业革命前的310μmol/mol,增加到目前的400μmol/mol,预估21世纪末将达到近800μmol/mol[1-2]。温室效应也随之增强,造成全球气候变暖,影响大气环流,继而改变全球的雨量分布,导致区域性干旱甚至土壤退化和盐碱化[3]。土壤盐碱化对植物造成生理干旱、离子毒害和破坏正常代谢等方面的危害,抑制大多数植物的生长,造成生态系统稳定性和农业综合生产力面临巨大压力[4]。因此,在全球大气CO2浓度不断升高,土壤盐碱化日趋严重的背景下,针对耐盐植物对盐胁迫的生理响应及耐盐调控机制展开研究,就显得十分迫切和重要。
土壤中盐分过高造成土壤渗透势降低,植物细胞渗透势增高,使植物吸收水分和养分困难,严重时导致细胞组织水分外渗[5]。为了减少水分流失,防止脱水,植物关闭气孔,从而降低气孔导度。这将直接导致植物净光合速率的降低,进而减少CO2的固定量,最终导致叶片衰老[6]。此外,在盐胁迫下,脱落酸(Abscisic Acid,ABA)作为主要的植物生长调节剂起着重要的化学信号传递作用。一方面,根、茎的木质部汁液pH值升高,根系ABA含量迅速增加,通过木质部汁液传递到叶片。叶片保卫细胞中不断积累的ABA通过调节压力势和气孔关闭,抑制水分蒸发[7]。另一方面,ABA的信号转导涉及了活性氧(Reactive Oxygen Species,ROS)的生成,大量活性氧急剧增加引起蛋白质、DNA和细胞膜脂的氧化伤害,并最终影响细胞功能和破坏细胞结构[8]。同时,盐碱土壤中大量的Na+和Cl-对植物造成离子毒害作用,引起植物养分不平衡和生理代谢紊乱。高浓度的Na+严重阻碍K+的吸收,扰乱植物体内K+/Na+平衡[9]。此外,高浓度的Cl-抑制植物对NO3-的吸收,从而降低植物体内的氮含量[10]。综上所述,大气中CO2浓度升高引起植物在形态结构和生理上都发生相应的变化,理论上而言,植物净光合速率会显著提升,并伴随着气孔导度和蒸腾速率的降低[11]。但是根据植物光合作用、生长速率和水肥利用效率以及其他特征的差异,不同植物对CO2浓度升高的响应也不同[12]。柴伟玲等[13]研究发现CO2浓度升高能显著提高飞机草总生物量和净光合速率。Perez-Lopez等[14]研究发现,CO2浓度倍增能有效降低植株蒸腾速率、提高植株水势,进而提高植物抗旱性。郑云普等[11]研究表明,不同作物水分利用效率对升高CO2浓度的响应存在明显差异,但大豆等作物在CO2浓度倍增条件下净光合速率没有显著提升。Merilo等[15]发现高浓度CO2诱导植物叶片气孔关闭,造成叶片气孔导度与蒸腾速率显著下降。Zhuang等[16]的研究结果表明CO2浓度升高能改变盐胁迫下植物叶片和根的代谢情况,增加K+吸收,抑制Na+吸收,提高植物耐盐性。然而,迄今为止针对CO2浓度变化对耐盐植物盐胁迫下生长、生理特性的反馈机制研究较少,有必要进行深入的研究。
藜麦是1年生藜科双子叶植物,原产于南美安第斯山脉[17-18]。藜麦是无麸质谷物,富含人体所需的必需氨基酸、矿物质、多不饱和脂肪酸和碳水化合物,其营养和食用价值超过很多谷物,被国际营养学家们称为“营养黄金”[19]。藜麦的营养和经济价值受到世界范围内的关注,越来越多的国家开始种植藜麦,联合国粮农组织(Food and Agriculture Organization of the United Nations,FAO)推荐藜麦为解决世界粮食安全问题最具潜力的农作物[20]。作为耐盐植物,藜麦对盐胁迫的适应能力很强,甚至可以在土壤溶质浓度高达400 mmol/L(相当于海水的浓度)的条件下正常生长。中国于20世纪90年代初就已经引进种植藜麦,但仍对其缺乏深入系统的研究。本研究探讨了盐胁迫下藜麦关键生理参数对CO2浓度倍增的响应,对于科学应对土壤环境变化,提高保障粮食安全能力具有重要意义。
1 材料与方法
1.1 试验材料与设计
人工气候室CO2浓度设定分别为400μmol/mol(CO2常规组)和800μmol/mol(CO2倍增组)。前者模拟目前状况,后者模拟21世纪末状况。
土壤盐胁迫设计2个处理:NaCl浓度为0和400 mmol/L,前者模拟无盐分胁迫状况,后者模拟藜麦能忍耐的强盐分胁迫状况(藜麦耐盐阈值,相当于海水的浓度)。
试验于2018年4—9月在东北农业大学大学水利与土木工程学院人工气候室进行。播种前对藜麦(Chenopodium quinoaWilld.,TiTiCaCa)进行表面消毒,然后放入育苗盆中,每穴5粒种子。四周后将藜麦幼苗移植到花盆中(盆直径20 cm、高25 cm),栽培基质为营养土。移植1周后定苗,每盆保留1株藜麦幼苗。随即将花盆分别放入2间人工气候室,其中1间人工气候室CO2浓度为400μmol/mol,另一间人工气候室CO2浓度为800μmol/mol。
每间人工气候室内,放置12盆,其中6盆为对照组,即无盐分胁迫,NaCl浓度为0,另6盆为盐分胁迫组,土壤NaCl浓度为400 mmol/L。
对于盐胁迫组,当藜麦幼苗长出第5片叶子时(34 d),每天浇NaCl溶液50 mL,浓度每次增加80 mmol/L直至达到设定的400 mmol/L浓度,此后每7 d 分别浇400 mmol/L NaCl溶液1 次(48、55和62 d)。对于对照组,在盐胁迫组浇NaCl时,对照组浇NaCl浓度为0的自来水。
人工气候室的温度白天25 ℃、夜晚18 ℃、光照强度560~680μmol/(m2·s)、光照周期为08:00—20:00、相对湿度40%±5%。
1.2 测定项目与方法
1.2.1 叶片生理指标测定
测定指标取样方法相同:初始采样时间为定苗后1周,即播种后42 d,此后分别在拔节期(49 d)取样1次,花期(56、63 d)取样1次,试验期间共取样4次,每次组内随机选择4盆植株取样。
在取样当日10:00—13:00,选取藜麦植株自上而下第3片完全展开的成熟叶片,利用Li-6400 便携式光合测定系统(LI-COR Inc. Lincoln,Nebraska,USA)测定植物叶片的光合速率和气孔导度,测定前使藜麦叶片处于饱和的光合光量子通量密度(1200μmol/(m2·s)),叶室气温25 ℃,叶室CO2浓度为相应气候室CO2浓度。基于光合速率和气孔导度计算内禀水分利用效率为
式中iWUE为内禀水分利用效率,μmol/mol;Pn为叶片光合速率,μmol/(m2·s);Gs为叶片气孔导度,mmol/(m2·s)。选取藜麦植株自上而下第3片完全展开的成熟叶片,采用植物水分仪(3000 Series Plant Water Status Consoles,Soil Moisture Equipment Corp.,Santa Barbara,CA,USA)测定叶片水势。然后,将取下的叶片用铝箔纸包好放入液氮中,储存在-80℃冰箱中,待进一步测定叶片渗透势和离子含量。将叶片取出解冻15 min后,用植物压汁器直接压榨藜麦叶片汁液到滤纸片上,然后再将滤纸片放到C-52植物渗透压仪(C-52 sample chambers,Wescor Inc.,Logan,UT,USA)中用来测定叶片渗透势,并计算压力势。
式中Ψp为植物压力势,MPa;Ψπ为叶片渗透势,MPa;Ψl为叶片水势,MPa。
取出冷冻的叶片,采用离子色谱法测定叶片中Na+、K+浓度[21]。
1.2.2 产量及其构成因素测定
作物成熟后,测量每盆藜麦植株的株高,同时测其单株百粒质量,最后考种测产量。另外,将每盆植株茎和根在85 ℃下烘干测定干物质量。
1.3 数据统计与分析
采用R version 3.6.3(R Development Core Team,2012)分别进行方差分析和主成分分析,其中方差分析为多因素方差(Multi-way ANOVA),显著水平为0.05。
2 结果与分析
2.1 CO2浓度倍增和土壤盐胁迫对藜麦叶片光合参数的影响
多因素方差分析结果显示,播种后天数、盐胁迫和CO2浓度对叶片Pn、Gs和iWUE均产生显著影响,其中3个因素对Pn产生显著交互作用(表1)。如图1所示,在对照和盐胁迫组中叶片Pn和Gs均随藜麦生长而持续提高,但叶片Pn和Gs增加幅度逐步降低,且这种趋势在CO2浓度为400μmol/mol(常规组)时更加明显。此外,与常规组相比,CO2浓度倍增处理显著提高藜麦叶片Pn,降低叶片Gs。特别是在盐胁迫组中,CO2浓度倍增组叶片Pn比常规组分别高30%(42 d)、22.9%(49 d)、31.6%(56 d)和39.4%(63 d),可见,Pn增加幅度呈现先增加后减少再增加的趋势,但CO2浓度倍增组各取样阶段叶片Pn绝对增加量逐渐降低;与此同时,在盐胁迫组中,与CO2浓度常规组相比,CO2浓度倍增组叶片Gs分别降低27.2%、18.3%、13.2%和11.5%,表现出降低幅度减少趋势。值得注意的是,播种后天数和CO2浓度对藜麦叶片Gs和iWUE均未产生交互作用。此外,盐胁迫显著增加叶片iWUE。特别是盐胁迫下CO2浓度倍增组在播后42 d iWUE较CO2浓度常规组显著提高59%,达到0.26μmol/mol,此后CO2浓度倍增组iWUE趋于稳定,维持在0.3μmol/mol左右。
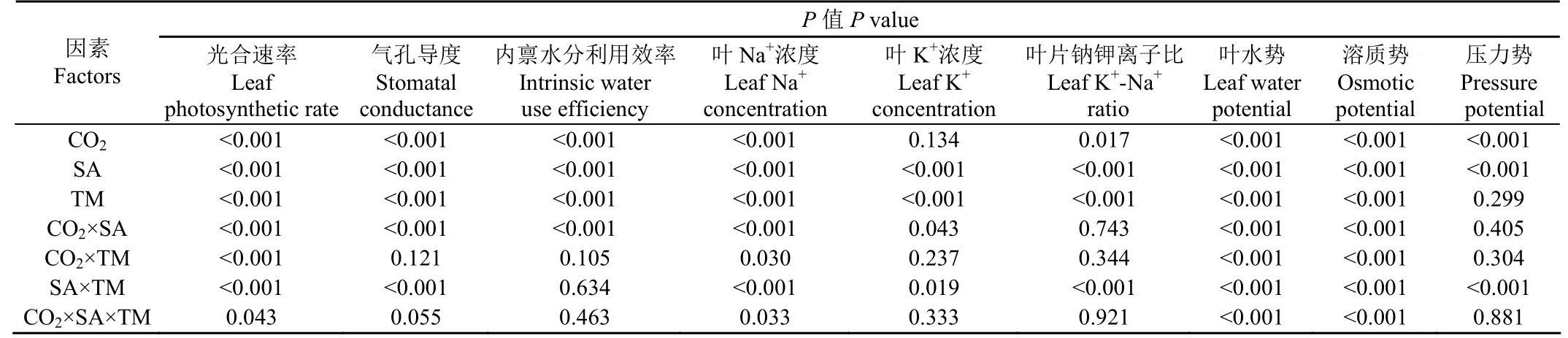
表1 不同CO2浓度下不同盐胁迫处理藜麦叶片各指标多因素方差分析结果Table 1 Output of multi-way ANOVA for indices of quinoa leaves under treatments of CO2 concentration and salt stress
2.2 CO2浓度倍增和土壤盐胁迫对藜麦叶片Na+、K+浓度的影响
由表1可知,播种后天数、盐胁迫和CO2浓度均显著影响叶片Na+且产生显著交互作用。在对照组和盐胁迫组中,随着藜麦生长,CO2浓度常规组与倍增组叶片Na+、K+浓度均显著提高,但差异逐渐缩小(图2)。此外,在无盐胁迫(对照组)中,同一播种后天数CO2浓度对叶片Na+、K+浓度影响不显著。但在盐胁迫组中,CO2浓度对同一播种后天数叶片Na+、K+浓度影响显著并且差异逐渐增大。盐胁迫下,相对于CO2浓度常规组,CO2浓度倍增组在63 d叶片Na+浓度降低42%,相反,在63 d时CO2浓度倍增组叶片K+浓度比常规组高26%。此外,在盐胁迫组中,CO2浓度倍增组叶片K+-Na+比随着植株生长显著增加,最高提升K+-Na+比达80%。
2.3 CO2浓度倍增和土壤盐胁迫对藜麦叶片水分运动的影响
播种后天数、盐胁迫和CO2浓度对叶片Ψl和Ψπ影响显著且均产生显著交互作用(表1)。在对照组和盐胁迫组中,不同CO2浓度处理的叶片Ψl和Ψπ均随藜麦生长呈现上升趋势(图3)。在对照组中,CO2浓度对同一播种后天数叶片Ψl和Ψπ影响均不显著。但在盐胁迫组中,与CO2浓度常规组相比,CO2浓度倍增组在49 d后叶片Ψl和Ψπ显著降低,在63 d降幅分别为39%和36%。此外,CO2浓度倍增提高叶片Ψp(对照组49和63 d,盐胁迫组49 d及以后),而盐胁迫显著降低叶片Ψp,随着藜麦生长,在对照组中叶片Ψp逐渐增加,而在盐胁迫组中叶片Ψp逐渐降低。在盐胁迫组中,CO2浓度常规组与倍增组叶片Ψp最大差值出现在56 d ,差值达到0.034 MPa。
2.4 CO2浓度倍增和土壤盐胁迫对藜麦生长参数的影响
如表2所示,CO2浓度和盐胁迫对藜麦生长参数均产生显著影响,其中盐胁迫显著降低各生长参数,而CO2浓度显著提升各生长参数。在盐胁迫组中,相对于CO2浓度常规组,CO2浓度倍增条件下,藜麦株高、茎干物质量、根干物质量、百粒质量、产量分别提高8%、20%、82%、19%和34%。值得注意的是,CO2浓度倍增显著增加藜麦根茎干物质量比,提升幅度达5%。

表2 不同CO2浓度和盐胁迫处理下藜麦生长参数Table 2 Growth parameters of quinoa under different treatments of CO2 concentration and salt stress
2.5 不同CO2浓度和土壤盐胁迫处理主成分分析
如图4所示,通过主成分分析(Principal component analysis,PCA)将藜麦各取样阶段不同CO2浓度处理的多个指标进行综合性分析,主成分1和主成分2累计贡献率达到92.7%,具有代表性。相同散点各自聚集成团分散排布,说明藜麦各取样阶段不同CO2浓度处理差异显著。藜麦iWUE向量与Ψl、Ψπ、Pn和K+浓度向量均成锐角,因此,藜麦iWUE与这4个指标成正相关,与其他指标成负相关。
3 讨 论
叶片气孔是植物与外界环境进行水气交换的重要通道。大量研究表明,盐胁迫和CO2浓度升高都会使气孔开度迅速缩小,甚至造成气孔密度降低,导致叶片Gs下降、水分蒸腾变弱、植物失水减少、水分利用效率和干物质的积累增加[22]。此外,高CO2浓度不仅使Rubisco羧化反应速率升高,而且促进细胞分裂素等重要植物激素的合成,从而显著提高植物的光合速率[23-24]。然而,长期处于高CO2浓度环境植物光合速率增幅会逐渐缩小,甚至低于正常大气CO2浓度水平,即“光合适应现象”[25]。以往对此现象的研究多基于CO2浓度单一因素的影响,并且对其发生机理尚未达成共识。本研究发现,在盐胁迫条件下,虽然CO2浓度倍增使藜麦Pn显著提高、Gs显著降低,但随着藜麦生长,不仅藜麦叶片中Na+浓度增加(图2a),Ψπ降低(图3b),而且藜麦Pn和Gs波动幅度逐渐减小(图1a,1b),同样产生光合适应现象。这可能是由于CO2浓度倍增不仅提高促进植株生长的激素生长素和细胞分裂素的合成,而且降低抑制植株生长的激素ABA和乙烯含量,这样极大缓解了盐胁迫下植株产生大量ABA和乙烯对其早期生长的抑制作用[24,26]。此外,随着植株的生长,CO2浓度倍增显著促进根系发育,大幅提高植株根茎干物质量比,有助于植株吸收更多水分和养分的同时,也导致了Na+积累和Ψπ降低,对植株生长起到一定的抑制作用[12]。在植物激素水平、离子含量以及水势调节的动态平衡过程中引起的光合适应现象。大量研究证实,高CO2浓度不仅抑制气孔发育而且诱导气孔关闭,因此植物蒸腾失水量减少,水分利用效率显著增加。本试验结果表明,在Pn和Gs共同作用下,盐胁迫下在藜麦生长关键的49~63 d期间,与常规组相比,CO2倍增组叶片iWUE都维持较高水平,促进藜麦干物质积累,显著提高了藜麦产量。此外,高CO2浓度可以上调抗氧化酶基因表达,提高抗氧化酶的活性,清除藜麦体内产生的自由基,抑制ROS的积累,提高藜麦耐盐性,促进藜麦生长[27]。
盐胁迫导致植物细胞严重脱水,因此细胞内离子平衡被打破,造成植物水势和渗透势不断降低,大量Na+积累,导致K+-Na+比值不断降低,严重影响植物生长[28]。本研究结果显示,CO2浓度倍增处理中藜麦表现出明显的吸K+排Na+的现象。结合以往研究结果分析,这种现象一方面是由于高CO2浓度显著降低藜麦叶片中乙烯前体ACC合成酶含量,导致由乙烯诱导合成的Na+转运蛋白减少,进而减少藜麦叶片中Na+积累量,增加K+-Na+的调控能力[26]。另一方面,高CO2浓度可以促进甘氨酸甜菜碱的合成,从而增强盐胁迫下藜麦根系对Na+和K+的选择吸收能力,维持适当的K+-Na+比,促进质膜的主动排Na+,显著降低叶片中Na+的积累,缓解Na+的毒害作用[29]。同时,高CO2浓度促进根系发育、提升根系吸水能力,缓解叶片细胞脱水情况,有效调节植物Ψl和Ψπ,降低细胞内Na+浓度,维持细胞内离子平衡。
在盐胁迫条件下,植物需要不断降低水势才能吸收水分,以维持植物体内水分平衡和正常生理代谢,在水势和渗透势协同作用下细胞压力势逐渐降低,然而,压力势降低造成细胞的原生质体对细胞壁的作用力减弱,直接导致植物萎蔫甚至枯萎[30]。本研究表明,CO2浓度倍增能有效地调节盐胁迫下藜麦水分运动,提升藜麦渗透调节能力。一方面是由于高CO2浓度处理显著降低藜麦叶片Na+含量,而叶片Na+含量与Ψl、Ψπ和Ψp,呈显著负相关的关系(图4),因此盐胁迫下藜麦缺水状况得到缓解,不需要进一步降低Ψl加强对水分的吸收,同时,Ψp升高能稳定叶片细胞形态,保证其正常的生理功能。另一方面,高CO2浓度条件下藜麦根系发育和吸水速率显著增加,进而提高叶片相对含水率,从而促进藜麦渗透调节,提高叶片细胞保水和维持Ψp的能力。
4 结 论
本研究通过人工气候室精准控制CO2浓度,在2个CO2浓度(常规组:400 μmol/mol和倍增组:800 μmol/mol)条件下,探讨在400 mmol/L NaCl盐胁迫下,CO2浓度对耐盐作物藜麦光合、离子吸收和水分运动的影响,得到如下结论:
1)在常规组和盐胁迫组中,CO2浓度对藜麦叶片光合速率、气孔导度和内禀水分利用效率均产生显著影响。在盐胁迫处理下,CO2浓度倍增显著提升藜麦光合速率最高可达39.4%,降低气孔导度最高达11.5%。但随着藜麦生长,叶片Pn和Gs波动幅度逐渐减小,产生“光和适应现象”。同时,CO2浓度倍增处理显著提高叶片内禀水分利用效率和藜麦产量。
2)在常规组中,CO2浓度对藜麦叶片Na+含量、K+含量和K+-Na+比的影响均不显著。在盐胁迫组中, CO2浓度倍增显著降低藜麦叶片Na+含量(49~63 d),增加叶片K+含量(56~63 d),表现出明显的吸K+排Na+的现象,并维持较高的K+/Na+比。
3)在常规组中,CO2浓度对藜麦叶片水势、渗透势和压力势影响均不显著。在盐胁迫组中,CO2浓度倍增能激发藜麦叶片渗透调节能力,有效调控叶片水分运动,降低叶片渗透势和水势(49~63 d),提高压力势,缓解藜麦叶片细胞水分亏缺,维持细胞正常的生理功能。
综上,本研究结果表明CO2浓度升高有效缓解盐胁迫对藜麦生长造成的不利影响。
