α-酮酸联合极低蛋白饮食对2型糖尿病肾病的影响
2021-05-08王毅汪延辉虞丹丹
王毅 汪延辉 虞丹丹
2型糖尿病肾病为常见糖代谢综合征微血管并发症,是终末期肾功能衰竭的重要发病因素[1]。研究发现,2型糖尿病肾病由于长期处于高血糖状态,肾脏组织代谢负担不断加重,最终造成肾功能障碍。自噬是人体细胞特有自我保护机制,通过清除受损细胞器、循环利用细胞内蛋白质等维持细胞内环境稳定,抵御外部环境变影响[2-3]。最新发现细胞自噬在2型糖尿病肾病发病中起关键作用[4]。α-酮酸联合低蛋白饮食可防治2型糖尿病肾病,但其病理学机制仍未明确[5]。本研究基于细胞自噬探讨α-酮酸联合极低蛋白饮食对2型糖尿病肾病的作用机制,现报道如下。
1 资料与方法
1.1 临床资料 选择2018年11月至2020年1月本院2型糖尿病肾病确诊患者120例作为观察对象。按随机数表法分成观察组和对照组,每组各60例。对照组中男36例,女24例;年龄22~74岁,平均(53.18±6.22)岁;病程1.5~12年,平均(6.32±1.06)年。观察组中男34例,女26例;年龄21~77岁,平均(55.02±4.77)岁;病程1.4~11年,平均(6.29±1.17)年。(1)纳入标准:①多项检查联合确诊为2型糖尿病肾病者[6];②伴有蛋白尿症状;③尿白蛋白排泄率>100 mg/24 h;④对本研究所用药物耐受;⑤患者及家属均自愿参与研究,并签订知情同意书。(2)排除标准:①糖尿病酮症酸中毒者;②合并凝血功能障碍及自身免疫系统功能障碍者;③血糖、血压难以控制在正常范围者;④恶性肿瘤患者;⑤对本研究所用药物不耐受,出现严重不良反应患者;(6)妊娠期或者哺乳期患者。两组基本资料差异无统计学意义(P>0.05),具有可比性。
1.2 糖尿病肾病分期标准 (1)Ⅰ期:肾损伤,肾小球滤过率GFR≥90;(2)Ⅱ期:肾脏受损,60≤肾小球滤过率GFR≤89;(3)Ⅲ期:肾脏中度受损,30≤肾小球滤过率GFR≤59;(4)Ⅳ期:肾脏重度受损,15≤肾小球滤过率GFR≤29;(5)Ⅴ期:终末期肾病尿毒症,肾小球滤过率GFR<15。
1.3 方法 对照组给予非严格控制低蛋白饮食[1.0 g/(kg·d)]+α-酮酸片(北京费森尤斯卡比医药有限公司生产,服用剂量:4片/次,3次/d);观察组给予α-酮酸片(北京费森尤斯卡比医药有限公司生产,服用剂量:4片/次,3次/d)联合极低蛋白饮食[(0.5 g/(kg·d)]进行治疗,连续治疗3个月为一个疗程。
1.4 观察指标 (1)24 h UAER、24 h Upro:采用免疫比浊法(试剂盒购自浙江世纪康大医疗科技有限公司)检测24 h UAER,采用双缩脲法(试剂盒购自浙江世纪康大医疗科技有限公司)检测24 h Upro;(2)BUN、SCr:采用酶偶联速率法(试剂盒购自山东博迈达生物科技有限公司)检测血清BUN及SCr;(3)肾小球滤过率:采用肌酐酶法(试剂盒购自杭州德安奇生物工程有限公司)检测肾小球滤过率;(4)LC3蛋白及P62抗体阳性率:采用RNA 提取试剂(购自浙江世纪康大医疗科技有限公司)提取糖尿病患者血清RNA,配合选取反转录试剂盒(购自浙江世纪康大医疗科技有限公司)生成cDNA,扩增反应DNA 片段后分离LC3 蛋白,经溴化乙锭染色后检测LC3 蛋白的相对表达。采用ELISA法检测p62 抗体阳性率,试剂盒及p62 抗原购自杭州德安奇生物工程有限公司。
1.5 统计学方法 采用SPSS 20.0统计软件。计量资料以(±s)表示,组间比较采用t检验;计数资料以n或%表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 两组治疗前、治疗后3个月24 h UAER、24h Upro指标比较 治疗前,两组患者的24 h UAER、24 h Upro指标差异无统计学意义(P>0.05);治疗后3个月,两组患者的24 h UAER、24 h Upro指标均降低,且观察组比对照组低,差异有统计学意义(P<0.05)。见表1。
2.2 两组治疗前、治疗后3个月BUN、SCr指标比较 治疗后3个月,两组患者BUN、SCr指标水平均降低,且观察组比对照组低,差异有统计学意义(P<0.05)。见表2。
2.3 两组治疗前、治疗后3个月肾小球滤过率比较 治疗后3个月,两组患者肾小球滤过率升高,且观察组高于对照组,差异有统计学意义(P<0.05)。见表3。
表1 两组治疗前、治疗后3个月24 h UAER、24 h Upro指标比较[mg/24 h,(±s)]
组别 n 24 h UAER 24 h Upro治疗前 治疗后3个月 t值 P值 治疗前 治疗后3个月 t值 P值观察组 60 296.22±64.71 187.26±49.66 38.744 0.000 204.22±33.074 154.07±36.305 28.366 0.000对照组 60 295.18±68.27 242.73±52.24 22.167 0.000 203.17±18.661 184.37±23.076 19.062 0.000 t值 0.128 43.216 0.203 56.221 P值 0.861 0.000 0.794 0.000
表2 两组治疗前、治疗后3个月BUN、SCr指标比较(±s)
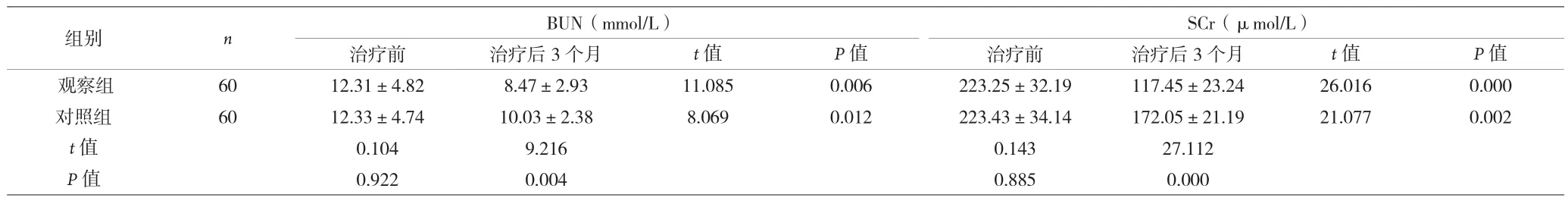
表2 两组治疗前、治疗后3个月BUN、SCr指标比较(±s)
组别 n BUN(mmol/L)SCr(μmol/L)治疗前 治疗后3个月 t值 P值 治疗前 治疗后3个月 t值 P值观察组 60 12.31±4.82 8.47±2.93 11.085 0.006 223.25±32.19 117.45±23.24 26.016 0.000对照组 60 12.33±4.74 10.03±2.38 8.069 0.012 223.43±34.14 172.05±21.19 21.077 0.002 t值 0.104 9.216 0.143 27.112 P值 0.922 0.004 0.885 0.000
表3 两组治疗前、治疗后3个月肾小球滤过率比较[ml/(min·1.73 m2),(±s)]

表3 两组治疗前、治疗后3个月肾小球滤过率比较[ml/(min·1.73 m2),(±s)]
组别 n 治疗前 治疗后3个月 t值 P值观察组 60 47.04±12.041 128.06±14.102 27.884 0.000对照组 60 47.27±12.07 72.10±15.026 14.228 0.004 t值 0.228 31.284 P值 0.857 0.001
2.4 两组治疗前、治疗后3个月LC3蛋白、P62抗体阳性率比较 治疗后3个月,两组患者LC3蛋白表达升高,P62抗体阳性率降低,且观察组LC3蛋白表达高于对照组,P62抗体阳性率低于对照组,差异有统计学意义(P<0.05)。见表4。
表4 两组治疗前、治疗后3个月LC3蛋白、P62抗体阳性率比较(±s)

表4 两组治疗前、治疗后3个月LC3蛋白、P62抗体阳性率比较(±s)
组别 n LC3蛋白表达 P62抗体阳性率(%)治疗前 治疗后3个月 t值 P值 治疗前 治疗后3个月 χ2值 P值观察组 60 0.65±0.14 1.08±0.39 6.1320.015 25.68 14.27 10.826 0.000对照组 60 0.64±0.17 0.89±0.21 4.0290.002 25.07 18.25 16.008 0.000 t/χ2 值 0.418 7.013 0.108 8.224 P值 0.944 0.006 0.784 0.000
3 讨论
2型糖尿病肾病是糖尿病常见并发症,其发病早期隐匿,且病情进展缓慢,易被患者及其家属忽略,一旦出现大量蛋白流失,肾脏损伤已进展为终末期,预后较差[7]。细胞自噬在2型糖尿病肾病的进展中发挥重要作用,细胞自噬通过清除受损细胞器、循环利用细胞内蛋白质等手段,为细胞提供营养的分解代谢过程[8]。α-酮酸为多种氨基酸复方制剂,可提供机体必需氨基酸,维持肌肉氨基酸平衡,促进细胞自噬活化,缓解骨骼肌蛋白降解风险[9]。而极低蛋白饮食能够降低机体内前列腺素E2合成分泌,缓解肾小球高灌注状况,降低蛋白质的流失,但长期保持极低蛋白含量可能会诱发营养不良[10]。α-酮酸联合极低蛋白饮食干预不仅能够改善肾功能指标水平,降低肾脏负担,还可通过α-酮酸的摄入,有效避免极低蛋白饮食引起的营养不良[11]。
本研究结果显示,两组患者治疗后3个月的24 h UAER、24 h Upro、BUN、SCr指标均降低,且观察组比对照组低。提示α-酮酸联合极低蛋白饮食干预能够有效改善2型糖尿病肾病患者的肾功能指标,缓解24 h蛋白质流失进程,进而有效保护患者的肾脏功能。究其原因,α-酮酸联合极低蛋白饮食能够降低前列腺素E2血管扩充物的合成和分泌,缓解肾小球的高滤过和高灌注,降低2型糖尿病肾病患者的蛋白流失程度,起到良好的肾功能保护作用[11],还可以有效改善2型糖尿病肾病患者LC3蛋白、P62抗体阳性率,调节机体细胞自噬进程[12]。究其原因,外周血自噬相关蛋白p62和LC3被认为是自噬标志性蛋白,动物和体外实验发现这两个蛋白的表达水平与自噬功能的强弱相关p62是一种支架蛋白,在LC3介导下与LC3结合形成自噬小体,最后自噬小体与溶酶体相互融合完成蛋白的降解。α-酮酸联合极低蛋白饮食不仅能提高机体所必须的氨基酸,缓解长期低蛋白饮食所造成的营养不良症状,同时能够显著降低细胞自噬-溶酶体细胞自噬-溶酶体mRNA和蛋白的相对表达量,显著抑制了细胞的自噬活化作用,降低2型糖尿病肾病患者骨骼肌自噬水平,应用效果确切[13-14]。
