应用组织芯片技术对PRDX3与α-SMA的相关性研究
2021-05-08陈远洋王志维
陈远洋 王志维
组织芯片是将数十个乃至上千个组织样本整齐地排列在同一张载玻片上而制成的微缩组织切片,具有节省材料、样本量大、操作性统一、对比性强等优点。由于人体的心血管样本收集难度较大,采用组织芯片技术能减少制作过程中的样本损耗[1,2]。
多种心血管疾病会造成冠状动脉狭窄,随着狭窄的不断发展,冠状动脉内会因血流量不足而导致缺氧,引起氧化应激损伤。氧化应激是指当体内氧化与抗氧化失衡时产生过量氧自由基,例如活性氧(reactive oxygen species, ROS)和反应性氮(reactive nitrogen species, RNS),而ROS和RNS又会作为损伤因素进一步刺激血管平滑肌细胞(vascular smooth muscle cells, VSMCs)的表型转化和增殖迁徙,因此氧化应激与VSMCs的表型转化及功能改变密切相关[3,4]。过氧化物酶(peroxiredoxin,PRDX)3是一种在生物体内广泛表达,能有效清除过氧化物及自由基的抗氧化酶[5]。α-SMA是血管平滑肌细胞表型转化的主要标志物,成熟的收缩型平滑肌细胞主要表现为收缩能力较强,α-SMA表达较高;而分泌型平滑肌细胞的主要表现为增殖能力较强,α-SMA表达较少[6]。综上所述,笔者认为:冠状动脉狭窄引起的氧化应激损伤可能会促进VSMCs由收缩型转化为分泌型,α-SMA表达减少,PRDX3表达增加,并且两者具有相关性。
材料与方法
1.人体标本与实验分组:收集2017年7月~2020年7月于武汉大学人民医院接受心脏移植患者的冠状动脉组织标本,按患者是否存在冠状动脉狭窄分为狭窄组和正常组,其中狭窄组25例,正常组15例。本研究中所有样本均由冠状动脉CTA和HE染色证明是否存在冠状动脉狭窄:纳入标准:①年龄>18岁,病史清晰,诊断明确,患者知情同意本研究;②获取的冠状动脉样本结构完整。排除标准:①合并肝脏、肾脏等其他重要器官疾病;②合并恶性肿瘤患者;③合并其他血管疾病。患者在入院后行心脏移植手术,在心脏移植术后取下患者的心脏,分离出左右冠状动脉组织。标本取出后,用预冷的0.9%氯化钠溶液漂洗,一部分冻存于液氮中,一部分用4%多聚甲醛溶液固定,石蜡包埋用于制作组织芯片。术前所有实验方案均已告知家属,并签署知情同意书,且该部分实验经武汉大学及武汉大学人民医院医学伦理学委员会审批同意。
2.实验细胞来源:原代血管平滑肌细胞均来源于体质量为150~200g的Sprauge-Dawley大鼠,实验动物均由湖北省疾控动物中心采购,饲喂于武汉大学人民医院动物实验中心。在无菌条件下对大鼠进行麻醉手术获取其主动脉,在超净工作台内将主动脉用PBS清洗后,除去主动脉的内外膜,将其剪碎成均匀小块,采用贴壁法在培养皿中进行培养。在显微镜下观察血管平滑肌细胞的形态进行鉴别,培养稳定后进行传代。
3.实验试剂:PRDX3抗体(北京Bioss生物技术公司)、α-SMA抗体(武汉Servicebio生物技术公司)、β-actin抗体(武汉Servicebio生物技术公司)、抗兔二抗(美国Cell Signaling Technology公司)。
4.Western blot法实验:按照分组将狭窄组和正常组冠状动脉处理后,取约50mg组织于1.5ml EP管内,加入含有适量比例的蛋白酶抑制剂(Cocktail、PMSF)的RIPA裂解液,进行研磨后在冰上裂解;将获取的蛋白样本于冷冻离心机中以4℃ 12000r/min离心20min,弃去沉淀的组织,收集上清液后在冰上超声裂解。根据所获得蛋白样本的总体积,以适当的比例加入蛋白上样缓冲液混匀,在100℃金属浴加热15min,所得到的蛋白样本冻存于-80℃冰箱中。电泳时,每孔蛋白上样量为20μg,以 90V电压,40mA电流,在10% SDS-PAGE丙烯酰胺凝胶中进行电泳。电泳完成后,在电流200mA,电压100V条件下进行转膜1.5h。而后用5%脱脂牛奶在摇床上封闭,一抗4℃孵育过夜。以β-actin为内参,使用羊抗兔荧光二抗显影,在Odessy荧光扫膜系统上扫膜,并对结果进行半定量分析。
提取大鼠原代血管平滑肌细胞后培养,分别用0、5、10、20ng/ml的血小板衍生生长因子(可刺激VSMCs分裂增殖)处理24h后,弃去培养基后,加入RIPA裂解液,在冰上裂解、离心超声,加入上样缓冲液,用金属浴加热后于同样条件下进行Western blot法实验,并对结果进行分析。
5.免疫组化:各组标本经4%多聚甲醛固定,石蜡包埋后进行切片制作成含多个样本组织的组织芯片。将组织芯片置于65℃恒温烘箱中加热融蜡2h,然后放入二甲苯溶液中脱去残留的石蜡,进行常规的水化步骤后用PBS漂洗。用Triton试剂(含2‰的曲拉通的PBS溶液)破膜15min,而后在枸橼酸缓冲溶液中进行微波加热修复。自然冷却后,用3%的过氧化氢消除内源性过氧化物酶,血清常温封闭1h,一抗4℃孵育过夜。室温复温1h,二抗避光孵育1h。用DAB染色液在显微镜下显色,显色后苏木精染核,盐酸乙醇分化,漂洗干净后进行风干,中性树脂封片,最后在全自动显微镜下观察拍照。用Image J软件测量蛋白的阳性率。
6.统计学方法:使用Graghpad 6.01统计学软件对数据进行统计分析。计量资料的两组间比较采用t检验,以P<0.05为差异有统计学意义。配对资料用Pearson相关系数表示,相关系数r为0.6~1.0为强或极强相关;0.4~0.6为中等相关;0~0.4为弱或极弱或无相关。当1>r>0时表示正相关,当0>r>-1时表示负相关,r=0时表示无相关。
结 果
1.组织芯片中PRDX3、α-SMA的表达及相关性分析:组织芯片的免疫组化染色发现,狭窄组PRDX3表达较高(棕色代表阳性信号),α-SMA较低(图1、图2);反之正常组α-SMA表达较高,PRDX3表达较低(图3、图4)。将两种蛋白阳性率统计分析后,发现PRDX3与α-SMA之间具有负相关性(由于样本剔除及损坏,最终采用样本量为32例,图5)。

图1 两组α-SMA的免疫组化染色A、C为正常组40倍及400倍视野;B、D为狭窄组40倍及400倍视野

图2 α-SMA免疫组化染色定量结果
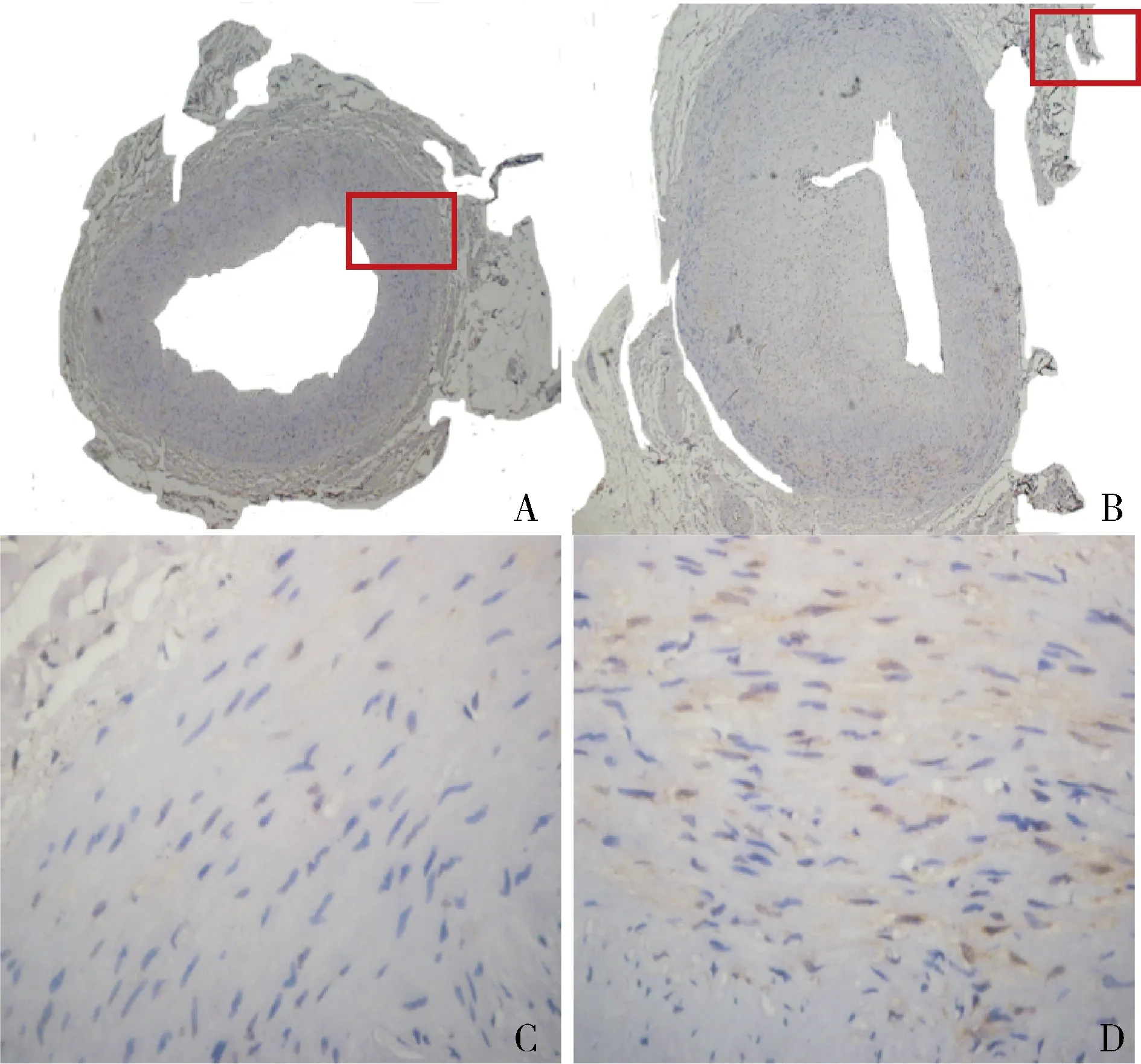
图3 两组PRDX3的免疫组化染色A、C为正常组40倍及400倍视野;B、D为狭窄组40倍及400倍视野

图4 PRDX3免疫组化染色定量结果

图5 组织芯片中PRDX3与α-SMA的相关性两者呈负相关,r=-0.8,P=0.000
2.Western blot法实验验证组织芯片中的PRDX3表达:将两组组织提取蛋白后进行Western blot法实验,发现狭窄组的PRDX3蛋白与正常组比较显著过表达,差异有统计学意义(图6)。重复实验后得到相同结果,证明PRDX3表达与冠状动脉狭窄相关。
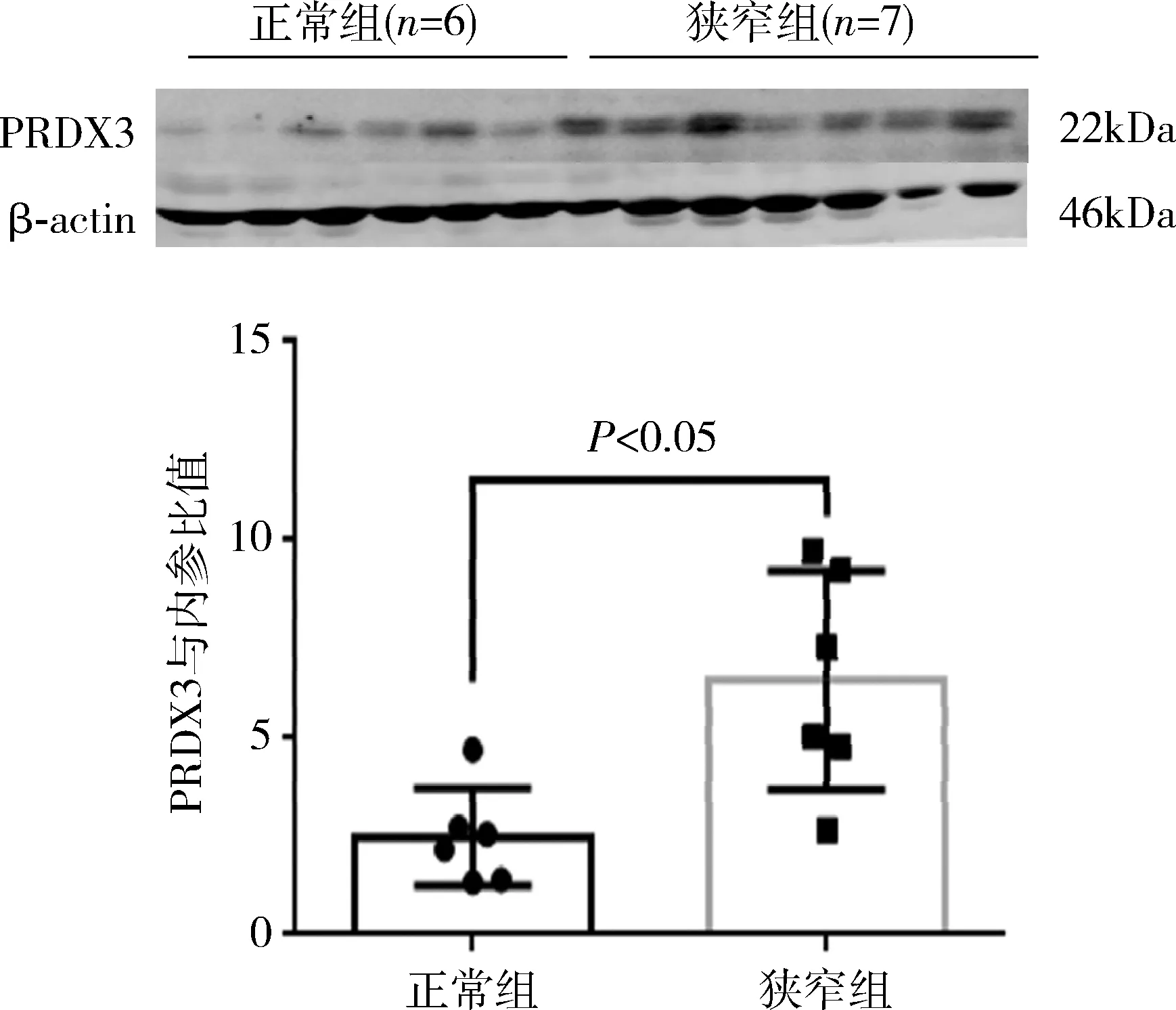
图6 Western blot法实验的PRDX3表达结果
3.细胞实验中用PDGF处理VSMCs后的PRDX3表达:在大鼠原代VSMCs培养稳定后,分别加入0、5、10、20ng/ml的血小板衍生生长因子(platelet derived growth factor,PDGF)进行处理,24h后提取细胞蛋白进行Western blot法实验。发现随着在相同时间内随着PDGF浓度增加,PRDX3的表达量随之增加(图7)。说明在VSMCs的增殖过程中,伴随着氧化应激水平的增加,抗氧化酶PRDX3增加。
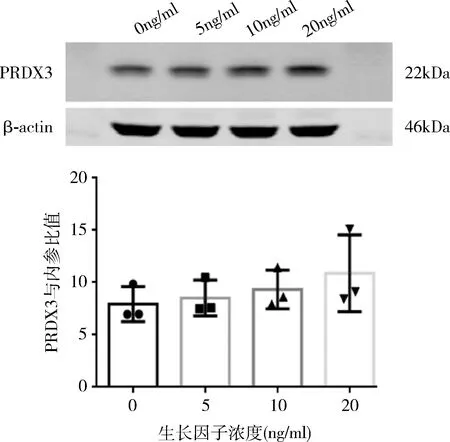
图7 细胞实验的PRDX3表达
讨 论
在心血管疾病的研究中,由于人体心脏血管标本的获取难度较大,一定程度上限制了心血管研究的发展。组织芯片是生物芯片的一种, 利用组织芯片可对大样本量的组织标本同时进行形态结构比较,以及基因和蛋白表达的定位检测, 是对基因芯片和蛋白芯片的重要补充[7]。在传统免疫组化中,最大的缺点就是多个标本处于不同实验条件下,造成免疫组化结果出现很大组内差异, 甚至出现假阳性或者假阴性。而运用组织芯片的免疫组化由于实验条件一致可有效减少实验误差,提高染色结果的质量。可以同时对免疫组化染色结果进行平行分析,大大节约抗体和时间。并且可以减少制作切片过程中对组织原材料的损耗[8]。本研究通过组织芯片技术的应用,帮助较高效、快速地获取实验数据,有足量的数据支持PRDX3和α-SMA之间的相关性。由于人体组织标本之间存在年龄、性别、发病程度等多种差异,样本均一性相对较差。为了验证组织芯片的免疫组化结果,后续又进行了Western blot法实验和细胞实验,都得到了一致的结果,证明了组织芯片技术在心血管疾病研究中的准确性和可靠性,说明组织芯片技术在心血管研究中有良好的应用前景。
临床上的冠状动脉狭窄最常见的原因是冠状脉粥样斑块形成,导致血管动脉粥样硬化,血管腔逐渐缩窄。正常冠状动脉中血液中的氧气可以通过扩散作用从管腔进入血管壁,随着血管的狭窄不断发展,经流血管内的血流量不断减少,从而显著减少了氧气向血管壁的扩散[9]。冠状动脉的缺氧会引发氧化应激损伤,诱导血管生成因子(如 VEGF、PDGF等)的表达和释放,同时增加促炎性细胞因子的表达,多种因子共同促刺激血管壁上的VSMCs表型转化和增殖迁徙[10]。研究表明,VSMCs的表型转化与血管疾病的发生、发展密切相关,其表型转化是为了让血管适应外界损伤,维持正常结构功能[11,12]。然而,当损伤持续存在时,VSMCs过度修复会导致内膜病理性增厚、血管壁重构,导致血管管腔狭窄,是动脉粥样硬化、血管成形术和支架术后再狭窄等血管狭窄性疾病的共同病理基础。血管内膜新生增加导致的内膜增厚是动脉血管针对损伤产生的反应,内膜增厚依赖于平滑肌细胞的表型转化及其增殖迁徙能力,内膜新生时以分泌型的平滑肌细胞为主,α-SMA的表达降低。反之,当无明显内膜新生时,收缩型VSMC增加,α-SMA表达增加,因此α-SMA可作为VSMC表型转化的标志物[13]。血小板衍生因子(PDGF)可以通过刺激线粒体裂变,增加线粒体中的能量水平和ROS水平促进VSMCs的表型转化和增殖迁徙能力[14,15]。因此在笔者用PDGF刺激大鼠原代血管平滑肌细胞后,可见细胞内的氧化应激水平增加,PRDX3的表达量也随之增加。
过氧化物酶作为近年来备受关注的特异性抗氧化剂蛋白家族,在细胞的氧化应激损伤中发挥保护作用,通过减少过氧化氢等各种过氧化物来减轻氧化应激损伤。过氧化物酶家族在哺乳动物中至少有6种同工酶,通过对氧化应激水平的调节来影响细胞的增殖、分化和凋亡。PRDX3是由256个氨基酸构成,主要位于线粒体中[16,17]。Wang等研究表明,肠道缺血/再灌注(ischemia reperfusion,IR)过程中伴随着大量活性氧(ROS)的产生,积累的ROS例如过氧化氢(H2O2)和羟基自由基,会破坏细胞脂质,蛋白质和DNA,诱导细胞凋亡,破坏肠道上皮稳态。而线粒体中的PRDX3可有效清除IR产生的ROS,在肠道的缺血再灌注损伤中起保护作用[18]。在本实验中随着冠状动脉狭窄程度的增加,同样发现了高表达的PRDX3,因此可以看出PRDX3在冠状动脉血管的缺血缺氧中同样可能起到保护作用,为预防和治疗冠状动脉的氧化应激损伤提供了新的靶点。
综上所述,在不同狭窄程度的冠状动脉血管中,可观察到缺血缺氧可引起氧化应激,促进VSMCs的表型转化,α-SMA表达量降低,抗氧化酶PRDX3的表达增加,且两者呈负相关。PRDX3的抗氧化作用在冠状动脉的缺血缺氧中起到保护作用,为预防和治疗心血管的氧化应激损伤提供了新的治疗靶点。
