G蛋白偶联受体81基因沉默联合顺铂诱导与喉癌能量代谢相关因子的研究
2021-05-07贾巧静贾晓芳张海中岳丽艳张玉波单春光
贾巧静,贾晓芳,张海中,岳丽艳,张玉波,单春光
(河北医科大学第二医院 耳鼻咽喉一科,河北 石家庄 050000)
喉癌是常见的头颈部恶性肿瘤之一,以原发性较为多见,鳞状细胞癌最多,大约占耳鼻咽喉部位恶性肿瘤的7.9%~35%[1],在头颈部恶性肿瘤中排名第3位。迄今为止,喉癌的治疗方式一直采用手术切除原发区癌组织及淋巴结,配合放疗化疗及细胞抑制剂。在某些情况下,表皮生长因子受体(epidermal growth factor receptor,EGFR) 靶向抗体西妥昔单抗和程序性死亡受体-1 (programmed death receptor-1,PD-1)抗体也用于喉癌的临床治疗。因其具有易复发、转移快以及预后差的特点,对患者的生理、心理及正常生活带来许多痛苦。对喉癌采取治疗及干预措施后,其晚期患者的5年生存率仍不尽人意[2-3]。因此,寻找新的特异性靶点对于喉癌的治疗具有重要意义。
在肿瘤微环境中,恶性肿瘤细胞通过葡萄糖摄入进行高效的糖酵解,并将乳酸转运出细胞作为糖酵解过程的中间产物。在过去,乳酸常常被认为是代谢垃圾,然而有研究表明乳酸可作为信号传导分子,激活特定的G蛋白偶联受体81(G protein-coupled receptor, GPR81)。GPR81的表达特征与能量代谢异常密切相关。目前有报道称其在各种原发性肿瘤细胞中均具有高表达特性[4-6],并参与恶性肿瘤的增殖、分化、生长、生存及细胞凋亡[7-9]。单羧酸转运蛋白(monocarboxylate transporters, MCT)在维持糖酵解进程中扮演重要角色,并具有乳酸调控及pH值控制的双重功能[10-11]。Na+-葡萄糖共转运蛋白(sodium-glucose co-transporter 1,SGLT-1)是一种高亲和力、低容量的受体,可运输两个钠分子和一个葡萄糖分子,介导小肠细胞对葡萄糖的摄取和近端肾小管的S3段,主要作用是介导跨膜吸收葡萄糖和半乳糖[12-13]。本研究主要通过构建GPR81-shRNA,并转染至Hep2细胞中,联合顺铂诱导后,研究其与MCT4、SGLT-1表达的相关性,以及通过检测细胞凋亡抑制蛋白(survivin)的表达,研究其对细胞凋亡的影响,进而阐述GPR81与顺铂诱导在喉癌发生机制中的作用。
1 材料与方法
1.1 实验试剂
使用的一抗GPR81购自Santa Cruze,SGLT-1、MCT4、survivin一抗购自Abcam,一抗beta-actin及二抗购自三鹰,抗体为兔抗人。细胞培养基RPM1640购买于索莱宝,胎牛血清购买于依科赛生物科技公司(中国),双抗、蛋白裂解液RIPA和BCA蛋白浓度提取试剂盒购自索莱宝。转染试剂Lip3000购自Invitrogen。RNA提取试剂Trizol及cDNA反转录试剂盒购自北京天根。胰酶、青霉素、链霉素购自于索莱宝。
1.2 细胞培养与刺激
喉癌Hep2细胞系为我院耳鼻咽喉科实验室保存。Hep2细胞培养于T25细胞培养瓶,包含有10%胎牛血清、100 U/mL青霉素、100 μg/mL链霉素的RPM1640细胞培养基5 mL。培养条件为37℃,培养箱保持5%CO2、湿度95%。待细胞贴壁生长数量达5×106,对Hep2细胞传代培养至6孔板,待细胞浓度为(1.0~2.0)×105个/孔时进行shRNA转染。带有绿色荧光蛋白(GFP)标签的shRNA-GPR81质粒和shRNA-scramble(对照)质粒由广州赛业生物公司合成。采用Lip3000进行质粒转染,转染过程参照说明书。转染48 h后荧光显微镜下通过GFP表达情况观察细胞转染程度,对于转染达75%以上的细胞用不同浓度顺铂诱导处理。顺铂浓度分别为0、0.5 、1、2、5 μg/mL,置于培养箱中培养24 h后收集蛋白。每组设置3个重复。另外,未经质粒转染的Hep2细胞经5 μg/mL顺铂刺激后,分别于培养箱中诱导0、12、24、48 h后收集样品用于RNA提取或蛋白分离,每个刺激设置3个重复。用于RNA提取的Hep2细胞经磷酸盐缓冲盐水(PBS)清洗后加入500 μL Trizol,用于后续RNA提取。
1.3 实验方法
1.3.1 RNA提取及cDNA第一条链的合成 将转染了shRNA-GPR81质粒(实验组)和shRNA-scramble质粒(对照组)的Hep2细胞用预冷无菌PBS置于摇床清洗3次,每次5 min,弃去PBS后,每孔加入500 μL Trizol,冰上裂解,将裂解液吸出至2 mL无RNA酶离心管中,加入200 μL氯仿,剧烈震荡30 s,冰上静置10 min。然后轻轻吸出上清液,加入500 μL异丙醇,上下颠倒混匀,冰上静置15 min,之后4℃,12 000 g离心15 min,吸出上清后,加入1 mL 75%乙醇,上下颠倒混匀,之后4℃,12 000 g离心5 min,将上清吸出,置于空气中干燥30 min,最后根据RNA的丰度高低加入30~100 μL DEPC水。使用NanoDrop 2000C检测RNA浓度。cDNA第一条链的合成参照FastQuant cDNA 第一条链合成试剂盒说明书。
1.3.2 半定量聚合酶链式反应(PCR) 以上述反转录的Hep2细胞cDNA为模板,beta-actin为内参基因,利用半定量PCR分析GPR81基因在GPR81基因沉默的Hep2细胞中mRNA水平变化,进而检测GPR81-shRNA的干扰效率。引物采用Primer 5设计,引物序列如表1。半定量PCR反应体系为:超纯水8 μL,PCR Master Mix 10 μL,上下游引物(10 μM)各0.5 μL,不同刺激处理的cDNA模板1 μL。半定量PCR反应程序为:95℃预变性5 min,95℃变性45 s,58℃退火30 s,72℃延伸30 s,30个循环,72℃再延伸10 min。PCR反应产物经琼脂糖凝胶电泳检测,并采用Image J进行灰度值分析。
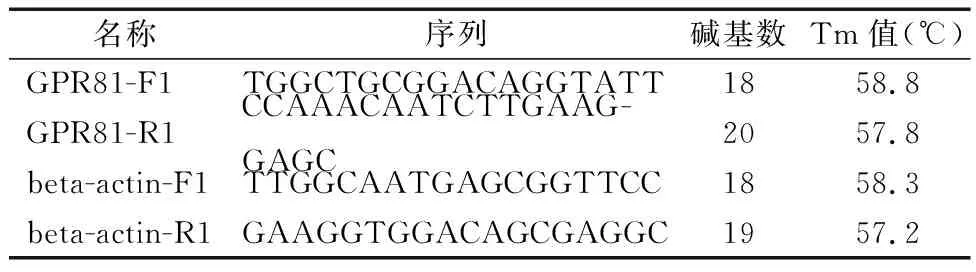
表1 引物序列信息
1.3.3 蛋白印迹分析(Western Blot) 用于蛋白分离的Hep2细胞经无菌PBS清洗后,加入放射免疫沉淀实验(RIPA)裂解液冰上裂解30 min,然后用细胞刮刀刮取细胞,4℃,12 000 g离心15 min后,吸取上清,用二辛可宁酸(BCA)蛋白浓度测定试剂盒测定蛋白浓度,加入蛋白上样缓冲液后,99℃加热10 min使得蛋白质变性,然后冰上放置2 min,可冻存于-80℃用于Western Blot。经变性的蛋白裂解液用12%十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离胶进行蛋白分离,再将蛋白转移至聚偏二氟乙烯(PVDF)膜上,用含有5%牛血清白蛋白的加入吐温20的Tris-盐酸缓冲液(TBST)在37℃恒温箱中封闭1 h。TBST与一抗按照1∶500比例进行稀释,用封口膜将转有蛋白的PVDF膜密封浸润在一抗中,于4℃摇床孵育过夜。将孵育后的PVDF膜置于摇床上用TBST室温清洗3次,每次5 min,然后加入辣根过氧化酶标记的二抗(TBST与二抗按照1∶2 000稀释),室温孵育2 h,经TBST清洗2~3次后,加入化学发光显色剂进行显色,然后采用化学发光仪对蛋白进行发光。采用Image J进行灰度值分析目的蛋白的表达情况。
1.4 数据分析
利用统计软件SPSS 20对数据进行单因素方差分析(One-Way ANOVA,Duncan)和独立样本t检验,取α=0.05为检验水准,P<0.05为差异具有统计学意义。数据分析完成后,导入excel表格中,使用Origin 7作图。
2 结果
2.1 GPR81基因沉默联合顺铂诱导对MCT4、survivin及SGLT-1表达的影响
采用半定量PCR方法和Western Blot检测GPR81在Hep2细胞中的基因沉默效果,如图1所示。GPR81在GPR81基因沉默的Hep2细胞中其mRNA水平和蛋白质水平的表达量分别为shRNA-scramble组的0.28倍(P<0.01)和0.31倍(P<0.05)。
GPR81基因沉默的喉癌Hep2细胞经0、0.5、1、2、5 μg/mL顺铂诱导24 h后MCT4、SGLT-1及survivin的表达情况如图2~4所示。MCT4在转染了shRNA-GPR81的Hep2细胞和转染shRNA-scramble的Hep2细胞中其表达均呈现下调趋势。其中,在shRNA-GPR81组中,在顺铂浓度2 μg/mL及5 μg/mL刺激中,其表达与0 μg/mL的顺铂诱导下的表达比较有显著下调趋势,分别为0 μg/mL顺铂刺激组的0.29倍和0.2倍(P<0.05)。MCT4在对照组中的表达趋势亦呈现下调趋势,在2 μg/mL及5 μg/mL顺铂刺激下,与无顺铂诱导下的表达比较有显著差异,分别为无顺铂诱导条件下MCT4表达量的0.35倍及0.28倍(P<0.05),其中在1μg/mL顺铂诱导的shRNA-GPR81细胞中MCT4的表达显著低于shRNA-scramble细胞中MCT4的表达,约为shRNA-scramble组的0.65倍,差异具有统计学意义(P<0.05),如图4所示。
图1 GPR81在转染不同质粒的Hep2细胞中的mRNA及蛋白水平表达结果 A、B:GPR81在转染不同质粒的Hep2细胞中的mRNA水平的表达及统计结果;C、D:GPR81在转染不同质粒的Hep2细胞中的蛋白水平的表达及统计结果 (1:转染shRNA-scramble质粒;2:转染shRNA-GPR81质粒)
SGLT-1在转染shRNA-GPR81的Hep2细胞中其表达趋势呈现先上调,在2μg/mL顺铂诱导下,其表达达到最高峰,为无顺铂刺激组表达量的3.38倍(P<0.01),其后表达降低,为无顺铂刺激组表达量的2.7倍 (P<0.05)。而在shRNA-scramble对照组中,SGLT-1在不同浓度顺铂诱导下其表达呈现总体下降的趋势,其中在5μg/mL顺铂诱导下,表达量最低,为无顺铂诱导条件下的0.49倍(P<0.05)。其中SGLT-1在0.5、1、2、5μg/mL的顺铂诱导的GPR81基因沉默的Hep-2细胞中的表达均显著高于阳性对照组Hep-2细胞。其中在2μg/mL顺铂诱导时其差异最显著,约为shRNA-scramble组的4.5倍(P<0.05),如图3所示。
Survivin在转染了shRNA-GPR81的Hep2细胞中其表达呈现下降趋势,其中在0.5、1、2、5 μg/mL顺铂诱导条件下与无顺铂诱导相比,分别为无顺铂诱导下survivin表达量的0.74、0.61、0.44、0.36倍,在5 μg/mL顺铂诱导条件下达到最低,具有统计学意义(P<0.05),该结果表明survivin对GPR81沉默及顺铂诱导比较敏感。同时,在顺铂诱导的shRNA-scramble对照组Hep2细胞中,survivin的表达也呈现下调趋势,其中在0.5、1、2、5 μg/mL顺铂诱导条件下与无顺铂诱导相比,分别为无顺铂诱导下survivin表达量的0.92、0.84、0.71、0.56倍。在5μg/mL的顺铂诱导条件下,达到最低值,为无顺铂诱导条件下表达量的0.56倍,差异具有统计学意义(P<0.05),但该组survivin表达的抑制程度比shRNA-GPR81组弱,两组在2 μg/mL及5 μg/mL顺铂诱导下表达量前者约为后者的0.62倍和0.64倍,差异具有统计学意义(P<0.05),如图5所示,这一结果说明GPR81基因沉默联合顺铂诱导可抑制survivin的表达,进而促进细胞凋亡的发生。

图2 GPR81基因沉默联合顺铂诱导条件下Hep2细胞中MCT4的表达情况 A:在转染了shRNA-scramble和转染了shRNA-GPR81质粒的Hep2细胞经不同浓度顺铂诱导后MCT4表达情况;B:MCT4蛋白表达的统计学分析;DDP为顺铂,下图同

图3 GPR81基因沉默联合顺铂诱导条件下Hep2细胞中SGLT-1的表达情况 A:在转染了shRNA-scramble和转染了shRNA-GPR81质粒的Hep2细胞经不同浓度顺铂诱导后SGLT-1表达情况;B:SGLT-1蛋白表达的统计学分析

图4 GPR81基因沉默联合顺铂诱导条件下Hep2细胞中survivin的表达情况 A:在转染shRNA-scramble和转染了shRNA-GPR81质粒的Hep2细胞经不同浓度顺铂诱导后survivin表达情况;B:survivin蛋白表达的统计学分析
2.2 顺铂诱导MCT4、survivin及SGLT-1在喉癌Hep2中的表达特征
Hep2细胞经5 μg/mL顺铂诱导0、12、24、48 h后,MCT4、survivin及SGLT-1在喉癌细胞中的表达情况如图5所示。MCT4在顺铂诱导下,随着时间的推移,其表达呈现下调趋势,其中24 h的表达量与48 h的表达量分别为0 h表达量的0.44倍和0.34倍,与0 h表达量相比显著下降,具有统计学意义(P<0.05)。Survivin基因在顺铂诱导下随着诱导时间的变化,其表达趋势逐渐下降。在48 h下降到最低值,约为0 h刺激表达量的0.281倍,二者差异具有统计学意义(P<0.05)。SGLT-1在顺铂诱导下的表达情况也是被抑制表达的,随着诱导时间的延长,其表达逐渐下调,在48 h达到最低值,约为0 h的0.29倍(P<0.05)。
3 讨论
肿瘤是一种动态的假器官,其包含多种类型的细胞,并通过细胞间的相互作用产生一种独特的生理微环境。在肿瘤细胞网络中,恶性肿瘤细胞会遭遇很多挑战,如物理压力、氧化应激、营养匮乏、细胞间竞争、乏氧及免疫监视与放化疗抵抗等,并通过改变能量代谢特性来适应各种挑战。
MCT4在细胞中主要参与一元羧酸等胞内的释放过程,其对丙酮酸亲和力较低,对乳酸的亲和力较高,并受分解代谢的核转录因子如缺氧诱导因子HIF-1a及核转录因子NF-kB调控,在肿瘤相关的成纤维细胞中具有高表达特征[13],有报道称在多种恶性肿瘤中MCT1和MCT4表达上调,可以作为肿瘤治疗的潜在靶向分子[14]。目前尚无明确的研究报道顺铂诱导及GPR81对MCT4表达的影响。在本研究中经顺铂诱导后MCT4的表达随着时间推移其表达量逐渐降低,并在48 h达到最低,说明Hep2细胞经顺铂诱导后其乳酸含量减少。我们在先前的预实验中发现,糖酵解反应过程中的第二个限速酶磷酸果糖激酶1(phosphofructokinase-1,PFK-1)经相同条件的顺铂诱导后其表达也呈现逐渐下降的趋势,因此推测顺铂对糖酵解可能存在一定的抑制作用,进而说明糖酵解过程的葡萄糖摄入及乳酸累积降低。这一结论也能从侧面解释MCT4经顺铂诱导后表达下调的原因。MCT1、MCT4及GPR81是乳酸转运的重要参与者,三者共同调控乳酸的来源与去向,维持细胞能量代谢的正常进行。在本研究中,GPR81基因沉默的Hep2细胞联合不同浓度顺铂诱导后与对照组相比,MCT4仍表现为下调趋势,根据这一结果我们推测GPR81的缺失联合顺铂诱导对乳酸的转运具有抑制作用。
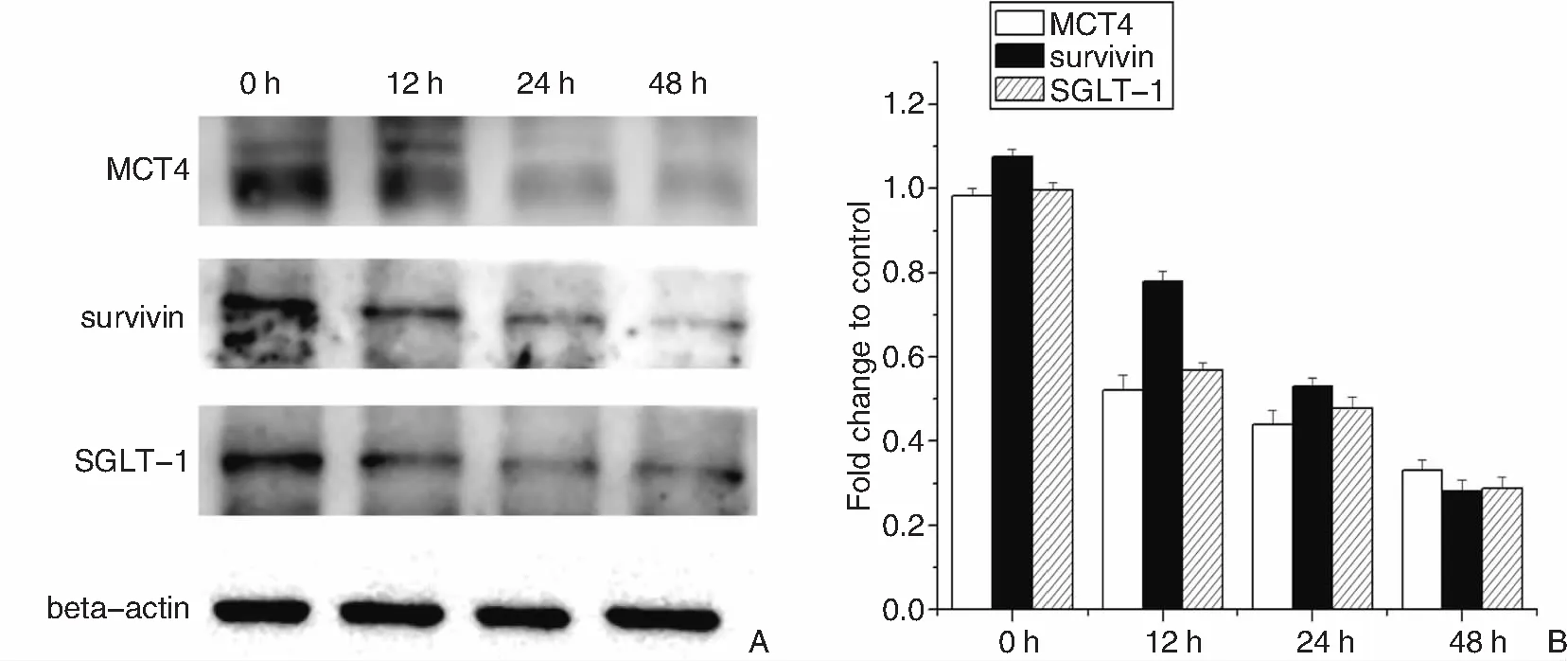
图5 顺铂诱导不同时间的MCT4、survivin、SGLT-1表达情况 A: Hep2细胞经顺铂诱导0、12、24、48h后,MCT4、survivin及SGLT-1在蛋白水平的表达情况;B: 统计分析结果
GPR81作为糖酵解反应中间产物乳酸的受体,其表达量的高低与能量代谢过程密切相关。SGLT-1在肿瘤中具有高表达特性,通过介导葡萄糖的转运为肿瘤细胞提供营养,促进肿瘤细胞的生长[15]。葡萄糖作为细胞的主要能量来源,可通过SGLT-1转运葡萄糖,以满足肿瘤细胞通过高效的糖酵解反应获取细胞增殖所需的能量。目前已有许多研究表明SGLT-1可在多种肿瘤细胞中表达,如肺癌、头颈肿瘤、宫颈癌等[16-18]。有研究报道,顺铂可以降低SGLT家族的亲和力(主要是SGLT-2),抑制其在近曲肾小管上皮细胞中的表达[19]。该机制可能是通过共价铂与转运蛋白的巯基(SH)集团藕联来实现的[20]。考虑到SGLT-1与SGLT-2氨基酸序列具有59%的同源性[21],我们推测SGLT-1在顺铂诱导下也能发挥其相应的功能。本研究中SGLT-1经顺铂诱导不同时间后,其表达呈现下调趋势,说明顺铂可抑制SGLT-1的表达,相似的研究结果在肾小管上皮细胞的相关报道中也出现过[22]。我们知道,糖酵解反应的中间产物乳酸可以作为GPR81的配体激活GPR81,进而下调cAMP及减弱蛋白激酶A(PKA)调控的信号转导通路。而有研究表明SGLT-1在糖酵解能量代谢过程中,为葡萄糖的摄入、能量储存及转运发挥重要作用[23-24],进而影响乳酸的合成。因此,我们推测GPR81的表达量高低在一定程度上会影响SGLT-1的表达,进而影响生物体能量代谢的过程。本研究中在GPR81基因沉默的Hep2细胞中,经顺铂诱导后SGLT-1蛋白表达整体呈现先上调趋势,在2μg/mL的顺铂浓度诱导后达到最大值,经5μg/mL顺铂诱导后其表达又呈现下调趋势,但整体与阳性对照组相比表达上调。这一结果提示我们,在顺铂诱导的情况下,GPR81基因沉默会增加SGLT-1的表达,进而促进葡萄糖的转运,为机体活动提供能量供应。从某种角度来说,SGLT-1表达的升高是细胞应对顺铂诱导而获得的一种自我保护功能。
众所周知,顺铂诱导可导致细胞凋亡的发生。有研究表明,在肿瘤体内实验及体外实验经顺铂诱导后,均可导致凋亡抑制蛋白表达量的下调[25-26]。GPR81在乳腺癌患者的肿瘤组织及乳腺癌的几种细胞系中具有高表达,GPR81基因敲除后可导致乳腺癌细胞生长受损,并导致细胞凋亡的发生[9]。本研究中,顺铂诱导Hep2细胞后survivin的表达随着时间呈现下调趋势,GPR81基因敲除联合顺铂诱导后的Hep2细胞中,survivin在不同浓度顺铂诱导下,也呈现下调趋势,即细胞凋亡启动。这一研究结果与当前的研究结果一致,说明GPR81基因沉默对于细胞凋亡具有促进作用。
综上所述,GPR81基因沉默联合顺铂诱导对喉癌细胞能量代谢相关的MCT4、SGLT-1的表达具有不同程度的影响,而且对细胞凋亡的发生也具有促进作用,这一研究结果可为临床治疗化疗抗性的喉癌提供一定的理论指导,为今后研究靶向治疗喉癌奠定基础。
