不同分割剂量同步推量调强放疗治疗肺癌脑转移瘤的安全性分析
2021-05-07刘金娥沈永奇梁勋斯叶建忠谢华东刘文健林锋蒙静敏
刘金娥,沈永奇,梁勋斯,叶建忠,谢华东,刘文健,林锋,蒙静敏
1.广西医科大学附属柳铁中心医院肿瘤科,广西柳州545007;2.广西壮族自治区龙潭医院胸外科,广西柳州545005;3.广西壮族自治区龙潭医院肿瘤科,广西柳州545005;4.广西融水县人民医院肿瘤科,广西柳州545300
前言
近年来,在环境污染加剧、吸烟者数量增多、不良生活习惯日益多见等诸多因素影响下,肺癌的发病率与死亡率逐年升高[1]。最新研究显示,在欧洲,肺癌正超过乳腺癌成为女性死亡的头号杀手,可见这一疾病的严重危害[2]。统计发现肺癌患者中20%~50%会发生脑部转移,且病理类型多数为腺癌,预后极差,患者自然中位生存期仅1~2 个月,其死因主要是占位性病变所引起的颅内高压、脑疝以及颅内转移灶出血[3]。在肺癌脑转移患者治疗中,由于血脑屏障的存在,很多化疗药物无法进入脑内发挥抗肿瘤作用,因此放疗仍是该病最主要的治疗手段[4]。同步推量调强放疗可于同一射野,对亚临床病灶、肿瘤病灶同时提供不同分割剂量照射,有助于缩短治疗所需时间,提高治疗精准性,改善患者预后[5-6]。然而目前,同步推量调强放疗在临床中的应用较少,且不同医院应用这一方法治疗时所用分割剂量各有不同,缺少统一标准。本研究选取75 例肺癌脑转移瘤患者,以随机分组、对照研究方式,探索同步推量调强放疗的安全性及最佳分割剂量。
1 资料与方法
1.1 临床资料
选取2017年3月至2019年6月在广西医科大学附属柳铁中心医院就诊的肺癌脑转移瘤患者75 例,均获得明确诊断,临床资料完整,能够遵从医护人员指导完成治疗及随访工作,且对本研究内容知情,已签署知情同意书,并经医院伦理委员会批准。将患者以随机数字表法分为3 组,每组25 例。A 组男18例,女7 例,年龄52~79 岁,平均(62.44±3.14)岁,其中10 例有吸烟史;病理类型:腺癌17 例,鳞癌3 例,小细胞癌4例,腺鳞癌1例。B组男18例,女7例,年龄43~77岁,平均(62.62±3.16)岁,其中11 例有吸烟史;病理类型:腺癌16例,鳞癌3例,小细胞癌5例,腺鳞癌1例。C组男17例,女8例,年龄41~79岁,平均(62.32±2.98)岁,其中12 例有吸烟史;病理类型:腺癌17 例,鳞癌4 例,小细胞癌4例。3组患者基本资料无显著差异(P>0.05),具有可比性。
1.2 方法
3组患者均取仰卧位,以头部热塑膜对患者体位予以固定,行CT增强扫描(2.5 mm层厚),下至颈2椎体,上至开放。完成扫描后,将图像传至Variab23EX Eclipse11.0治疗计划系统。CT上转移灶定位为大体肿瘤体积,将大体肿瘤体积向外均匀放3 mm,定义为计划肿瘤靶区,而临床靶区为全脑,全脑向外均匀放3 mm,为计划靶区体积。患者处方剂量为95%计划靶区体积所受剂量。勾画危及器官,包括眼球、晶体、脑干、视神经。
在实施放疗前,先对患者实施降颅压、脱水治疗,对颅内压予以控制。各组患者的放疗方式均为调强放疗,放疗剂量:A组全脑40 Gy/20f(2.0 Gy/f)+瘤区同步推量46 Gy/20f(2.3 Gy/f),B组全脑40 Gy/20f(2.0 Gy/f)+瘤区同步推量52 Gy/20f(2.6 Gy/f),C 组全脑40 Gy/20f(2.0 Gy/f)+瘤区同步推量58 Gy/20f(2.9 Gy/f)。
1.3 观察指标
(1)放疗计划完成后统计3 组患者危及器官(眼球、晶体、脑干、视神经)平均剂量及最大剂量。(2)统计3 组患者放疗相关不良反应。自放疗第1 天起至放疗后3个月内放疗相关的各种急性不良反应评价:神经系统反应如眩晕、癫痫、认知障碍、记忆损伤、胃肠道反应及骨髓抑制;放疗后3个月起各种晚期神经系统不良反应:认知功能障碍、记忆损伤、脑坏死评价。各急性及晚期不良反应评价标准参照美国CTC4.0 不良反应评价标准进行。(3)随访1年,统计患者生存情况。
1.4 统计学分析
应用SPSS20.0 统计学软件,符合正态分布的计量资料用均数±标准差表示,采用单因素方差分析,两两比较采用SNK 法,计数资料采用Kruskal-WallisH检验,生存率比较采用对数秩检验。P<0.05表示差异有统计学意义。
2 结果
2.1 3组患者危及器官平均剂量及最大剂量比较
采用单因素方差分析,结果显示左右眼球、左右晶体、左右视神经、脑干平均剂量和最大剂量组间无显著差异(P>0.05),见表1。
2.2 3组急性放疗不良反应分析
3组均无4级急性放疗反应发生,3级急性放疗反应发生率4%,检验方法采用Kruskal-WallisH检验,结果表明3组患者在神经系统反应、消化道反应、骨髓抑制方面出现的不良反应均无显著差异(P>0.05),见表2。
2.3 3组患者晚期神经系统不良反应
3组患者均无4级晚期神经系统放疗反应发生,3级晚期神经系统放疗反应发生率4%,检验方法采用Kruskal-WallisH检验,结果表明3组患者在认知功能障碍、记忆损伤、脑坏死方面出现的不良反应均无显著差异(P>0.05),见表3。
表1 3组患者危及器官平均剂量及最大剂量比较(Gy,±s)Tab.1 Comparison of mean dose and maximum dose delivered to organs-at-risk in 3 groups(Gy,Mean±SD)

表1 3组患者危及器官平均剂量及最大剂量比较(Gy,±s)Tab.1 Comparison of mean dose and maximum dose delivered to organs-at-risk in 3 groups(Gy,Mean±SD)
危及器官左眼球右眼球左晶体右晶体左视神经右视神经脑干A组平均剂量13.73±2.18 13.42±1.83 5.98±0.88 6.07±0.86 33.52±3.81 33.50±2.94 41.55±0.87最大剂量37.20±4.18 36.79±3.00 6.82±0.94 7.09±0.88 40.75±0.95 40.68±1.31 43.42±1.56 B组平均剂量13.44±2.16 13.20±2.57 5.74±0.80 5.81±0.79 34.03±3.79 33.05±4.39 41.14±0.64最大剂量38.03±3.39 36.78±6.08 6.85±0.62 6.98±0.69 41.00±1.44 40.92±1.39 43.27±1.33 C组平均剂量13.36±2.85 13.13±3.78 6.09±0.89 6.00±0.95 34.51±3.56 33.14±4.66 41.23±1.05最大剂量37.31±3.21 36.48±6.07 6.97±0.79 6.97±0.79 41.27±1.25 41.32±1.36 43.02±1.64 F/P值平均剂量0.15/0.86 0.07/0.94 1.14/0.32 0.60/0.55 0.44/0.64 0.09/0.92 1.53/0.22最大剂量0.24/0.79 0.03/0.97 0.25/0.78 0.09/0.92 1.13/0.33 1.43/0.25 0.46/0.64
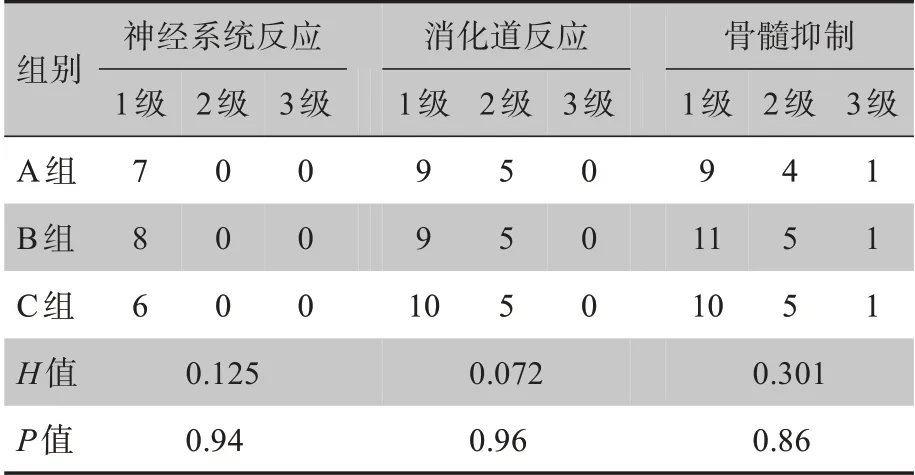
表2 3组患者急性放疗不良反应分析Tab.2 Analysis of acute radiotherapy-induced adverse reactions in 3 groups
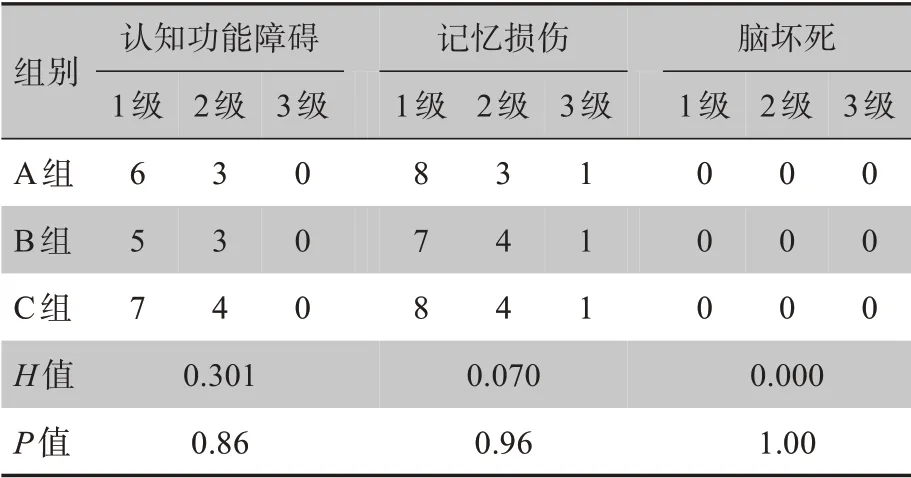
表3 3组患者晚期神经系统放疗不良反应发生情况(例)Tab.3 Occurrence of radiotherapy-induced late neurological adverse reactions in 3 groups(case)
2.4 3组患者1年生存情况比较
采用Kaplan-Meier生存曲线,3组患者累积生存率比较采用对数秩检验,χ2=6.01,P=0.049 6,表明3组患者累积生存率存在显著差异(P<0.05),A组生存率明显低于B组与C组,B组生存率低于C组,见图1。
3 讨论
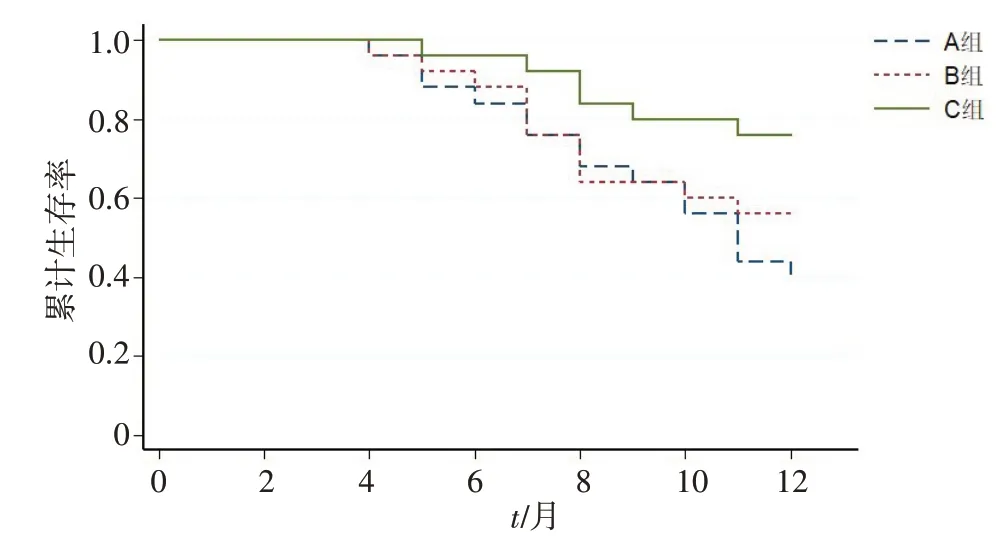
图1 3组患者累积生存率Fig.1 Cumulative survival rate of 3 groups
肺癌患者发生脑转移之后,疾病会进入快速进展阶段,一般预后不理想。放疗是肺癌脑转移最常用、最有效的治疗方法,目前常用放疗手段主要有全脑放疗、立体定向放疗及调强放疗。其中全脑放疗照射范围广,能较好地控制颅内多发转移瘤和亚临床病灶,但放射总剂量相对受限,导致肿瘤控制不理想[7-8]。立体定向放射治疗有较好的局部肿瘤控制率,具有治疗精确、靶区剂量高、周围损伤小、毒副作用小、风险低等特点,是肺癌脑转移瘤的有效治疗方法之一[9-10],但立体定向放射治疗靶区内外体积剂量落差大,病灶边缘剂量骤降,造成靶区外脑复发率较高。同步推量调强放疗属于先进放疗技术,其凭借逆向设计思路,通过多叶准直器的遮挡实现射线强度的不均匀输出,使靶区的剂量分布更趋向于合理,表现出更好的适形度,同时对邻近重要组织有较好的保护作用[11]。同步推量调强放疗综合了全脑放疗和立体定向放疗两者的优点,理论上是一种疗效更佳、副作用更小的放射治疗方法。
现阶段一些医院已开始在脑转移瘤中尝试应用同步推量调强放疗,且通过研究发现这一方法的效果比序贯放疗更好[12-14],且与图像引导结合,治疗也会更加安全。林辉等[15]研究发现全脑联合同步整合加量调强放疗通过局部加量技术提高了脑部可见病灶的控制率,毒副反应没有明显增多。李振生等[16]研究发现全脑放疗提高小细胞肺癌脑转移患者总生存和无颅内进展生存,但同期或后继局部增量照射无益于生存库再提高。目前,同步推量调强放疗的剂量分割方案还缺少统一标准,相关研究也较为少见。本研究通过1年随访,发现A组生存率明显低于B组与C组,B组生存率低于C组,3组的累积生存率存在显著差异(P<0.05),说明随着局部分割剂量的增加,治疗效果增加。
肺癌脑转移的治疗目的,除了延长生存时间,患者生存质量的提高越来越受到临床的重视。在实施放疗时,患者及家属不仅会关注治疗效果,同时还关心放疗的安全性,放疗所致不良反应是否严重[17]。放疗关键在于确定分割方案与照射剂量,保证杀灭肿瘤细胞与正常组织损伤之间维持一个平衡[18-19]。本研究结果发现,3 组患者的危及器官剂量及放疗不良发生情况是相当的,证明同步推量调强放疗治疗肺癌脑转移瘤是安全可靠的,而且随着分割剂量的增加,危及器官的剂量没有明显增加,放疗不良反应的发生率及程度均没有增加。对本研究结果进行总体分析,可以发现C 组的治疗方案在安全性方面与A、B 组等同,在治疗效果方面更占据优势,可见作为高分割剂量,C 组的放疗分割剂量在保证患者安全性的条件下,还能提高患者的治疗效果。
综上所述,同步推量调强放疗治疗肺癌脑转移瘤是一种安全有效的方法,其中全脑40 Gy/20f(2.0 Gy/f)+瘤区同步推量58 Gy/20f(2.9 Gy/f)的分割剂量放疗方案临床疗效最为理想。但因本研究病例样本量较少,在病例选择方面还存在一定偏差,本研究没有进行海马保护,其晚期不良反应的评价尚需继续随访。
