模拟酸雨对番茄光合作用和病害发生的影响及油菜素内酯对其缓解效应
2021-05-07李建鑫王文平胡璋健师恺
李建鑫,王文平,胡璋健,师恺
模拟酸雨对番茄光合作用和病害发生的影响及油菜素内酯对其缓解效应
李建鑫,王文平,胡璋健,师恺
浙江大学农业与生物技术学院,杭州 310058
【】在全球气候变化大背景下,酸雨沉降日益加剧,严重影响蔬菜等农作物的产量、品质和抗性。油菜素内酯(brassinosteroid,BR)是一类植物体中广泛存在的植物激素,具有广谱调控植物抗性的作用。研究外源油菜素内酯对模拟酸雨环境下蔬菜作物光合作用和病害发生的影响,明确其对酸雨条件下蔬菜危害的缓解效应,对蔬菜作物安全生产提供指导。本研究以番茄(L.)‘合作903’为材料,在模拟酸雨(模拟酸雨1(simulated acid rain 1,SiAR1):NH4NO3(1.3 g·L-1)、MgSO4·7H2O(3.1 g·L-1)、Na2SO4(2.5 g·L-1)、KHCO3(1.3 g·L-1)、CaCl2·2H2O(3.1 g·L-1),用1 N H2SO4调节pH至3.0;模拟酸雨2(SiAR2):杭州地区春季收集的雨水,pH调至3.0)和对照(喷施dH2O)条件下研究酸雨对番茄叶片光合作用和pv.DC3000(DC3000)引发的细菌性叶斑病发生的影响,其次在模拟酸雨和对照条件下对番茄叶片外源施用BR,研究外源施用BR对番茄叶片的光合特性和细菌性叶斑病发生的缓解作用,为了研究BR缓解作用的内在机制,测定番茄叶片光合作用关键基因、、和抗病基因、的表达以及抗氧化酶的活性。模拟酸雨导致番茄叶片净光合作用速率(Pn)、光系统II实际光化学效率(ΦPSII)及光化学淬灭系数(qP)显著下降;模拟酸雨削弱了番茄对DC3000的抗性,导致细菌性叶斑病发病率上升和菌落数显著增加。外源施用BR提高酸雨和对照条件下番茄叶片的光合作用,并有效增强了酸雨条件下番茄对DC3000的抗性,使酸雨条件下叶片菌落数下降,光系统II实际光化学效率提高。探究BR缓解效应的内在机制发现,外源施用BR显著提高了番茄叶片光合作用关键基因、、和抗病基因、等的表达,降低了膜脂质过氧化物丙二醛(MDA)的含量,并增加了愈创木酚过氧化物酶(G-POD)和过氧化氢酶(CAT)等抗氧化酶的活性,从而缓解模拟酸雨对番茄光合和抗病性的抑制作用。外源施用BR能够显著提高番茄内源光合相关基因和抗病基因的表达及抗氧化酶的活性,有效促进酸雨环境中番茄等园艺作物的生长和增强抗病性。
番茄;酸雨;油菜素内酯;光合作用;细菌性叶斑病
0 引言
【研究意义】酸雨(Acid rain)是指pH小于5.6的各种形式大气降水[1]。在全球气候变化大背景下,近年来我国酸雨频现,严重影响了农作物的生长发育及其健康生产[2-3]。但是,酸雨对农作物生长和抗性的影响,尤其是对蔬菜作物光合作用和病害发生的影响机理研究甚少,更缺乏针对酸雨危害的有效缓解途径。油菜素内酯(Brassinosteroid,BR)是甾醇类植物激素,具有高效调节生长发育的生理效应,并且能够提高植物对多种逆境的抗性[4-5],但BR对酸雨胁迫下植物光合及抗病性是否具有调控作用尚未见报道。番茄作为一种重要蔬菜栽培种类和研究模式作物,以其为研究对象,探究外源BR对酸雨胁迫下番茄光合作用和病害发生的调控作用,对蔬菜作物的高产高效安全生产具有一定的理论和现实意义。【前人研究进展】番茄是我国种植面积最大的蔬菜作物之一,南方以露地栽培为主,北方以保护地栽培为主。近年来,我国番茄年播种面积已达两千万亩,露地播种面积约九百万亩,占总播种面积的45%。2018年,我国受酸雨影响的面积达到53万km2,酸雨造成的蔬菜减产损失超22亿元,其中酸雨污染主要分布在长江以南—云贵高原以东地区[6]。酸雨影响植物的种子萌发、生长发育和抗性形成等一系列生命进程。其中,酸雨对植物生长的最大影响体现在其能破坏植株光合作用[7-8]。有研究表明,长时间酸雨环境会导致番茄类囊体膜的扭曲,破坏植物叶绿体结构[9-10]。用不同酸度的酸雨喷淋油菜发现,随着酸雨强度增加,油菜的光合作用被严重抑制[11]。另一方面,酸雨对植物的影响还体现在其对植物抗病性的抑制上。有关研究表明,酸雨能通过影响水杨酸(salicylic acid,SA)信号路径调控辣椒与细菌性叶斑病病菌()的相互作用[12]。酸雨还能破坏小麦植株的角质层,导致小麦对条锈病(f. sp.)抗性的减弱[13]。然而,酸雨会抑制香蕉叶斑病致病菌壳针孢菌()孢子的萌发和繁殖,使酸雨区香蕉叶斑病发病率比非酸雨区发病率明显降低[14]。但酸雨对植物与病原菌互作的影响尚未确定,有待深入研究。为了减少环境污染对农作物造成的危害,目前越来越多的植物生长调节剂被应用于促进生产,减少病害[15-16]。随着研究的不断深入,人们发现BR不仅能够提高植物的光合作用,调控光形态建成[17],还具有广谱抗性,能够显著提高植物对多种病原菌的抗性,包括丁香假单胞菌()、白粉病菌(sp.)、稻瘟病菌()、水稻黄单胞菌()[18]。但是BR是否能够有效缓解酸雨对植物生长和抗病等进程带来的不良影响尚且未知。【本研究切入点】酸雨对作物造成了严重的危害,导致光合作用的抑制和抗病性降低。作为植物内源激素,BR在植物诸多逆境响应中发挥了重要的积极作用。因此,探究外源施用BR是否能够缓解模拟酸雨下光合作用的下降以及病害加重的效应,并解析其内在机制非常必要。【拟解决的关键问题】通过对植物光合作用和抗病响应相关参数的分析,评估模拟酸雨对番茄光合和病害抗性造成的影响,及BR对酸雨胁迫的缓解作用。进一步利用qRT-PCR技术分析外源施用BR对模拟酸雨下番茄内源光合和抗病相关基因表达的变化,并分析抗氧化酶活性的变化,深入挖掘BR缓解酸雨胁迫的内在机制,为缓解酸雨对蔬菜等园艺作物危害和园艺作物高产高效安全生产提供科学依据。
1 材料与方法
试验于2016—2019年在浙江大学蔬菜研究所温室及实验室进行。
1.1 试验材料
1.1.1 供试番茄(L.)‘合作903’品种。番茄种子于55℃浸种10 min后置于28℃催芽2 d,待种子发芽后播种于含有草炭与蛭石为2﹕1(v/v)的50孔穴盘中,播种7 d后,将两片真叶充分展开的番茄幼苗移至营养钵(外径10 cm,高8.5 cm)中继续生长,控制生长环境条件为:温度25℃/21℃(昼/夜),光周期为12 h /12 h(昼/夜),光照强度为200 μmol·m-2·s-1,相对湿度60%左右。待番茄长至4叶1心时进行试验。模拟酸雨处理:选取生长状况一致的番茄植株分别喷施:模拟酸雨1(simulated acid rain 1,SiAR1),参照Velikova等[19]酸雨的配方:NH4NO3(1.3 g·L-1)、MgSO4·7H2O(3.1 g·L-1)、Na2SO4(2.5 g·L-1)、KHCO3(1.3 g·L-1)、CaCl2·2H2O(3.1 g·L-1),用1 N H2SO4调节pH至3.0;模拟酸雨2(SiAR2),为杭州地区春季收集的雨水,pH调至3.0);喷施dH2O作为对照。每次均匀喷施番茄叶面,以喷满整个叶面而没有水滴落下为准。每天处理一次,连续处理4 d。外源BR处理:喷施模拟酸雨前24 h,用1 μmol∙L-1BR喷施番茄植株叶片,以ddH2O作为对照。
1.2 试验方法
1.2.1 光合作用参数测定 用LI-6400型光合荧光测量系统(美国LI-COR公司)测定番茄净光合作用速率(Pn)、光化学淬灭(qP)。测定条件:光强为800 μmol∙m-2∙s-1,CO2浓度为400 μL·L-1,叶面温度为(25±1.5)℃。叶绿素荧光使用Imaging-PAM调制荧光成像系统(IMAG-MAXI;Heinz Walz,Germany)进行测定。植株暗适应0.5 h后,光化光强度和饱和光强度分别设为280 μmol∙m-2∙s-1和4 000 μmol∙m-2∙s-1,光系统Ⅱ实际光化学效率计算公式为ΦPSII=(Fm′-F)/Fm′[20],其中,F为任意时间实际荧光产量,Fm′为最大荧光产量。
1.2.2 病原菌的培养与接种 丁香假单胞菌番茄变种(pv.DC3000,DC3000)的培养参照THILMONY等[21]的方法,将DC3000菌种在含有25 mg·L-1利福平的KB固体培养基上于28℃光照培养箱中培养2 d。挑取单菌落于同样浓度抗生素的KB液体培养基中于28℃、200 r/min扩大培养约8—12 h后,调浓度至OD600=0.8—1.0,4 000×、4℃下离心5 min,得到的沉淀即为菌体。将菌体用10 mmol∙L-1MgCl2清洗两次后重新悬浮,浓度调为OD600= 0.01,加入有机硅至终浓度为0.03%。接病处理为将病原菌溶液均匀喷施番茄叶面,对照处理则喷施含有终浓度为0.03%有机硅的10 mmol∙L-1MgCl2溶液。
1.2.3 番茄植株感病评估DC3000细菌数量的计算参照KOCH等[22]的方法,取直径1.0 cm接种过病菌的番茄叶圆片,每个处理3个生物学重复,每个重复6个叶圆片。将叶圆片在70%的酒精中浸泡10 s后,用dH2O冲洗,置于含有500 μLMgCl2(10 mmol∙L-1)的1.5 mL磨样管中,4 000 r/min,20 s充分研磨。吸取磨好的样品用10 mmol∙L-1的MgCl2进行梯度稀释。取每个稀释液10 μL点在含有25 mg·L-1利福平的KB固体培养基上,28℃培养2 d,取菌落数范围在“9—90”的点计算叶片菌落数(Colony-forming unit,CFU)的数量。台盼蓝染色参照LEGRAND等[23]的方法并有所改进。将番茄叶圆片浸入65℃预热的染色液中,煮沸10 min后用保鲜膜包严,摇床上染色5—6 h。染色后将叶圆片置于脱色液中,脱色3—4次,每次洗涤5—6 h至叶片透明。透明叶片分别置于LEICA- DM400B显微镜下拍照。
1.2.4 抗氧化物酶活性及丙二醛(Malondialdehyde,MDA)含量测定 取0.3 g植物样品,加入3 mL 50 mmol∙L-1的PBS缓冲液,冰浴中研磨成匀浆,4℃下12 000 r/min离心20 min,取上清液用于抗氧化物酶活性测定。抗氧化酶活性及丙二醛含量测定参考陈建勋等[24]的方法。过氧化物酶(Guaiacol peroxidase,G- POD)活性采用愈创木酚法测定,过氧化氢酶(Catalase,CAT)活性采用紫外吸收法,蛋白质含量测定参照BRADFORD[25]的考马斯亮蓝法,MDA含量采用硫代巴比妥酸(Thiobarbituric acid,TBA)法测定[26]。
1.2.5 植物总RNA提取和qRT-PCR检测 植物总RNA的提取参照天根生化公司(TIANGEN)试剂盒操作步骤;cDNA的合成参照TOYOBO公司反转录试剂盒操作步骤。
qRT-PCR在荧光定量PCR Light Cycler 480Ⅱ平台(Roche)上进行,反应条件参见AceQ qPCR SYBR Green Master Mix荧光染料试剂盒(Vazyme公司),qRT-PCR引物的设计采用软件Primer 5.0,特异性引物序列如表1所示。
PCR反应体系设置为:10 μL AceQ qPCR SYBR Green Master Mix,1 μL cDNA模板,上、下游引物各0.4 μL,7.2 μL ddH2O。选取番茄的看家基因作为荧光定量的内参指标,相对基因表达量参照LIVAK等[27]的2-ΔΔCT法进行计算。
1.3 统计方法
试验结果均为3次重复的平均值,利用Microsoft Excel 2016整理数据;运用SAS 9.1 Tukey法进行差异显著性分析;运用Origin 2017作图。

表1 基因qRT-PCR特异性引物
2 结果
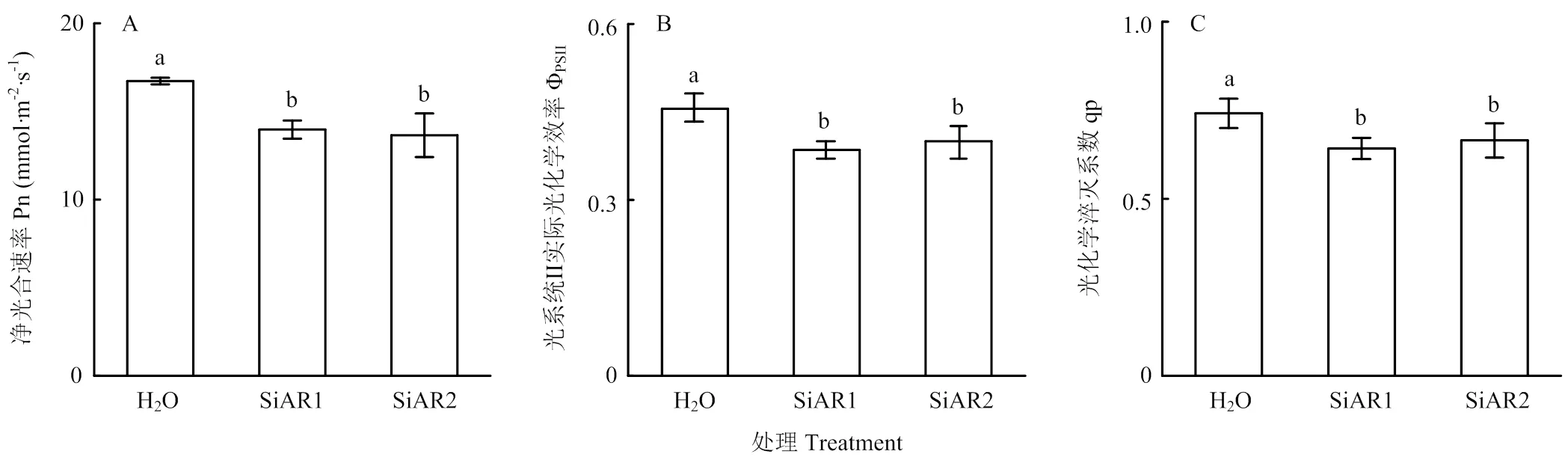
2.1 模拟酸雨对番茄叶片光合作用和抗病性的影响
SiAR1和SiAR2处理的番茄植株相较于对照植株,其叶片的Pn分别下降了16.5%与18.4%(图1-A),ΦPSII分别降低15.5%与12.8%(图1-B),而qP也分别下降了13.4%与10.3%(图1-C)。上述结果表明模拟酸雨处理导致番茄光合反应速率减弱,光能利用率降低,导致光合作用受到抑制。
利用模拟酸雨体外培养DC3000病原菌,发现酸雨条件下病原菌12 h时生长量仅为对照的6.8%(图2-A),表明模拟酸雨能显著抑制病原菌DC3000增殖。但是,对模拟酸雨处理过的番茄植株接种DC3000病原菌,接种2 d后观察发现SiAR1和SiAR2处理的番茄植株叶片发病比对照组更严重(图2-B)。此外,模拟酸雨加剧了DC3000侵染后番茄叶片中死细胞的积累,使番茄植株发病率提高了2倍(图2-C),同时也导致番茄叶片上的病原菌菌落数增加了约38.4%(图2-D)。综上,模拟酸雨处理削弱了番茄对DC3000的抗性。
2.2 BR对模拟酸雨环境下番茄光合作用的影响
在SiAR1和SiAR2两种模拟酸雨环境下,外源施用1 μmol∙L-1BR后,番茄植株的Pn比对照分别提高了13.7%和14.8%(图3-A),ΦPSII分别提高了7.8%和11.1%(图3-B),qP分别提高了12.8%和18.1%(图3-C)。综上,外源施用BR显著提高了模拟酸雨环境下番茄的光合效率。
2.3 BR对模拟酸雨环境下番茄细菌性叶斑病抗性的影响
在非酸雨处理环境下,外源BR处理组细菌菌落数与对照组相比降低了3.8%;这一效应在模拟酸雨环境下更加明显,对番茄叶片进行SiAR1、SiAR2处理后外源施用BR,其细菌菌落数与对照相比都降低了约7.7%(图4-A)。从图4-B可以看出,接种DC3000并酸雨处理的叶片ΦPSII值均降低,而在酸雨条件下外源施用BR后能明显缓解因病原菌接种导致的ΦPSII下降,这与细菌菌落数ΦPSII成像图(图4-C)的结果表现一致。因此,外源施用BR使番茄叶片DC3000菌落生长量降低,在一定程度上抑制了菌落的生长,并使病菌对ΦPSII的影响减小,能够显著缓解细菌性叶斑病造成的ΦPSII降低,尤其能够缓解酸雨环境下病菌对番茄的危害。
2.4 BR对模拟酸雨和Pst DC3000处理条件下光合作用和抗病相关基因表达的影响
进一步测定光合作用关键酶果糖-1,6-二磷酸酶(FBPase)、景天庚酮糖-1,7-二磷酸酯酶(SBPase)、核酮糖1,5-二磷酸羧化/加氧酶(Rubisco)等编码基因的表达量情况。模拟酸雨处理4 d后,等基因表达均受到了不同程度的抑制(图5),外源施用BR后,酸雨条件下的表达量相对于未进行BR处理的对照增加了3—7倍(图5)。表明酸雨抑制了光合作用相关基因的表达,而酸雨环境下外源BR有助于激活光合作用相关基因的转录与表达,进而增强番茄的光合作用。同样,外源施用BR后,番茄在模拟酸雨条件下响应病原菌入侵时病程相关基因比对照上调了6—8倍(图6-A),则上调了4—13倍(图6-B),BR诱导的内源抗病基因表达上调有助于提高番茄对DC3000的抗性。
H2O:对照组,用dH2O喷施叶片;SiAR1:SiAR1喷施叶片;SiAR2:SiAR2喷施叶片。不同小写字母表示处理间差异显著(P<0.05)。下同

图2 模拟酸雨对番茄对细菌性叶斑病发生的影响

图3 外源BR对模拟酸雨环境下番茄光合系统的影响
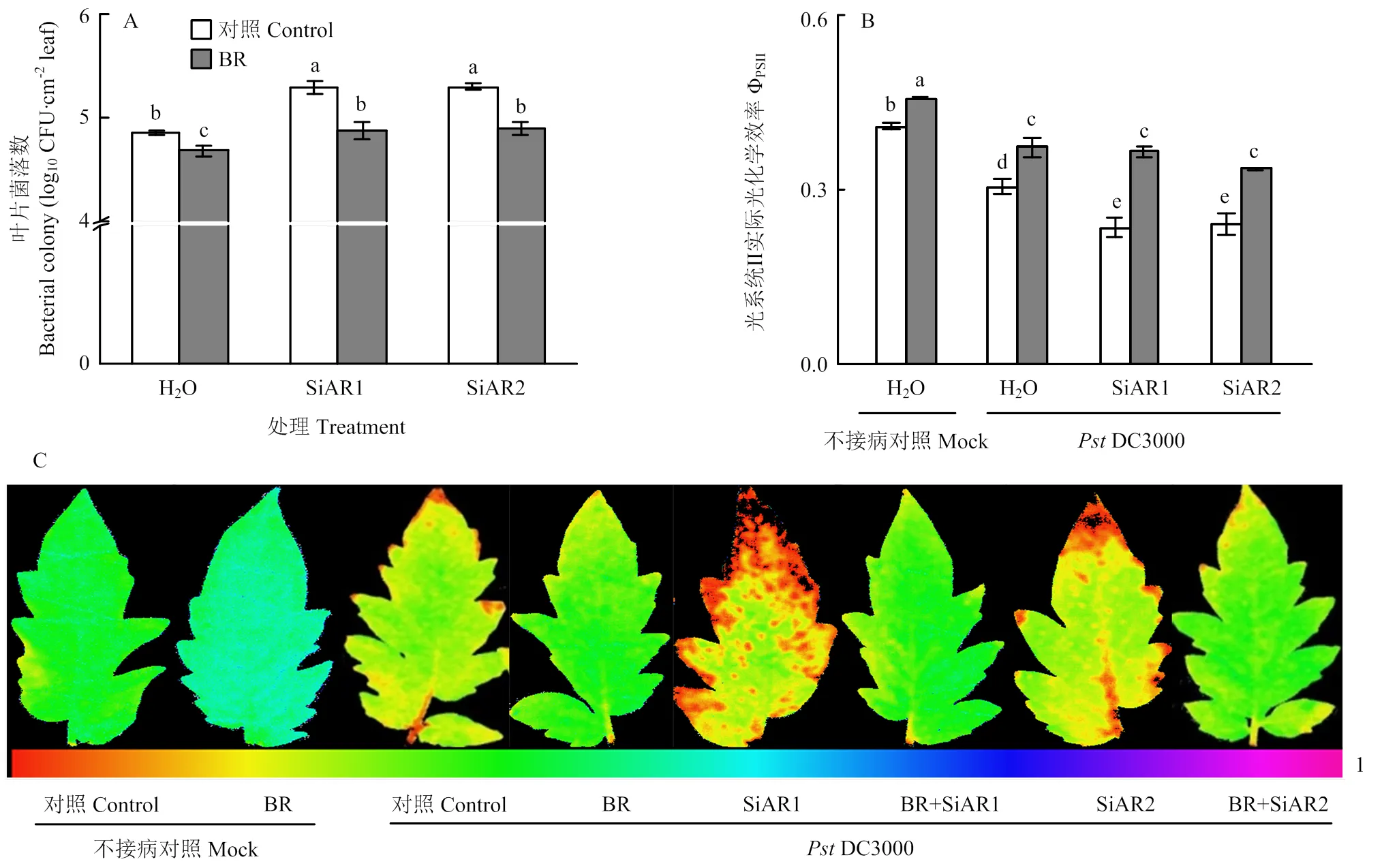
图4 外源BR对模拟酸雨环境下番茄细菌性叶斑病抗性的影响
此外,外源施用BR使两种模拟酸雨环境下MDA含量分别降低了22.8%和21.9%(图7-A),使G-POD活性分别提高了19.6%和22.8%(图7-B),CAT的活性分别提高29.1%和21.6%(图7-C)。以上结果表明,酸雨与BR都能够影响番茄的氧化还原稳态,外源施用BR能够显著降低番茄的膜脂过氧化水平,并在酸雨处理的基础上进一步提高抗氧化酶的活性,进而提高番茄植株对酸雨的抗性。

图5 外源BR对在模拟酸雨下番茄叶片中光合相关基因表达的影响

图6 外源BR对在模拟酸雨下番茄叶片中抗病基因表达的影响

图7 外源BR对番茄叶片中MDA含量和抗氧化酶活性的影响
3 讨论
叶片是植物光合作用的主要器官,酸雨会直接影响叶片的生理状况和光合机构进而影响叶片的光合作用。前人研究表明,酸雨可以影响植物的叶绿素荧光参数、气孔运动、光合色素、光合蛋白酶等来危害植物的光合作用,使植物光合作用速率降低[28]。本研究发现,模拟酸雨处理4 d使番茄叶片的Pn显著降低,这与姚桃峰等[29]研究酸雨使拔节期小麦Pn显著下降的结果一致。研究发现,酸雨对不同生态型和不同生育期植物的Pn均有显著影响[30]。酸雨不仅降低番茄的光合速率,还破坏番茄的光化学系统。本研究中酸雨使番茄PSII严重受损,类似研究也有报道,YU等[31]研究黄瓜发现经酸雨处理3 h后,ΦPSII随酸雨的pH减小呈显著下降趋势。GABARA等[32]用pH 1.8的酸雨喷淋番茄,发现其PSII结构发生扭曲,酸雨还能导致活性氧积累来加重PSII的损伤[33]。
酸雨对植物-病原菌互作的影响是复杂的,其引起的酸性环境能够显著抑制病菌的萌发和繁殖能力,本研究用酸雨体外培养病菌发现酸雨显著抑制了DC3000病菌繁殖。有研究报道,酸雨处理使小麦叶枯病菌()孢子萌发率显著降低,而且雨水中亚硫酸盐浓度的升高显著增加了小麦颖枯病菌()的感染率[34]。酸雨还可能通过降低寄主植物免疫能力,增强病原菌致病力来削弱植物的抗病性。本研究中模拟酸雨处理后番茄侵染DC3000,发现番茄感病更加严重,抗病性明显下降。袁志文[35]研究发现,在邻近重酸雨区的马尾松落针病()和赤落叶病()的病情较无酸雨区更加严重,酸性降水增加了对表皮的侵蚀,植物的免疫系统受到损害,病菌扩散更为迅速,导致死细胞数量明显增多。上述研究结果说明酸雨影响植物光合作用的同时,加剧了细菌性叶斑病的发生。
BR作为植物体内重要的激素,能够调节植物叶片的发育,并参与光形态建成,直接和间接的调节植物的光合作用[36]。本试验中外源施用BR能显著提高模拟酸雨环境下番茄叶片的Pn、qP和ΦPSII,增加酸雨胁迫下PSII反应中心的光能利用率,有效缓解酸雨对光合作用的损害。JIN等[37]在高温胁迫下对榕树进行BR处理,显著提高了抗氧化酶活性并有效减轻高温对PSII反应中心的损伤。研究发现酸雨胁迫与其他逆境胁迫类似,都会诱导植物产生过量活性氧,破坏光合结构,而外源BR有助于缓解活性氧等有害物质的积累。陆晓民[38]用1 mg·L-1BR处理大豆,提高了渍水胁迫下大豆幼苗的叶绿素含量、脯氨酸含量,并抑制了MDA增生,降低了细胞膜透性,提高了大豆的光合作用。同样,KUREPIN等[39]的研究也证实外源BR有助于缓解弱光胁迫,提高植物的光合作用。另外有研究表明,FBPase、SBPase、Rubisco都是光合碳代谢和光呼吸的关键酶,可以直接影响碳固定[40]。本研究中酸雨抑制了、、的表达,而外源施用BR显著提高了这些基因的表达。光照条件下,BR可以通过BR信号转导因子BZR1(Brassinazole resistant 1)结合于光信号转导中的转录调节因子来调控光合基因的表达[41]。在模拟酸雨条件下,外源施用BR能够诱导其信号元件参与到光信号途径中,调控光合基因的表达,进而提高植物的光合作用,增强PSII光化学反应能力,保护植物的光合结构[42]。
BR除了具有促进植物生长发育等作用外,其信号途径在植物免疫反应中也发挥着积极的正调节作用[43]。BRI1(Brassinosteroid insensitive 1)是细胞膜表面受体,它能够识别BR信号。有研究报道,烟草中BR参与到乙烯介导的对DC3000的抗性,外源BR与乙烯均能提高烟草的抗性,而且BRI1的缺失也导致烟草对DC3000更加敏感[44]。本试验对番茄叶片外源施用BR后,显著抑制了病原菌在植物中的生长。有研究报道外施BR可以增强烟草抵御和sp.侵染[43];同样喷施BR后,葡萄对霜霉病()和灰霉病()的抗性都显著增强[45]。本研究中,外源施用BR显著提高了番茄植株响应DC3000时内源抗病基因和的表达,这与拟南芥中BR信号能够提高抗病基因表达,激活免疫反应的模式类似[46]。另外,多种逆境胁迫都会导致植物积累活性氧等有害物质,而植物通过提高抗氧化酶活性来缓解逆境胁迫,酸雨胁迫也不例外。本试验中不仅酸雨使抗氧化酶活性增加,外源施用BR也使酸雨条件下多种抗氧化酶活性提高,有助于激活番茄的抗性,使番茄更能抵御酸雨的侵害。
4 结论
模拟酸雨不仅导致番茄作物光合作用下降,还加剧了番茄细菌性叶斑病的发生。外源施用BR则能显著促进番茄内源光合与抗病相关基因的表达,提高抗氧化酶活性,有效缓解模拟酸雨对光合作用的危害,同时提高对细菌性叶斑病的抗性。因此,外源施用BR有助于提高植物对酸雨胁迫的抗性,研究结果为应对酸雨危害,探索酸雨胁迫缓解途径提供了科学依据。
[1] EVANS L S. Botanical aspects of acidic precipitation. The Botanical Review, 1984, 50(4): 449-490.
[2] 刘萍, 夏菲, 潘家永, 陈益平, 彭花明, 陈少华. 中国酸雨概况及防治对策探讨. 环境科学与管理, 2011, 36(12): 30-35, 84.
LIU P, XIA F, PAN J Y, CHEN Y P, PENG H M, CHEN S H. Discuss on present situation and countermeasures for acid rain prevention and control in China.Environmental Science and Management, 2011, 36(12): 30-35, 84. (in Chinese)
[3] 黎华寿, 聂呈荣, 胡永刚. 模拟酸雨对杂交稻常规稻野生稻影响的研究. 农业环境科学学报, 2004, 23(2): 284-287.
LI H S, NIE C R, HU Y G. Effects of simulated acid rain on hybrid, common and wild rice varieties. Journal of Agro-Environment Science, 2004, 23(2): 284-287. (in Chinese)
[4] CAO Y Y, ZHAO H. Protective roles of brassinolide on rice seedlings under high temperature stress. Rice Science, 2008, 15(1): 63-68.
[5] SYMONS G M, DAVIES C, SHAVRUKOV Y, DRY I B, REID J B, THOMAS M R. Grapes on steroids brassinosteroids are involved in grape berry ripening. Plant Physiology, 2006, 140(1): 150-158.
[6] 2018年《中国生态环境状况公报》(摘录一). 环境保护, 2019, 47(11): 47-53.
China ecological environment status bulletin in 2018 (Excerpt 1). Environmental Protection, 2019, 47(11): 47-53. (in Chinese)
[7] ZHANG J, JIANG X D, LI T L, CAO X J. Photosynthesis and ultrastructure of photosynthetic apparatus in tomato leaves under elevated temperature. Photosynthetica, 2014, 52(3): 430-436.
[8] WANG L H, WANG W, ZHOU Q, HUANG X H. Combined effects of lanthanum (III) chloride and acid rain on photosynthetic parameters in rice. Chemosphere, 2014, 112: 355-361.
[9] DEBNATH B, HUSSAIN M, IRSHAD M, MITRA S, LI M, LIU S, QIU D L. Exogenous melatonin mitigates acid rain stress to tomato plants through modulation of leaf ultrastructure, photosynthesis and antioxidant potential.Molecules, 2018, 23(2): 388-403.
[10] GABARA B, SKŁODOWSKA M, WYRWICKA A, GLIŃSKA S, GAPIŃSKA M. Changes in the ultrastructure of chloroplasts and mitochondria and antioxidant enzyme activity inMill. leaves sprayed with acid rain. Plant Science, 2003, 164(4): 507-516.
[11] 麦博儒, 郑有飞, 吴荣军, 梁骏, 刘霞. 模拟硫酸型、硝酸型及其混合型酸雨对油菜生理特性、生长和产量的影响. 植物生态学报, 2010, 34(4): 427-437.
MAI B R, ZHENG Y F, WU R J, LIANG J, LIU X. Effects of simulated sulfur-rich, nitric-rich and mixed acid rain on the physiology, growth and yield of rape (). Chinese Journal of Plant Ecology, 2010, 34(4): 427-437. (in Chinese)
[12] DUTTA B, LANGSTON D B, LUO X, CARLSON S, KICHLER J, GITAITIS R. A risk assessment model for bacterial leaf spot of pepper (), caused by, based on concentrations of macronutrients, micronutrients, and micronutrient ratios. Phytopathology, 2017, 107(11): 1331-1338.
[13] 王树和, 孙佩璐, 周文楠, 刘婷, 马占鸿. 模拟酸雨对小麦条锈病流行学组分的影响. 植物保护学报, 2018, 45(1): 173-180.
WANG S H, SUN P L, ZHOU W N, LIU T, MA Z H. Effect of simulated acid rain on disease progress of wheat yellow rust. Journal of Plant Protection, 2018, 45(1): 173-180. (in Chinese)
[14] TRUJILLO E E, KADOOKA C Y, TANIMOTO V, BERGFELD S, SHISHIDO G, KAWAKAMI G. Effective biomass reduction of the invasive weed species banana poka by septoria leaf spot. Plant Disease, 2001, 85(4): 357-361.
[15] VERMA V, RAVINDRAN P, KUMAR P P. Plant hormone-mediated regulation of stress responses. BMC Plant Biology, 2016, 16(1): 86.
[16] HAN S Y, LIU H, YAN M, QI F Y, WANG Y Q, SUN Z Q, HUANG B Y, DONG W Z, TANG F S, ZHANG X Y, HE G H. Differential gene expression in leaf tissues between mutant and wild-type genotypes response to late leaf spot in peanut (L.). PLoS ONE, 2017, 12(8): e0183428.
[17] AHAMMED G J, CHOUDHARY S P, CHEN S, XIA X, SHI K, ZHOU Y, YU J. Role of brassinosteroids in alleviation of phenanthrene- cadmium co-contamination-induced photosynthetic inhibition and oxidative stress in tomato. Journal of Experimental Botany, 2013, 64(1): 199-213.
[18] YU M H, ZHAO Z Z, HE J X. Brassinosteroid signaling in plant-microbe interactions. International Journal of Molecular Sciences, 2018, 19(12): 4091.
[19] VELIKOVA V, YORDANOV I, KURTEVA M, TSONEV T. Effects of simulated acid rain on the photosynthetic characteristics ofL. Photosynthetica, 1998, 34(4): 523-535.
[20] SUN Y J, GENG Q W, DU Y P, YANG X H, ZHAI H. Induction of cyclic electron flow around photosystem I during heat stress in grape leaves. Plant Science, 2017, 256: 65-71.
[21] THILMONY R, UNDERWOOD W, HE S Y. Genome-wide transcriptional analysis of the Arabidopsis thaliana interaction with the plant pathogenpv.DC3000 and the human pathogenO157:H7. The Plant Journal, 2006, 46(1): 34-53.
[22] KOCH E, SLUSARENKO A.is susceptible to infection by a downy mildew fungus. The Plant Cell, 1990, 2(5): 437-445.
[23] LEGRAND C, BOUR J M, JACOB C, CAPIAUMONT J, MARTIAL A, MARC A, WUDTKE M, KRETZMER G, DEMANGEL C, DUVAL D, HACHE J. Lactate dehydrogenase (LDH) activity of the number of dead cells in the medium of cultured eukaryotic cells as marker. Journal of Biotechnology, 1992, 25(3): 231-243.
[24] 陈建勋, 王晓峰. 植物生理学实验指导(第二版). 广州: 华南理工大学出版社, 2006: 64-66.
CHEN J X, WANG X F. Guidance of Plant Physiological Experiment (2ndedition). Guangzhou: South China University of Technology Publishers, 2006: 64-66. (in Chinese)
[25] BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein- dye binding. Analytical Biochemistry, 1976, 72: 248-254.
[26] HODGES D M, DELONG J M, FORNEY C F, PRANGE R K. Improving the thiobarbituric acid-reactive-substances assay for estimating lipid peroxidation in plant tissues containing anthocyanin and other interfering compounds. Planta, 1999, 207(4): 604-611.
[27] LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2−ΔΔCTmethod. Methods, 2001, 25(4): 402-408.
[28] WYRWICKA A, SKŁODOWSKA M. Influence of repeated acid rain treatment on antioxidative enzyme activities and on lipid peroxidation in cucumber leaves. Environmental and Experimental Botany, 2006, 56(2): 198-204.
[29] 姚桃峰, 王润元, 王鹤龄, 赵鸿. 拔节期模拟酸雨对春小麦叶片光合特性的影响. 安徽农业科学, 2010, 38(15): 8069-8073.
YAO T F, WANG R Y, WANG H L, ZHAO H. Stress effects of simulated acid rain on photosynthetic characteristics of field-grown spring wheat at the jointing stage. Journal of Anhui Agricultural Sciences, 2010, 38(15): 8069-8073. (in Chinese)
[30] SUN Z G, WANG L H, CHEN M M, WANG L, LIANG C J, ZHOU Q, HUANG X H. Interactive effects of cadmium and acid rain on photosynthetic light reaction in soybean seedlings. Ecotoxicology and Environmental Safety, 2012, 79: 62-68.
[31] YU J Q, YE S F, HUANG L F. Effects of simulated acid precipitation on photosynthesis, chlorophyll fluorescence, and antioxidative enzymes inL. Photosynthetica, 2002, 40(3): 331-335.
[32] GABARA B, SKŁODOWSKA M, WYRWICKA A, GLIŃSKA S, GAPIŃSKA M. Changes in the ultrastructure of chloroplasts and mitochondria and antioxidant enzyme activity inMill. leaves sprayed with acid rain. Plant Science, 2003, 164(4): 507-516.
[33] JOZEF K, BOŘIVOJ K, MARTIN B, FRANTIŠEK S, JOSEF H. Physiological responses of root-less epiphytic plants to acid rain. Ecotoxicology, 2011, 20(2): 348-357.
[34] CHANDRAMOHAN P, SHAW M W. Sulphate and sulphurous acid alter the relative susceptibility of wheat toand. Plant Pathology, 2013, 62(6): 1342-1349.
[35] 袁志文. 酸雨与马尾松病害的发生调查初报. 生态学杂志, 1988, 7(5): 50-52.
YUAN Z W. Acid rain and the occurrence of diseases in. Chinese Journal of Ecology, 1988, 7(5): 50-52. (in Chinese)
[36] YANG A J, ANJUM S A, WANG L, SONG J X, ZONG X F, LV J, ZOHAIB A, ALI I, YAN R, ZHANG Y, DONG Y F, WANG S G. Effect of foliar application of brassinolide on photosynthesis and chlorophyll fluorescence traits ofunder varying levels of shade. Photosynthetica, 2018, 56(3): 873-883.
[37] JIN S H, LI X Q, WANG G G, ZHU X T. Brassinosteroids alleviate high-temperature injury inseedlings via maintaining higher antioxidant defence and glyoxalase systems. AoB Plants, 2015, 21(7): plv009.
[38] 陆晓民, 陈勇, 贡伟, 陈运梅. 油菜素内酯对毛豆幼苗生长及其抗渍性的影响. 生物学杂志, 2006, 23(3): 37-38.
LU X M, CHEN Y, GONG W, CHEN Y M. Effect of brassinolide on the seedling growth and water logging resistance of soybean.Journal of Biology, 2006, 23(3): 37-38. (in Chinese)
[39] KUREPIN L V, JOO S H, KIM S K, PHARIS R P, BACK T G. Interaction of brassinosteroids with light quality and plant hormones in regulating shoot growth of young sunflower andseedlings. Journal of Plant Growth Regulation, 2012, 31(2): 156-164.
[40] YOSHIDA K, HISABORI T. Determining the rate-limiting step for light-responsive redox regulation in Chloroplasts. Antioxidants, 2018, 7(11): 153-160.
[41] LUO X M, LIN W H, ZHU S W, ZHU J Y, SUN Y, FAN X Y, CHENG M L, HAO Y Q, OH E, TIAN M M, LIU L J, ZHANG M, XIE Q, CHONG K, WANG Z Y. Integration of light and brassinosteroid- signaling pathways by a GATA transcription factor in. Developmental Cell, 2010, 19(6): 872-883.
[42] WHITNEY S M, HOUTZ R L, ALONSO H. Advancing our understanding and capacity to engineer nature’s CO2-sequestering enzyme, Rubisco. Plant Physiology, 2011, 155(1): 27-35.
[43] NAKASHITA H, YASUDA M, NITTA T, ASAMI T, FUJIOKA S, ARAI Y, SEKIMATA K, TAKATSUTO S, YAMAGUCHI I, YOSHIDA S. Brassinosteroid functions in a broad range of disease resistance in tobacco and rice.The Plant Journal, 2003, 33(5): 887-898.
[44] XIONG J, HE R, YANG F, ZOU L, YI K, LIN H, ZHANG D. Brassinosteroids are involved in ethylene-inducedDC3000 resistance in. Plant Biology, 2020, 22(2): 309-316.
[45] 刘庆. 24-表油菜素内酯诱导葡萄抵抗霜霉病和灰霉病的研究[D]. 杨凌: 西北农林科技大学, 2016.
LIU Q. Effct of 24-epibrassinolide induced resistance of grapevine against downy mildew and grape against grey mould [D]. Yangling: Northwest A&F University, 2016. (in Chinese)
[46] YAN H J, ZHAO Y F, SHI H, LI J, WANG Y C, TANG D Z. Brassinosteroid-signaling kinase1 phosphorylates MAPKKK5 to regulate immunity in., 2018, 176(4): 2991-3002.
Effects of Simulated Acid Rain Conditions on Plant Photosynthesis and Disease Susceptibility in Tomato and Its Alleviation of Brassinosteroid
LI JianXin, WANG WenPing, HU ZhangJian, SHI Kai
College of Agriculture and Biotechnology, Zhejiang University, Hangzhou 310058
【】In the era of climate change, the acid rain deposition has become a global environmental issue, which seriously affects the yield, quality and disease incidence of vegetables and other crops. Brassinosteroids (BRs) are a group of plant hormones widely existing in plants, which regulate plant resistance to broad-spectrum environment stresses. The aim of this study was to investigate effects of BRs on plant photosynthesis and disease susceptibility in tomato under simulated acid rain conditions and its alleviation effect, so as to provide guidance for safety production of vegetable crop.【】In this study, using tomato (L.) cultivar ‘Hezuo 903’ as material, the effects of exogenous BR foliar spray on the photosynthetic characteristics and the incidence of bacterial leaf spot disease caused bypv.DC3000 (DC3000) were studied under two levels of simulated acid rain including simulated acid rain 1 (SiAR2): NH4NO3(1.3 g·L-1),MgSO4·7H2O (3.1 g·L-1),Na2SO4(2.5 g·L-1),KHCO3(1.3 g·L-1),CaCl2·2H2O (3.1 g·L-1), pH (3.0, adjusted by 1N H2SO4) and simulated acid rain 2 (SiAR2): rain from Hanzhou area in spring, pH (3.0, adjusted by 1N H2SO4), and spraying leaves with H2O as control condition. Thealleviation of exogenous BR were studied through spraying exogenous BR on tomato leaves under two levels of simulated acid rain and control conditions. To reveal the underlying mechanism of BR induced stress alleviation, the transcript abundance of photosynthesis-related genes (e.g.), defense-related genes (e.g.and), and the activity of antioxidant enzymes weremeasured.【】The results showed that the phytotoxic effect of simulated acid rain on photosynthesis in tomato was mainly reflected by the decrease of net photosynthesis rate (Pn), the photosystem II photochemical efficiency (ΦPSII), and the photochemical quenching coefficient (qP). The simulated acid rain increased tomato susceptibility toDC3000, resulting in a significant increase in disease incidence and leaf bacterial population. However, the exogenous BR was able to enhance the leaf photosynthetic capacity and decrease the susceptibility of tomato toDC3000 by reducing the leaf bacterial population under two levels of simulated acid rain and control conditions Furthermore, the exogenous BR treatment was able to protect plant photosynthesis and pathogen resistance from the damages caused by simulated acid rain. The BR pretreatment not only significantly increased the transcript abundance of photosynthesis-related genes (e.g.e, SBPase, a) and defense-related genes (e.g.and), but also reduced the content of malondialdehyde and enhanced the activity of G-POD and CAT in tomato plants under simulated acid rain treatments.Thus, the exogenous BR alleviated the inhibition of simulated acid rain on tomato photosynthesis and disease resistance.【】It was concluded that exogenous BR could increase leaf photosynthesis, transcript abundance of photosynthesis,defense-related genes, and the activity of antioxidant enzymes under simulated acid rain, and could also improve the resistance of tomato plants to bacterial leaf pathogen.
tomato; acid rain; brassinosteroid; photosynthesis; bacterial leaf spot

10.3864/j.issn.0578-1752.2021.08.012
2020-07-04;
2020-11-13
浙江省自然科学基金杰出青年项目(LR19C150001)、浙江省重点研发计划(2021C2040)
李建鑫,E-mail:1123819253@qq.com。通信作者师恺,E-mail:kaishi@zju.edu.cn
(责任编辑 赵伶俐)
