羊毛角蛋白降解菌的筛选鉴定及液体发酵条件优化
2021-05-06龙宏燕梁文英陈风蔚王睿勇
龙宏燕 梁文英 陈风蔚 王睿勇
摘要:从长年堆积羊毛的土壤中筛选获得3株具有角蛋白降解功能的菌株,经形态观察和16SrRNA测序初步鉴定,并分别命名为链霉菌NJU-05、金黄杆菌NJU-07、地衣芽孢杆菌NJU-10。同时,进行液体发酵工艺优化,得到NJU-05菌株实验室水平的最佳液体发酵条件:温度为40℃,pH值为9.0,发酵周期为3d;NJU-07菌株:温度为35℃,pH值为9.0,发酵周期为4d;NJU-10菌株:温度为35℃,pH值为9.0,发酵周期为4d。
关键词:羊毛角蛋白;液体发酵;工艺优化;降解菌;筛选鉴定
中图分类号:S182文献标志码:A
文章编号:1002-1302(2021)04-0200-05
作者简介:龙宏燕(1995—),女,安徽淮南人,硕士研究生,主要从事应用微生物研究。E-mail:longhongyan1995@163.com。
通信作者:王睿勇,博士,副教授,主要从事应用微生物研究。E-mail:wangry@nju.edu.cn。
近年来,随着养殖业的迅猛发展,和我国是革制大国的基本国情,会产生大量的羊毛、皮革加工废弃物。有统计显示,我国每年平均产生角蛋白类废弃物的总量超过400万t[1],这些废弃物由于难于加工且不易降解,大部分未得到合理利用。这类废弃物大量堆积不仅会造成环境的严重污染,同时也是一种极大的资源浪费[2]。研究羊毛废弃物的再生利用,不仅可以解决由它引发的环境污染问题,而且可以缓解我国蛋白质饲料的供需矛盾,同时在纺织、医用生物材料、包装等诸多领域都有广阔的前景[3]。
国内外研究表明,微生物及其酶降解法是利用动物角蛋白最经济有效的手段[4],且对环境友好。微生物通过合成角蛋白酶降解角蛋白,其降解角蛋白过程大致可分为3个步骤:变性作用、水解作用和转氨基作用[5]。目前,已发现30多种微生物具有降解角蛋白的功能,以细菌、真菌和放线菌为主,其中细菌主要有地衣芽孢杆菌、嗜热菌、弧菌科细菌;放线菌中大多是链霉菌属[6];真菌主要有长囊头孢霉菌和皮肤癣菌[7]。
本研究旨在从土壤中分离纯化出具有高效羊毛角蛋白降解能力的菌株,并对其液體发酵条件进行优化,为大量的废弃羊毛提供方便高效实用的微生物利用途径。
1材料与方法
1.1供试材料
1.1.1羊毛粉未经酸碱处理的羊毛清水洗净后在温度为60℃条件下烘干至恒质量,粉碎机粉碎过筛后备用。
1.1.2培养基BM基础培养基:1.500gK2HPO4、0.025gMgSO4·7H2O、0.025gCaCl2、0.015gFeSO4·7H2O、0.005gZnSO4·7H2O,1000mL蒸馏水,pH值为7.8~8.0。
羊毛分解能力测试培养基(筛选培养基):在15mLBM基础培养基中加入10根完整羊毛。
液体发酵培养基:50mLBM基础培养基与0.5g羊毛粉一同装入250mL锥形瓶中,灭菌备用。
1.2微生物的分离筛选
1.2.1采集样品在宿迁市泗阳县168乡道新袁镇山羊养殖基地,从羊圈表层、长期堆积羊毛废弃物处、放牧的农用荒地及羊群活动的地方采集的4种土壤样品。
1.2.2筛选分离富集培养:在15mLBM基础培养基中加入1g土壤样品及适量羊毛,在温度为37℃条件下培养,观察羊毛的降解情况。试管中的羊毛发生降解,且可溶性蛋白检测有蓝色反应,反复转接,得到富集培养液。
初筛:取富集培养液分别在牛肉膏蛋白胨、高氏Ⅰ号及马铃薯葡萄糖(PDA)培养基的平板上稀释涂布分离,挑选单菌落进一步纯化后转接斜面。37℃活化后,将活化菌接入测试管验证其对羊毛角蛋白的降解能力,选取有降解能力的菌株保藏备用。
复筛:取1mL初筛得到的活化菌液接种于100mLBM基础培养液中,于37℃、140r/min摇床培养5d。测定降解率、可溶性蛋白含量及角蛋白酶活性,分析各菌株对羊毛的降解能力。分析比对,从中挑选3株降解率最高的菌株,命名为NJU-05、NJU-07、NJU-10,接入斜面后保藏于4℃冰箱中,备用。
1.3菌种鉴定
分别对NJU-05、NJU-07、NJU-10的菌落进行形态学观察、结合16SrRNA基因序列分析进行菌种鉴定。
1.4液体发酵条件优化试验
于液体发酵培养基中分别接种,以培养温度及培养基起始pH值作为主要的参数研究NJU-05、NJU-07、NJU-10对羊毛的降解,其中培养温度分别设置为25、30、35、40、45℃;培养基起始pH值分别设置为6、7、8、9、10。
1.5发酵周期
在最适温度和最适pH值条件下,140r/min摇床培养,每24h取样1次,测定羊毛降解率、角蛋白酶活性、可溶性蛋白含量[8],确定最佳发酵时间。
2结果与分析
2.1羊毛降解菌的筛选分离
2.1.1富集与初筛
采集的土样进行富集培养后,通过初筛获得50个生长良好的单菌落。将单菌落转接入测试管,观察发现随着培养时间的延长,培养基的颜色逐渐加深,并出现沉淀。说明羊毛逐渐发生断裂、降解。据此,筛选得到具有该现象较为明显的18株菌,并根据所用培养基成分、菌落形态及镜检结果,初步判断18株菌株中有7株为放线菌,9株为细菌,2株为真菌。
2.1.2复筛
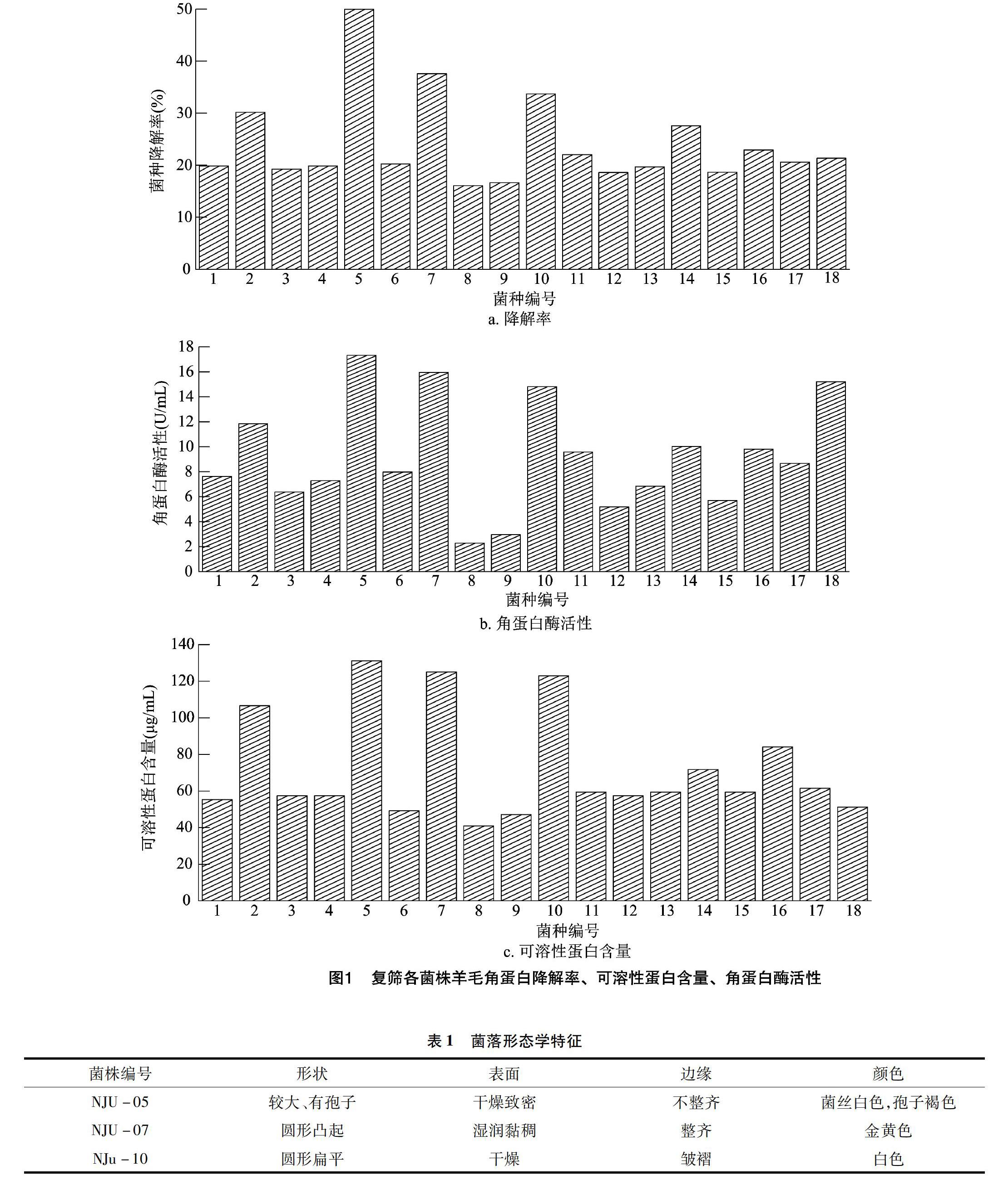
初筛获得的18株菌进一步发酵后,取发酵上清液测定可溶性蛋白含量,以及角蛋白酶活性。同时取滤渣烘干、称质量,测定降解率。由图1可知,编号为5、7、10的菌株有相对较高的降解率。编号为5的菌株降解率接近50%;7、10号降解率分别为37.59%、33.7%,超过其他菌株的降解率。同时,可溶性蛋白含量和角蛋白酶活性测定结果显示5、7、10号菌株也表现出与降解率一致的结果,可溶性蛋白含量及角蛋白酶活性均高于其他菌株。5、7、10号菌株的发酵液中可溶性蛋白含量较高,均大于120μg/mL。因此本试验选取角蛋白降解能力较高的3株菌5、7、10号作进一步研究,并将其命名为NJU-05、NJU-07、NJU-10。
2.2菌种鉴定结果
由表1可知,NJU-05油镜下观察菌丝发达,产孢子,为革兰氏阳性菌;NJU-07菌体呈杆状,无芽孢,为革兰氏阴性菌;NJU-10菌体细胞呈短棒状或杆状,两端为圆弧形,产椭圆形芽孢,革兰氏染色后菌体呈紫色,为革兰氏阳性菌。
16SrDNA测序结果与GenBank数据库中发表的序列进行相似性比对后发现,该序列与天蓝色链霉菌(Streptomycescoelicolor)A3(2)染色体相似性高达97%。NJU-07与黄杆菌科细菌(Flavobacteriaceaebacterium)3519-10同源性达到96%,GnenBank登录号为NC_013062.1。16SrDNA测序结果显示,NJU-10的16SrDNA基因约1.5kb,GenBank的登录号为NC006322.1。序列比较分析显示NJU10与地衣芽孢杆菌(Bacilluslicheniformis)相似性达99%。
结合菌落形态及16srDNA的鉴定结果,认定NJU-05为链霉菌,NJU-07为金黄杆菌属菌株,NJU-10为地衣芽孢杆菌。
2.3液体发酵工艺优化
2.3.1培養温度对液体发酵的影响
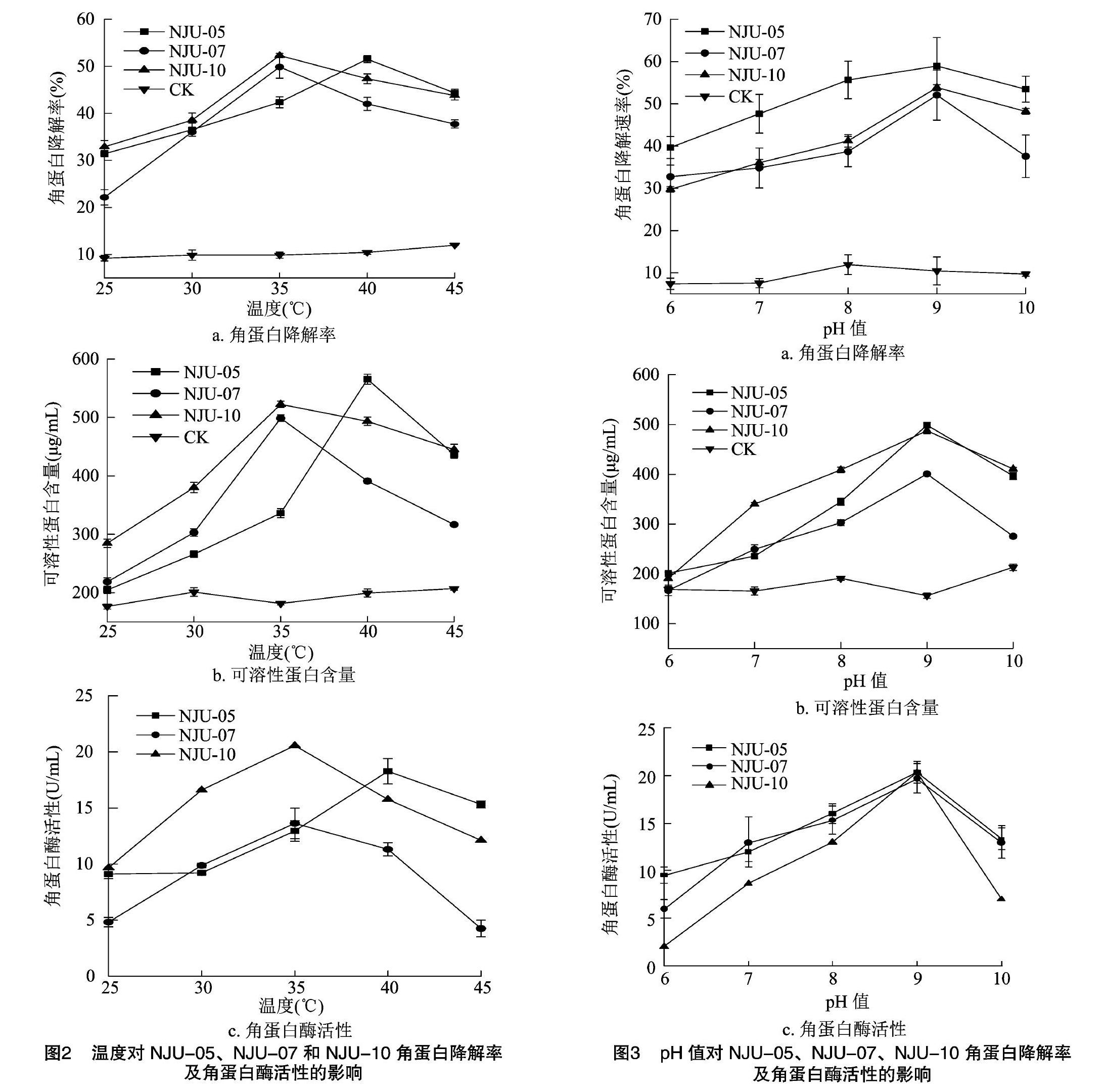
由图2可知,与对照组相比,NJU-05、NJU-07、NJU-10菌株随发酵温度升高角蛋白降解率逐渐上升,在温度为35℃时,NJU-07、NJU-10降解率达到最高;在40℃时,NJU-05降解率达到最高。可溶性蛋白含量、角蛋白酶活性随着温度升高的变化趋势与降解率一致。说明NJU-07和NJU-10于35℃液体发酵的最适温度为35℃,NJU-05的最适温度为40℃。低于或高于最适温度,降解率、可溶性蛋白含量及酶活性均有所降低。
pH值也是影响液体发酵的一个重要因素。由图3可知,在一定的pH值范围内,随着培养基起始pH值的升高,3株菌的降解率、可溶性蛋白含量及酶活性逐渐增加,pH值为9.0时,对3株菌所测定的3个指标均达到峰值,表明它们所产的角蛋白酶是碱性蛋白酶,且较高的碱性条件还能抑制杂菌生长。但过酸或过碱环境均会影响它们的角蛋白降解能力。
2.3.2发酵周期确定
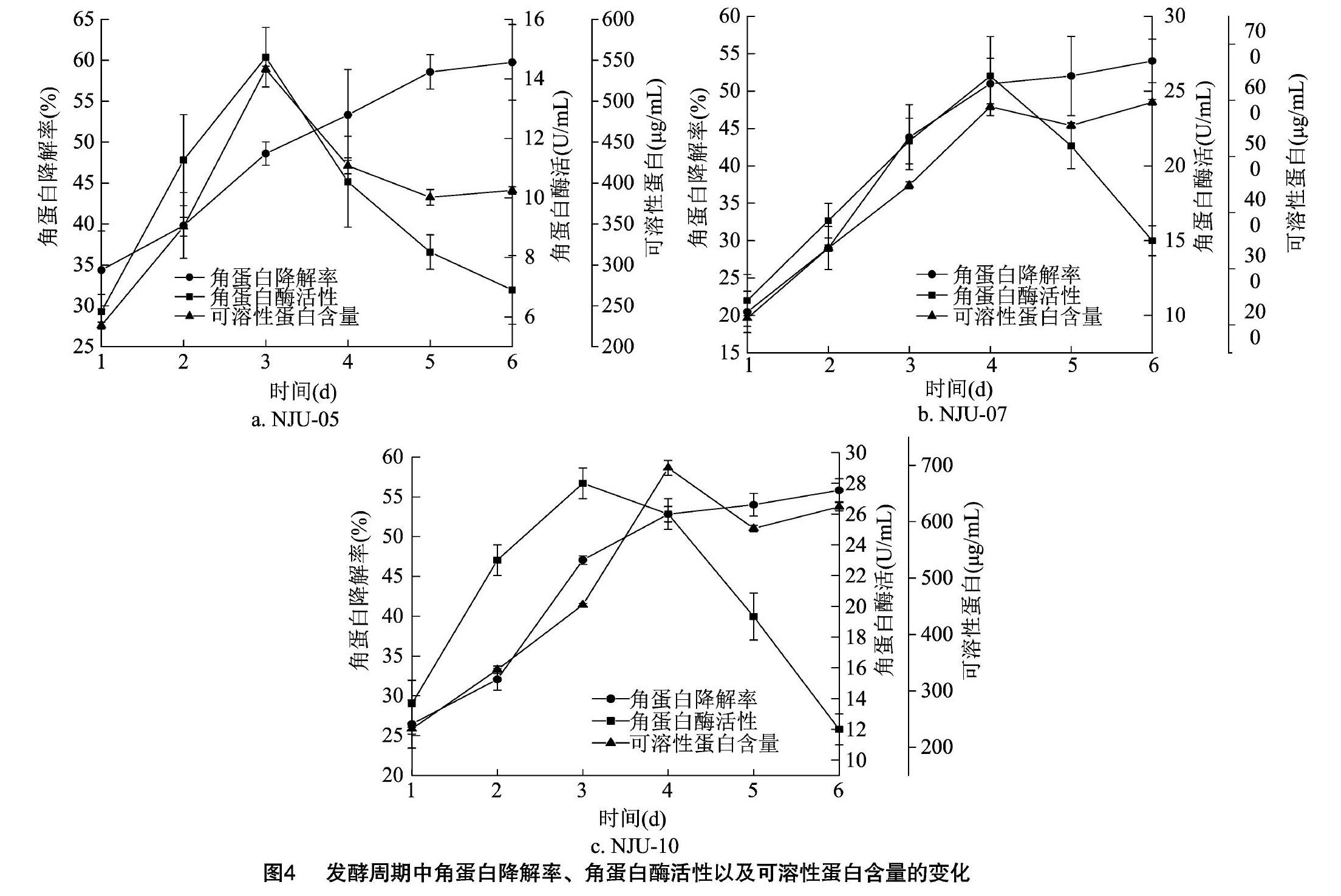
由优化试验可知所筛选出的3株菌在实验室水平下液体发酵的最优条件,其中NJU-05的培养温度为40℃,pH值为9.0;NJU-10的培养温度为35℃,pH值为9.0。在此培养条件下,确定发酵周期。由图4-a可知,NJU-05在发酵的前3d内,角蛋白酶活性及可溶性蛋白含量随着时间的推移逐渐增多,在发酵后3d均达到最大值,[KG*8]从发酵后4d起两者又逐渐下降,这可能是由于细菌生长受到环境和资源的抑制。角蛋白降解率从发酵后的1~6d呈持续上升趋势,在发酵2~3d时,增幅最大,而后的几天在此基础上虽继续降解,但增幅有所减小。所以,发酵周期以3d为宜。
由图4-b可知,随着发酵时间的延长,NJU-07的各项指标均在增加,在发酵4d时,角蛋白酶活性出现峰值,而后下降明显。可溶性蛋白含量在发酵4d时达到峰值。羊毛降解率在发酵前4d增幅均较明显,而在发酵5、6d时,增幅很小,所以,认为发酵时间为4d最合适。
由图4-c可知,在接入NJU-10后,角蛋白酶活性在发酵3d时出现峰值,发酵4d时略有下降,发酵5、6d下降明显。可溶性蛋白含量在发酵4d时增幅最大,且达到峰值。相应地,角蛋白降解率在发酵前4d增幅均较明显,而在发酵5、6d时,增幅均小于5%,此时再继续发酵已无多大意义。综合各因素,认为发酵时间为4d最合适。
3结论与讨论
从混有羊毛的土样中,经富集培养和筛选分离得到3株具有较强羊毛角蛋白降解能力的菌株NJU-05、NJU-07、NJU-10。本研究考察液体发酵温度和pH值对降解羊毛角蛋白的影响,以确定最优的发酵条件,获得较高的羊毛角蛋白降解率。通过以上试验表明,培养温度为40℃,培养基起始pH值为9.0,发酵3d时,NJU-05产酶能力最强,降解羊毛角蛋白的效果最优;NJU-07实验室水平的最佳液体发酵条件:温度为35℃,pH值为9.0,发酵周期为4d;最适宜NJU-10的液体发酵条件:温度为35℃,pH值为9.0,发酵周期为4d,降解率可达52.8%,在此条件下降解羊毛角蛋白最经济有效,且在液体发酵过程中也发现,角蛋白酶活性与可溶性蛋白含量的变化及角蛋白的降解率变化有一定的对应关系。
本研究为角蛋白废弃物的生物技术利用提供了理论依据。微生物降解羊毛为工业化利用开拓了更加经济的途径。如果将来能使微生物降解羊毛角蛋白形成一套系统工艺,角蛋白的循坏使用将实现,为此我们还需要对角蛋白酶进一步的纯化,并对其理化性质进一步的研究,后续工作还有待于进一步深入。
参考文献:
[1]YinJ,RastogiS,TerryAE,etal.Self-organizationofoligopeptidesobtainedondissolutionoffeatherkeratinsinsuperheatedwater[J].Biomacromolecules,2007,8(3):800-806.
[2]张念荣,王全杰,张琦,等.废弃羊毛角蛋白的资源化利用研究进展[J].西部皮革,2012,34(24):29-32.[HJ2.1mm]
[3]王慧玲,周彬.再生羽毛蛋白/PVA共混长丝仿毛面料设计与生产[J].毛纺科技,2015,43(9):10-13.
[4]WangLY,ChengGY,RenYX,etal.DegradationofintactchickenfeathersbyThermoactinomycessp.CDFandcharacterizationofitskeratinolyticprotease[J].AppliedMicrobiologyandBiotechnology,2015,99(9):3949-3959.
[5]GuptaR,RamnaniP.Microbialkeratinasesandtheirprospectiveapplications:anoverview[J].AppliedMicrobiologyandBiotechnology,2006,70(1):21-33.
[6]GousterovaA,BraikovaD,GoshevI,etal.Degradationofkeratinandcollagencontainingwastesbynewlyisolatedthermoactinomycetesorbyalkalinehydrolysis[J].LettersinAppliedMicrobiology,2005,40(5):335-340.
[7]董荣斌,张玲,朱晓飞,等.耐热链霉菌B221降解羽毛角蛋白的固体发酵条件研究[J].江苏农业科学,2007,35(6):249-251,267.
[8]TomarelliRM,CharneyJ,HardingML.Theuseofazoalbuminasasubstrateinthecolorimetricdeterminationorpepticandtrypticactivity[J].TheJournalofLaboratoryandClinicalMedicine,1949,34(3):428-433.
